Ligan. Pusat aktif protein dan interaksinya dengan ligan
Struktur modul | Tema |
Unit modular 1 | 1.1. Organisasi struktur protein. Peringkat pembentukan konformasi asli protein 1.2. Asas fungsi protein. Dadah sebagai ligan yang menjejaskan fungsi protein 1.3. Denaturasi Protein dan Kemungkinan Pembaharuan Spontan Mereka |
Unit modular 2 | 1.4. Ciri-ciri struktur dan fungsi protein oligomerik pada contoh hemoglobin 1.5. Mengekalkan konformasi asli protein dalam sel 1.6. Kepelbagaian protein. Keluarga protein pada contoh imunoglobulin 1.7. Sifat fiziko-kimia protein dan kaedah pemisahannya |
Unit modular 1 ORGANISASI STRUKTUR PROTEIN MONOMERIK DAN ASAS FUNGSINYA
Objektif pembelajaran Untuk dapat:
1. Gunakan pengetahuan tentang ciri-ciri struktur protein dan pergantungan fungsi protein pada strukturnya untuk memahami mekanisme perkembangan proteinopati keturunan dan diperolehi.
2. Terangkan mekanisme tindakan terapeutik ubat tertentu sebagai ligan yang berinteraksi dengan protein dan mengubah aktivitinya.
3. Gunakan pengetahuan tentang struktur dan labiliti konformasi protein untuk memahami ketidakstabilan struktur dan fungsinya serta kecenderungan untuk denaturasi dalam keadaan yang berubah-ubah.
4. Terangkan penggunaan agen denaturasi sebagai cara untuk mensterilkan bahan dan instrumen perubatan, serta antiseptik.
ketahui:
1. Tahap organisasi struktur protein.
2. Kepentingan struktur utama protein, yang menentukan kepelbagaian struktur dan fungsinya.
3. Mekanisme pembentukan dalam protein pusat aktif dan interaksi khusus dengan ligan, yang mendasari fungsi protein.
4. Contoh pengaruh ligan eksogen (ubat, toksin, racun) ke atas konformasi dan aktiviti fungsi protein.
5. Punca dan kesan denaturasi protein, faktor yang menyebabkan denaturasi.
6. Contoh penggunaan faktor denaturasi dalam perubatan sebagai antiseptik dan cara untuk mensterilkan alat perubatan.
TOPIK 1.1. ORGANISASI STRUKTUR PROTEIN. PERINGKAT MEMBENTUK ASLI
KONFORMASI PROTEIN
Protein ialah molekul polimer, monomernya hanya 20 asid α-amino. Set dan susunan sambungan asid amino dalam protein ditentukan oleh struktur gen dalam DNA individu. Setiap protein, mengikut struktur khususnya, melaksanakan fungsinya sendiri. Set protein organisma tertentu menentukan ciri fenotipnya, serta kehadiran penyakit keturunan atau kecenderungan untuk perkembangannya.
1. Asid amino yang membentuk protein. ikatan peptida. Protein adalah polimer yang dibina daripada monomer - 20 α-asid amino, formula am yang
Asid amino berbeza dalam struktur, saiz, sifat fizikokimia radikal yang melekat pada atom α-karbon. Kumpulan berfungsi asid amino menentukan ciri-ciri sifat asid α-amino yang berbeza. Radikal yang terdapat dalam asid α-amino boleh dibahagikan kepada beberapa kumpulan:
prolin, tidak seperti 19 monomer protein yang lain, bukan asid amino, tetapi asid imino, radikal dalam prolin dikaitkan dengan kedua-dua atom α-karbon dan kumpulan imino
 Asid amino berbeza dalam keterlarutannya dalam air. Ini disebabkan oleh keupayaan radikal untuk berinteraksi dengan air (untuk terhidrat).
Asid amino berbeza dalam keterlarutannya dalam air. Ini disebabkan oleh keupayaan radikal untuk berinteraksi dengan air (untuk terhidrat).
KEPADA hidrofilik termasuk radikal yang mengandungi kumpulan berfungsi anionik, kationik dan polar tidak bercas.
KEPADA hidrofobik termasuk radikal yang mengandungi kumpulan metil, rantai alifatik atau kitaran.
2. Ikatan peptida menghubungkan asid amino kepada peptida. Semasa sintesis peptida, kumpulan α-karboksil satu asid amino berinteraksi dengan kumpulan α-amino asid amino lain untuk membentuk ikatan peptida:
Protein adalah polipeptida, i.e. polimer linear asid α-amino yang disambungkan oleh ikatan peptida (Rajah 1.1.)
 nasi. 1.1. Istilah yang digunakan dalam menerangkan struktur peptida
nasi. 1.1. Istilah yang digunakan dalam menerangkan struktur peptida
Monomer asid amino yang membentuk polipeptida dipanggil sisa asid amino. Rangkaian kumpulan berulang - NH-CH-CO- borang tulang belakang peptida. Sisa asid amino yang mempunyai kumpulan α-amino bebas dipanggil N-terminal, dan satu yang mempunyai kumpulan α-carboxyl bebas dipanggil C-terminal. Peptida ditulis dan dibaca dari terminal-N ke terminal-C.
Ikatan peptida yang dibentuk oleh kumpulan imino prolin berbeza daripada ikatan peptida lain: atom nitrogen kumpulan peptida kekurangan hidrogen,
sebaliknya, terdapat ikatan dengan radikal, akibatnya, satu sisi kitaran dimasukkan ke dalam tulang belakang peptida:
 Peptida berbeza dalam komposisi asid amino, bilangan asid amino dan susunan asid amino, contohnya, Ser-Ala-Glu-Gis dan His-Glu-Ala-Ser ialah dua peptida yang berbeza.
Peptida berbeza dalam komposisi asid amino, bilangan asid amino dan susunan asid amino, contohnya, Ser-Ala-Glu-Gis dan His-Glu-Ala-Ser ialah dua peptida yang berbeza.
Ikatan peptida sangat kuat, dan hidrolisis bukan enzimatik kimianya memerlukan keadaan yang teruk: protein yang akan dianalisis dihidrolisiskan dalam asid hidroklorik pekat pada suhu kira-kira 110°C selama 24 jam. Dalam sel hidup, ikatan peptida boleh dipecahkan oleh enzim proteolitik, dipanggil protease atau hidrolase peptida.
3. Struktur utama protein. Sisa asid amino dalam rantai peptida protein yang berbeza tidak berselang-seli secara rawak, tetapi disusun dalam susunan tertentu. Urutan linear atau jujukan sisa asid amino dalam rantai polipeptida dipanggil struktur utama protein.
Struktur utama setiap protein individu dikodkan dalam molekul DNA (di rantau yang dipanggil gen) dan dilaksanakan semasa transkripsi (menulis semula maklumat pada mRNA) dan terjemahan (sintesis struktur utama protein). Akibatnya, struktur utama protein seseorang individu adalah maklumat yang diwarisi daripada ibu bapa kepada anak-anak yang menentukan ciri-ciri struktur protein organisma tertentu, di mana fungsi protein sedia ada bergantung (Rajah 1.2.).
 nasi. 1.2. Hubungan antara genotip dan konformasi protein yang disintesis dalam badan seseorang individu
nasi. 1.2. Hubungan antara genotip dan konformasi protein yang disintesis dalam badan seseorang individu
Setiap kira-kira 100,000 protein individu dalam tubuh manusia ada unik struktur primer. Molekul satu jenis protein (contohnya, albumin) mempunyai penggantian sisa asid amino yang sama, yang membezakan albumin daripada mana-mana protein individu lain.
Urutan sisa asid amino dalam rantai peptida boleh dianggap sebagai satu bentuk rakaman maklumat. Maklumat ini menentukan lipatan spatial rantai peptida linear ke dalam struktur tiga dimensi yang lebih padat yang dipanggil konformasi tupai. Proses pembentukan konformasi protein aktif berfungsi dipanggil melipat.
4. Konformasi protein. Putaran bebas dalam tulang belakang peptida adalah mungkin antara atom nitrogen kumpulan peptida dan atom α-karbon bersebelahan, serta antara atom α-karbon dan karbon kumpulan karbonil. Disebabkan oleh interaksi kumpulan berfungsi sisa asid amino, struktur utama protein boleh memperoleh struktur spatial yang lebih kompleks. Dalam protein globular, dua tahap utama lipatan konformasi rantai peptida dibezakan: menengah Dan struktur tertier.
struktur sekunder protein- ini adalah struktur ruang yang terbentuk hasil daripada pembentukan ikatan hidrogen antara kumpulan berfungsi -C=O dan -NH- tulang belakang peptida. Dalam kes ini, rantai peptida boleh memperoleh struktur biasa dua jenis: α-heliks Dan struktur β.
DALAM α-heliks ikatan hidrogen terbentuk antara atom oksigen kumpulan karbonil dan hidrogen amida nitrogen asid amino ke-4 daripadanya; rantai sampingan sisa asid amino
terletak di sepanjang pinggir heliks, tidak mengambil bahagian dalam pembentukan struktur sekunder (Rajah 1.3.).
Radikal besar atau radikal yang membawa cas yang sama menghalang pembentukan α-helix. Sisa prolin, yang mempunyai struktur cincin, mengganggu α-helix, kerana kerana kekurangan hidrogen pada atom nitrogen dalam rantai peptida, adalah mustahil untuk membentuk ikatan hidrogen. Ikatan antara nitrogen dan atom α-karbon adalah sebahagian daripada kitaran prolin, jadi tulang belakang peptida memperoleh selekoh di tempat ini.
β-Struktur terbentuk di antara kawasan linear tulang belakang peptida satu rantai polipeptida, dengan itu membentuk struktur terlipat. Rantai polipeptida atau bahagiannya boleh terbentuk selari atau struktur β antiselari. Dalam kes pertama, terminal N- dan C bagi rantai peptida yang berinteraksi bertepatan, dan dalam kes kedua, ia mempunyai arah yang bertentangan (Rajah 1.4).
nasi. 1.3. Struktur sekunder protein - α-helix
 nasi. 1.4. Struktur β-pleated selari dan antiselari
nasi. 1.4. Struktur β-pleated selari dan antiselari
β-struktur ditunjukkan oleh anak panah lebar: A - Antiparallel β-struktur. B - Struktur berlipat β selari
Dalam sesetengah protein, struktur β boleh terbentuk kerana pembentukan ikatan hidrogen antara atom tulang belakang peptida rantai polipeptida yang berbeza.
Juga terdapat dalam protein kawasan dengan sekunder yang tidak teratur struktur, yang termasuk lentur, gelung, pusingan tulang belakang polipeptida. Mereka selalunya terletak di tempat di mana arah rantai peptida berubah, contohnya, semasa pembentukan struktur β-lembaran selari.
Dengan kehadiran α-heliks dan β-struktur, protein globular boleh dibahagikan kepada empat kategori.
nasi. 1.5. Struktur sekunder myoglobin (A) dan hemoglobin β-chain (B), mengandungi lapan α-heliks
 nasi. 1.6. Struktur sekunder triose fosfat isomerase dan domain piruvat kinase
nasi. 1.6. Struktur sekunder triose fosfat isomerase dan domain piruvat kinase
 nasi. 1.7. Struktur sekunder domain pemalar imunoglobulin (A) dan enzim superoksida dismutase (B)
nasi. 1.7. Struktur sekunder domain pemalar imunoglobulin (A) dan enzim superoksida dismutase (B)
DALAM kategori keempat termasuk protein yang mempunyai dalam komposisinya sejumlah kecil struktur sekunder biasa. Protein ini termasuk protein kecil yang kaya dengan sistein atau metalloprotein.
Struktur tertier protein- sejenis konformasi yang terbentuk akibat interaksi antara radikal asid amino, yang boleh terletak pada jarak yang agak jauh antara satu sama lain dalam rantai peptida. Dalam kes ini, kebanyakan protein membentuk struktur spatial yang menyerupai globul (protein globular).
Oleh kerana radikal hidrofobik asid amino cenderung untuk bergabung dengan bantuan yang dipanggil interaksi hidrofobik dan daya antara molekul van der Waals, teras hidrofobik padat terbentuk di dalam globul protein. Radikal terion hidrofilik dan tidak terion terutamanya terletak pada permukaan protein dan menentukan keterlarutannya dalam air.
 nasi. 1.8. Jenis ikatan yang timbul antara radikal asid amino semasa pembentukan struktur tertier protein
nasi. 1.8. Jenis ikatan yang timbul antara radikal asid amino semasa pembentukan struktur tertier protein
1 - ikatan ion- berlaku antara kumpulan berfungsi bercas positif dan negatif;
2 - ikatan hidrogen- berlaku antara hidrofilik tidak bercas dan mana-mana kumpulan hidrofilik lain;
3 - interaksi hidrofobik- berlaku di antara radikal hidrofobik;
4 - ikatan disulfida- terbentuk kerana pengoksidaan kumpulan SH sisa sistein dan interaksi mereka antara satu sama lain
Sisa asid amino hidrofilik di dalam teras hidrofobik boleh berinteraksi antara satu sama lain menggunakan ionik Dan ikatan hidrogen(Gamb. 1.8).
Ikatan ionik dan hidrogen, serta interaksi hidrofobik, adalah antara yang lemah: tenaga mereka sedikit melebihi tenaga gerakan terma molekul pada suhu bilik. Konformasi protein dikekalkan dengan berlakunya banyak ikatan lemah tersebut. Oleh kerana atom-atom yang membentuk protein berada dalam gerakan yang berterusan, adalah mungkin untuk memecahkan beberapa ikatan lemah dan membentuk yang lain, yang membawa kepada pergerakan kecil bahagian individu rantai polipeptida. Sifat protein untuk mengubah konformasi akibat memecahkan beberapa dan membentuk ikatan lemah yang lain dipanggil labiliti konformasi.
Tubuh manusia mempunyai sistem yang menyokong homeostasis- keteguhan persekitaran dalaman dalam had tertentu yang boleh diterima untuk organisma yang sihat. Di bawah keadaan homeostasis, perubahan kecil dalam konformasi tidak mengganggu keseluruhan struktur dan fungsi protein. Konformasi aktif secara fungsional protein dipanggil konformasi asli. Perubahan dalam persekitaran dalaman (contohnya, kepekatan glukosa, ion Ca, proton, dll.) membawa kepada perubahan dalam bentuk dan gangguan fungsi protein.
Struktur tertier sesetengah protein distabilkan ikatan disulfida, dibentuk oleh interaksi kumpulan -SH dua residu
 nasi. 1.9. Pembentukan ikatan disulfida dalam molekul protein
nasi. 1.9. Pembentukan ikatan disulfida dalam molekul protein
sistein (Rajah 1.9). Kebanyakan protein intrasel tidak mempunyai ikatan disulfida kovalen dalam struktur tertiernya. Kehadiran mereka adalah ciri protein yang dirembeskan oleh sel, yang memastikan kestabilan mereka yang lebih besar dalam keadaan ekstraselular. Jadi, ikatan disulfida terdapat dalam molekul insulin dan imunoglobulin.
Insulin- hormon protein yang disintesis dalam sel-β pankreas dan dirembeskan ke dalam darah sebagai tindak balas kepada peningkatan kepekatan glukosa dalam darah. Dalam struktur insulin, terdapat dua ikatan disulfida yang menghubungkan polipeptida A- dan rantai B, dan satu ikatan disulfida di dalam rantai A (Rajah 1.10).
 nasi. 1.10. Ikatan disulfida dalam struktur insulin
nasi. 1.10. Ikatan disulfida dalam struktur insulin
5. Struktur super sekunder protein. Dalam protein berbeza dalam struktur dan fungsi primer, kadangkala gabungan serupa dan interposisi struktur sekunder, yang dipanggil struktur supersecondary. Ia menduduki kedudukan pertengahan antara struktur sekunder dan tertier, kerana ia adalah gabungan khusus unsur-unsur struktur sekunder semasa pembentukan struktur tertier protein. Struktur supersecondary mempunyai nama khusus seperti "α-helix-turn-a-helix", "zip leucine", "jari zink", dll. Struktur supersecondary sedemikian adalah ciri protein pengikat DNA.
"Zip Leucine". Struktur super sekunder jenis ini digunakan untuk menyambung dua protein. Pada permukaan protein yang berinteraksi terdapat kawasan α-heliks yang mengandungi sekurang-kurangnya empat sisa leucine. Sisa leucine dalam α-helix terletak enam asid amino selain antara satu sama lain. Oleh kerana setiap pusingan α-helix mengandungi 3.6 sisa asid amino, radikal leucine ditemui pada permukaan setiap pusingan kedua. Sisa leucine α-helix bagi satu protein boleh berinteraksi dengan sisa leucine protein lain (interaksi hidrofobik), menghubungkannya bersama-sama (Rajah 1.11.). Banyak protein pengikat DNA berfungsi sebagai sebahagian daripada kompleks oligomerik, di mana subunit individu dihubungkan antara satu sama lain dengan "zip leusin".
 nasi. 1.11. "Leucine zipper" antara kawasan α-heliks dua protein
nasi. 1.11. "Leucine zipper" antara kawasan α-heliks dua protein
Histon adalah contoh protein tersebut. Sejarah- protein nuklear, yang termasuk sejumlah besar asid amino bercas positif - arginin dan lisin (sehingga 80%). Molekul histon digabungkan menjadi kompleks oligomerik yang mengandungi lapan monomer dengan bantuan "pengikat leusin", walaupun terdapat cas homonim yang ketara bagi molekul ini.
"Jari Zink"- varian struktur supersecondary, ciri protein pengikat DNA, mempunyai bentuk serpihan memanjang pada permukaan protein dan mengandungi kira-kira 20 sisa asid amino (Rajah 1.12). Bentuk "jari teregang" disokong oleh atom zink yang dikaitkan dengan empat radikal asid amino - dua sisa sistein dan dua sisa histidin. Dalam sesetengah kes, bukannya sisa histidin, terdapat sisa sistein. Dua sisa sistein yang jaraknya rapat dipisahkan daripada dua sisa Gisili yang lain dengan urutan Cys yang mengandungi kira-kira 12 sisa asid amino. Rantau protein ini membentuk α-helix, radikal yang boleh mengikat secara khusus pada kawasan pengawalseliaan alur utama DNA. Kekhususan pengikatan seseorang individu
 nasi. 1.12. Struktur utama bahagian protein pengikat DNA yang membentuk struktur "jari zink" (huruf menunjukkan asid amino yang membentuk struktur ini)
nasi. 1.12. Struktur utama bahagian protein pengikat DNA yang membentuk struktur "jari zink" (huruf menunjukkan asid amino yang membentuk struktur ini)
protein pengikat DNA kawal selia bergantung pada urutan sisa asid amino yang terletak di "jari zink". Struktur sedemikian mengandungi, khususnya, reseptor untuk hormon steroid yang terlibat dalam peraturan transkripsi (membaca maklumat daripada DNA ke RNA).
TOPIK 1.2. ASAS BERFUNGSI PROTEIN. DADAH SEBAGAI LIGAN YANG MEMPENGARUHI FUNGSI PROTEIN
1. Pusat aktif protein dan interaksinya dengan ligan. Semasa pembentukan struktur tertier, pada permukaan protein aktif berfungsi, biasanya dalam reses, tapak terbentuk dibentuk oleh radikal asid amino yang berjauhan dalam struktur primer. Tapak ini, yang mempunyai struktur unik untuk protein tertentu dan mampu berinteraksi secara khusus dengan molekul tertentu atau sekumpulan molekul yang serupa, dipanggil tapak pengikat protein dengan ligan atau tapak aktif. Ligan ialah molekul yang berinteraksi dengan protein.
Kekhususan yang tinggi Interaksi protein dengan ligan dipastikan oleh pelengkap struktur pusat aktif dengan struktur ligan.
saling melengkapi ialah korespondensi spatial dan kimia bagi permukaan yang berinteraksi. Pusat aktif bukan sahaja mesti sesuai secara spasial dengan ligan yang termasuk di dalamnya, tetapi ikatan (interaksi ionik, hidrogen, dan hidrofobik) juga mesti terbentuk antara kumpulan berfungsi radikal yang termasuk dalam pusat aktif dan ligan, yang mengekalkan ligan dalam pusat aktif (Rajah 1.13).
 nasi. 1.13. Interaksi pelengkap protein dengan ligan
nasi. 1.13. Interaksi pelengkap protein dengan ligan
Sesetengah ligan, apabila dilekatkan pada pusat aktif protein, memainkan peranan tambahan dalam fungsi protein. Ligan sedemikian dipanggil kofaktor, dan protein yang mempunyai bahagian bukan protein dalam komposisinya dipanggil protein kompleks(berbeza dengan protein ringkas, hanya terdiri daripada bahagian protein). Bahagian bukan protein yang melekat kuat pada protein dipanggil kumpulan prostetik. Sebagai contoh, komposisi mioglobin, hemoglobin dan sitokrom mengandungi kumpulan prostetik yang melekat kuat pada pusat aktif - heme yang mengandungi ion besi. Protein kompleks yang mengandungi heme dipanggil hemoprotein.
Apabila ligan tertentu dilekatkan pada protein, fungsi protein ini ditunjukkan. Oleh itu, albumin, protein terpenting dalam plasma darah, mempamerkan fungsi pengangkutannya dengan melekatkan ligan hidrofobik ke pusat aktif, seperti asid lemak, bilirubin, beberapa ubat, dsb. (Gamb. 1.14)
Ligan yang berinteraksi dengan struktur tiga dimensi rantai peptida bukan sahaja boleh menjadi molekul organik dan bukan organik dengan berat molekul rendah, tetapi juga makromolekul:
DNA (contoh yang dibincangkan di atas dengan protein pengikat DNA);
Polisakarida;
 nasi. 1.14. Hubungan antara genotip dan fenotip
nasi. 1.14. Hubungan antara genotip dan fenotip
Struktur utama unik protein manusia, yang dikodkan dalam molekul DNA, direalisasikan dalam sel dalam bentuk konformasi unik, struktur tapak aktif, dan fungsi protein.
Dalam kes ini, protein mengiktiraf kawasan tertentu ligan yang sepadan dengan dan pelengkap kepada tapak mengikat. Jadi pada permukaan hepatosit terdapat protein reseptor untuk hormon insulin, yang juga mempunyai struktur protein. Interaksi insulin dengan reseptor menyebabkan perubahan dalam bentuk dan pengaktifan sistem isyarat, yang membawa kepada pengumpulan nutrien dalam hepatosit selepas makan.
Dengan cara ini, Fungsi protein adalah berdasarkan interaksi khusus pusat aktif protein dengan ligan.
2. Struktur domain dan peranannya dalam fungsi protein. Rantaian polipeptida panjang protein globular sering kali terlipat menjadi beberapa kawasan yang padat dan agak bebas. Mereka mempunyai struktur tertier bebas, menyerupai protein globular, dan dipanggil domain. Oleh kerana struktur domain protein, struktur tertiernya lebih mudah dibentuk.
Dalam protein domain, tapak pengikat ligan selalunya terletak di antara domain. Jadi, trypsin adalah enzim proteolitik yang dihasilkan oleh bahagian eksokrin pankreas dan diperlukan untuk pencernaan protein makanan. Ia mempunyai struktur dua domain, dan tapak pengikat trypsin dengan ligannya - protein makanan - terletak di alur antara dua domain. Di pusat aktif, keadaan yang diperlukan untuk pengikatan berkesan tapak tertentu protein makanan dan hidrolisis ikatan peptidanya dicipta.
Domain yang berbeza dalam protein boleh bergerak secara relatif antara satu sama lain apabila pusat aktif berinteraksi dengan ligan (Rajah 1.15).
Hexokinase- enzim yang memangkinkan fosforilasi glukosa dengan bantuan ATP. Tapak aktif enzim terletak di celah antara dua domain. Apabila heksokinase mengikat glukosa, domain di sekelilingnya tertutup dan substrat terperangkap, di mana fosforilasi berlaku (lihat Rajah 1.15).
 nasi. 1.15. Pengikatan domain hexokinase kepada glukosa
nasi. 1.15. Pengikatan domain hexokinase kepada glukosa
Dalam sesetengah protein, domain melakukan fungsi bebas dengan mengikat pelbagai ligan. Protein sedemikian dipanggil pelbagai fungsi.
3. Dadah - ligan yang menjejaskan fungsi protein. Interaksi protein dengan ligan adalah khusus. Walau bagaimanapun, disebabkan labiliti konformasi protein dan tapak aktifnya, adalah mungkin untuk memilih bahan lain yang juga boleh berinteraksi dengan protein dalam tapak aktif atau bahagian lain molekul.
Bahan yang mempunyai struktur yang serupa dengan ligan semula jadi dipanggil analog struktur ligan atau ligan yang tidak semulajadi. Ia juga berinteraksi dengan protein dalam tapak aktif. Analog struktur ligan boleh meningkatkan fungsi protein (agonis) dan mengurangkannya (antagonis). Ligan dan analog strukturnya bersaing antara satu sama lain untuk mengikat protein di tapak yang sama. Bahan sedemikian dipanggil modulator kompetitif(pengawal selia) fungsi protein. banyak ubat-ubatan bertindak sebagai perencat protein. Sebahagian daripadanya diperoleh melalui pengubahsuaian kimia ligan semula jadi. Inhibitor fungsi protein boleh menjadi ubat dan racun.
Atropin adalah perencat kompetitif reseptor M-cholinergik. Acetylcholine ialah neurotransmitter untuk penghantaran impuls saraf melalui sinaps kolinergik. Untuk menjalankan pengujaan, asetilkolin yang dilepaskan ke dalam celah sinaptik mesti berinteraksi dengan protein - reseptor membran postsynaptic. Dua jenis ditemui reseptor kolinergik:
M-reseptor sebagai tambahan kepada asetilkolin, ia secara selektif berinteraksi dengan muscarine (toksin agaric terbang). M - reseptor kolinergik terdapat pada otot licin dan, apabila berinteraksi dengan asetilkolin, menyebabkan penguncupan mereka;
H-reseptor mengikat secara khusus kepada nikotin. Reseptor N-kolinergik terdapat dalam sinaps striated otot rangka.
perencat tertentu Reseptor M-kolinergik ialah atropin. Ia ditemui dalam tumbuhan belladonna dan henbane.
 Atropine mempunyai kumpulan berfungsi dan susunan ruangnya serupa dengan asetilkolin dalam strukturnya, oleh itu ia tergolong dalam perencat kompetitif reseptor M-kolinergik. Memandangkan pengikatan asetilkolin kepada reseptor M-kolinergik menyebabkan pengecutan otot licin, atropin digunakan sebagai ubat yang melegakan kekejangan mereka. (antispasmodik). Oleh itu, diketahui penggunaan atropin untuk melegakan otot mata apabila melihat fundus, serta melegakan kekejangan dalam kolik gastrousus. Reseptor M-kolinergik juga terdapat di bahagian tengah sistem saraf(CNS), oleh itu, dos atropin yang besar boleh menyebabkan tindak balas yang tidak diingini daripada sistem saraf pusat: pergolakan motor dan mental, halusinasi, sawan.
Atropine mempunyai kumpulan berfungsi dan susunan ruangnya serupa dengan asetilkolin dalam strukturnya, oleh itu ia tergolong dalam perencat kompetitif reseptor M-kolinergik. Memandangkan pengikatan asetilkolin kepada reseptor M-kolinergik menyebabkan pengecutan otot licin, atropin digunakan sebagai ubat yang melegakan kekejangan mereka. (antispasmodik). Oleh itu, diketahui penggunaan atropin untuk melegakan otot mata apabila melihat fundus, serta melegakan kekejangan dalam kolik gastrousus. Reseptor M-kolinergik juga terdapat di bahagian tengah sistem saraf(CNS), oleh itu, dos atropin yang besar boleh menyebabkan tindak balas yang tidak diingini daripada sistem saraf pusat: pergolakan motor dan mental, halusinasi, sawan.
Ditilin adalah agonis kompetitif reseptor H-kolinergik yang menghalang fungsi sinaps neuromuskular.
 Sinaps neuromuskular otot rangka mengandungi reseptor H-kolinergik. Interaksi mereka dengan asetilkolin membawa kepada pengecutan otot. Dalam beberapa operasi pembedahan, serta dalam kajian endoskopik, ubat-ubatan digunakan yang menyebabkan kelonggaran otot rangka. (penahan otot). Ini termasuk dithylin, yang merupakan analog struktur asetilkolin. Ia melekat pada reseptor H-kolinergik, tetapi tidak seperti asetilkolin, ia dimusnahkan dengan perlahan oleh enzim acetylcholinesterase. Akibat pembukaan saluran ion yang berpanjangan dan depolarisasi membran yang berterusan, pengaliran impuls saraf terganggu dan kelonggaran otot berlaku. Pada mulanya, sifat-sifat ini ditemui dalam racun curare, oleh itu ubat-ubatan tersebut dipanggil curariform.
Sinaps neuromuskular otot rangka mengandungi reseptor H-kolinergik. Interaksi mereka dengan asetilkolin membawa kepada pengecutan otot. Dalam beberapa operasi pembedahan, serta dalam kajian endoskopik, ubat-ubatan digunakan yang menyebabkan kelonggaran otot rangka. (penahan otot). Ini termasuk dithylin, yang merupakan analog struktur asetilkolin. Ia melekat pada reseptor H-kolinergik, tetapi tidak seperti asetilkolin, ia dimusnahkan dengan perlahan oleh enzim acetylcholinesterase. Akibat pembukaan saluran ion yang berpanjangan dan depolarisasi membran yang berterusan, pengaliran impuls saraf terganggu dan kelonggaran otot berlaku. Pada mulanya, sifat-sifat ini ditemui dalam racun curare, oleh itu ubat-ubatan tersebut dipanggil curariform.
TOPIK 1.3. DENATURASI PROTEIN DAN KEMUNGKINAN PEMULIHAN SPONTAN MEREKA
1. Oleh kerana konformasi asli protein dikekalkan disebabkan oleh interaksi yang lemah, perubahan dalam komposisi dan sifat persekitaran yang mengelilingi protein, kesan reagen kimia dan faktor fizikal menyebabkan perubahan dalam bentuknya (sifat labiliti konformasi). Pecahnya sejumlah besar ikatan membawa kepada pemusnahan konformasi asli dan denaturasi protein.
Denaturasi protein- ini adalah pemusnahan konformasi asli mereka di bawah tindakan agen denaturasi, yang disebabkan oleh pemecahan ikatan lemah yang menstabilkan struktur spatial protein. Denaturasi disertai dengan pemusnahan struktur tiga dimensi unik dan pusat aktif protein dan kehilangan aktiviti biologinya (Rajah 1.16).
Semua molekul denaturasi satu protein memperoleh konformasi rawak yang berbeza daripada molekul lain protein yang sama. Radikal asid amino yang membentuk pusat aktif ternyata berjauhan secara ruang antara satu sama lain, i.e. tapak pengikatan spesifik protein dengan ligan dimusnahkan. Semasa denaturasi, struktur utama protein kekal tidak berubah.
Penggunaan agen denaturing dalam penyelidikan biologi dan perubatan. Dalam kajian biokimia, sebelum penentuan sebatian berat molekul rendah dalam bahan biologi, protein biasanya dikeluarkan daripada larutan terlebih dahulu. Untuk tujuan ini, asid trichloroacetic (TCA) paling kerap digunakan. Selepas menambahkan TCA ke dalam larutan, protein yang didenaturasi memendakan dan mudah dikeluarkan melalui penapisan (Jadual 1.1.)
Dalam bidang perubatan, agen denaturasi sering digunakan untuk mensterilkan instrumen dan bahan perubatan dalam autoklaf (agen pendenatur - suhu tinggi) dan sebagai antiseptik (alkohol, fenol, kloramine) untuk merawat permukaan tercemar yang mengandungi mikroflora patogenik.
2. Penjanaan semula protein secara spontan- bukti penentuan struktur utama, konformasi dan fungsi protein. Protein individu adalah produk daripada satu gen yang mempunyai urutan asid amino yang sama dan memperoleh konformasi yang sama dalam sel. Kesimpulan asas bahawa struktur utama protein sudah mengandungi maklumat tentang konformasi dan fungsinya dibuat berdasarkan keupayaan beberapa protein (khususnya, ribonuclease dan myoglobin) untuk renativasi spontan - pemulihan konformasi asli mereka selepas denaturasi.
Pembentukan struktur spatial protein dilakukan dengan kaedah pemasangan sendiri - proses spontan di mana rantai polipeptida, yang mempunyai struktur primer yang unik, cenderung untuk mengambil dalam penyelesaian konformasi dengan terkecil. tenaga percuma. Keupayaan untuk menjana semula protein yang mengekalkan struktur utamanya selepas denaturasi diterangkan dalam eksperimen dengan enzim ribonuclease.
Ribonuclease ialah enzim yang memecahkan ikatan antara nukleotida individu dalam molekul RNA. Protein globular ini mempunyai satu rantai polipeptida, struktur tertiernya distabilkan oleh banyak ikatan lemah dan empat ikatan disulfida.
Rawatan ribonuclease dengan urea, yang memecahkan ikatan hidrogen dalam molekul, dan agen penurunan, yang memecahkan ikatan disulfida, membawa kepada denaturasi enzim dan kehilangan aktivitinya.
Penyingkiran agen denaturasi melalui dialisis membawa kepada pemulihan bentuk dan fungsi protein, i.e. untuk menghidupkan semula. (Gamb. 1.17).
 nasi. 1.17. Denaturasi dan renativasi ribonuklease
nasi. 1.17. Denaturasi dan renativasi ribonuklease
A - konformasi asli ribonuclease, dalam struktur tertier yang terdapat empat ikatan disulfida; B - molekul ribonuklease tedenaturasi;
B - molekul ribonuklease renatif dengan struktur dan fungsi yang dipulihkan
1. Lengkapkan jadual 1.2.
Jadual 1.2. Pengelasan asid amino mengikut kekutuban radikal
2. Tulis formula tetrapeptida:
Asp - Pro - Fen - Liz
a) asingkan kumpulan berulang dalam peptida yang membentuk tulang belakang peptida dan kumpulan pembolehubah yang diwakili oleh radikal asid amino;
b) menetapkan N- dan C-termini;
c) gariskan ikatan peptida;
d) tulis peptida lain yang terdiri daripada asid amino yang sama;
e) mengira nombor pilihan tetrapeptida dengan komposisi asid amino yang sama.
3. Terangkan peranan struktur utama protein menggunakan contoh analisis perbandingan dua hormon peptida yang hampir sama struktur dan evolusinya bagi neurohypophysis mamalia - oxytocin dan vasopressin (Jadual 1.3).
Jadual 1.3. Struktur dan fungsi oxytocin dan vasopressin
 Untuk ini:
Untuk ini:
a) bandingkan komposisi dan urutan asid amino kedua-dua peptida;
b) cari persamaan struktur utama kedua-dua peptida dan persamaan tindakan biologinya;
c) cari perbezaan dalam struktur kedua-dua peptida dan perbezaan dalam fungsinya;
d) membuat kesimpulan tentang pengaruh struktur utama peptida terhadap fungsinya.
4. Terangkan peringkat utama dalam pembentukan pembentukan protein globular (sekunder, struktur tertier, konsep struktur supersecondary). Nyatakan jenis ikatan yang terlibat dalam pembentukan struktur protein. Radikal asid amino yang manakah boleh mengambil bahagian dalam pembentukan interaksi hidrofobik, ion, ikatan hidrogen.
Berikan contoh.
5. Tentukan konsep "labiliti konformasi protein", nyatakan sebab kewujudannya dan kepentingannya.
6. Terangkan maksud frasa berikut: "Protein berfungsi berdasarkan interaksi khusus mereka dengan ligan", menggunakan istilah dan menerangkan maksudnya: konformasi protein, tapak aktif, ligan, pelengkap, fungsi protein.
7. Menggunakan salah satu contoh, terangkan apakah domain itu dan apakah peranannya dalam fungsi protein.
TUGASAN UNTUK KAWALAN DIRI
1. Tetapkan padanan.
Kumpulan berfungsi dalam radikal asid amino:
A. Kumpulan karboksil B. Kumpulan hidroksil C Kumpulan guanidin D. Kumpulan tiol E. Kumpulan amino
2. Pilih jawapan yang betul.
Asid amino dengan radikal tidak bercas polar adalah:
A. Tsis B. Asn
B. Glu G. Tiga
3. Pilih jawapan yang betul.
Radikal asid amino:
A. Menyediakan kekhususan struktur primer B. Mengambil bahagian dalam pembentukan struktur tertier
B. Terletak di permukaan protein, ia menjejaskan keterlarutannya D. Membentuk pusat aktif
D. Mengambil bahagian dalam pembentukan ikatan peptida
4. Pilih jawapan yang betul.
Interaksi hidrofobik boleh terbentuk antara radikal asid amino:
A. Tre Lay B. Pro Tiga
B. Bertemu Ile G. Tir Ala D. Val Fen
5. Pilih jawapan yang betul.
Ikatan ionik boleh terbentuk antara radikal asid amino:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Angsa Asp D. Asn Apr
6. Pilih jawapan yang betul.
Ikatan hidrogen boleh terbentuk antara radikal asid amino:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Tetapkan padanan.
Jenis ikatan yang terlibat dalam pembentukan struktur protein:
A. Struktur primer B. Struktur sekunder
B. Struktur tertier
D. Struktur supersecondary E. Konformasi.
1. Ikatan hidrogen antara atom-atom tulang belakang peptida
2. Ikatan lemah antara kumpulan berfungsi radikal asid amino
3. Ikatan antara kumpulan α-amino dan α-karboksil asid amino
8. Pilih jawapan yang betul. Trypsin:
A. Enzim proteolitik B. Mengandungi dua domain
B. Menghidrolisis kanji
D. Pusat aktif terletak di antara domain. D. Terdiri daripada dua rantai polipeptida.
9. Pilih jawapan yang betul. Atropin:
A. Neurotransmitter
B. Analog struktur asetilkolin
B. Berinteraksi dengan reseptor H-kolinergik
G. Meningkatkan pengaliran impuls saraf melalui sinaps kolinergik
D. Perencat kompetitif reseptor M-kolinergik
10. Pilih pernyataan yang betul. Dalam protein:
A. Struktur utama mengandungi maklumat tentang struktur tapak aktifnya
B. Pusat aktif terbentuk pada tahap struktur primer
B. Konformasi ditetapkan secara tegar oleh ikatan kovalen
D. Tapak aktif boleh berinteraksi dengan sekumpulan ligan yang serupa
disebabkan oleh labiliti konformasi protein D. Perubahan persekitaran, boleh menjejaskan pertalian yang aktif
pusat kepada ligan
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
TERMA DAN KONSEP ASAS
1. Protein, polipeptida, asid amino
2. Struktur protein primer, sekunder, tertier
3. Konformasi, konformasi protein asli
4. Ikatan kovalen dan lemah dalam protein
5. labiliti konformasi
6. Tapak aktif protein
7. Ligan
8. Lipatan protein
9. Analog struktur ligan
10. Protein domain
11. Protein ringkas dan kompleks
12. Denaturasi protein, agen penyahwarna
13. Penjanaan semula protein
Selesaikan masalah
"Organisasi struktur protein dan asas fungsinya"
1. Fungsi utama protein - hemoglobin A (HbA) - adalah pengangkutan oksigen ke tisu. Dalam populasi manusia, pelbagai bentuk protein ini dengan sifat dan fungsi yang diubah dikenali - apa yang dipanggil hemoglobin tidak normal. Sebagai contoh, hemoglobin S yang terdapat dalam eritrosit pesakit dengan anemia sel sabit (HbS) didapati mempunyai keterlarutan yang rendah dalam keadaan tekanan separa oksigen yang rendah (seperti yang berlaku dalam darah vena). Ini membawa kepada pembentukan agregat protein ini. Protein kehilangan fungsinya, mendakan, dan eritrosit memperoleh bentuk tidak teratur(ada di antaranya membentuk bentuk sabit) dan musnah lebih cepat daripada biasa di dalam limpa. Akibatnya, anemia sel sabit berkembang.
Satu-satunya perbezaan dalam struktur utama HvA ditemui di kawasan terminal-N bagi rantai β hemoglobin. Bandingkan kawasan terminal-N bagi rantai-β dan tunjukkan bagaimana perubahan dalam struktur utama protein mempengaruhi sifat dan fungsinya.
 Untuk ini:
Untuk ini:
a) tulis formula asid amino yang berbeza dengan HvA dan bandingkan sifat asid amino ini (kekutuban, cas).
b) membuat kesimpulan tentang sebab penurunan keterlarutan dan pelanggaran pengangkutan oksigen dalam tisu.
2. Rajah menunjukkan gambar rajah struktur protein yang mempunyai pusat pengikat ligan (pusat aktif). Terangkan mengapa protein selektif dalam memilih ligan. Untuk ini:
a) ingat apakah pusat aktif protein itu, dan pertimbangkan struktur pusat aktif protein yang ditunjukkan dalam rajah;
b) tulis formula radikal asid amino yang membentuk pusat aktif;
c) lukis ligan yang secara khusus boleh berinteraksi dengan tapak aktif protein. Tunjukkan padanya kumpulan berfungsi yang mampu membentuk ikatan dengan radikal asid amino yang membentuk pusat aktif;
d) menunjukkan jenis ikatan yang timbul antara ligan dan radikal asid amino pusat aktif;
e) Terangkan asas bagi kekhususan interaksi protein dengan ligan.
 3.
Rajah menunjukkan tapak aktif protein dan beberapa ligan.
3.
Rajah menunjukkan tapak aktif protein dan beberapa ligan.
Tentukan ligan mana yang paling berkemungkinan berinteraksi dengan tapak aktif protein dan mengapa.
 Apakah jenis ikatan yang timbul semasa pembentukan kompleks protein-ligan?
Apakah jenis ikatan yang timbul semasa pembentukan kompleks protein-ligan?
4. Analog struktur ligan protein semulajadi boleh digunakan sebagai ubat untuk mengubah aktiviti protein.
Acetylcholine adalah mediator penghantaran pengujaan dalam sinaps neuromuskular. Apabila asetilkolin berinteraksi dengan protein - reseptor membran postsynaptic otot rangka, saluran ion terbuka dan penguncupan otot berlaku. Dithylin ialah ubat yang digunakan dalam beberapa operasi untuk mengendurkan otot, kerana ia mengganggu penghantaran impuls saraf melalui sinaps neuromuskular. Terangkan mekanisme tindakan ditilin sebagai ubat pelemas otot. Untuk ini:
a) tulis formula asetilkolin dan ditilin dan bandingkan strukturnya;
b) terangkan mekanisme tindakan mengendurkan ditilin.
5. Dalam sesetengah penyakit, suhu badan pesakit meningkat, yang dianggap sebagai tindak balas perlindungan badan. Walau bagaimanapun, suhu tinggi memudaratkan protein badan. Terangkan mengapa pada suhu melebihi 40 °C fungsi protein terganggu dan ancaman kepada kehidupan manusia timbul. Untuk melakukan ini, ingat:
1) Struktur protein dan ikatan yang memegang strukturnya dalam bentuk asli;
2) Bagaimanakah struktur dan fungsi protein berubah dengan peningkatan suhu?;
3) Apakah homeostasis dan mengapa penting untuk mengekalkan kesihatan manusia.
Unit modular 2 PROTEIN OLIGOMERIK SEBAGAI SASARAN UNTUK PENGARUH PENGAWALAN. PELBAGAI STRUKTUR DAN FUNGSI PROTEIN. KAEDAH PENGISIAN DAN PURIFIKASI PROTEIN
Objektif pembelajaran Untuk dapat:
1. Gunakan pengetahuan tentang ciri struktur dan fungsi protein oligomerik untuk memahami mekanisme penyesuaian fungsinya.
2. Terangkan peranan pendamping dalam sintesis dan pengekalan pembentukan protein dalam sel.
3. Untuk menerangkan kepelbagaian manifestasi kehidupan oleh kepelbagaian struktur dan fungsi protein yang disintesis dalam badan.
4. Menganalisis hubungan antara struktur protein dan fungsinya dengan membandingkan hemoprotein yang berkaitan - myoglobin dan hemoglobin, serta wakil lima kelas protein keluarga immunoglobulin.
5. Mengaplikasikan pengetahuan tentang ciri-ciri sifat fizikokimia protein untuk memilih kaedah penulenannya daripada protein dan kekotoran lain.
6. Mentafsir keputusan komposisi kuantitatif dan kualitatif protein plasma darah untuk mengesahkan atau menjelaskan diagnosis klinikal.
ketahui:
1. Ciri-ciri struktur protein oligomerik dan mekanisme penyesuaian peraturan fungsinya pada contoh hemoglobin.
2. Struktur dan fungsi chaperone dan kepentingannya untuk mengekalkan bentuk asli protein dalam sel.
3. Prinsip mengelompokkan protein kepada keluarga mengikut persamaan bentuk dan fungsinya pada contoh imunoglobulin.
4. Kaedah untuk pengasingan protein berdasarkan ciri sifat fizikokimianya.
5. Elektroforesis plasma darah sebagai kaedah untuk menilai komposisi kualitatif dan kuantitatif protein.
TOPIK 1.4. CIRI-CIRI STRUKTUR DAN FUNGSI PROTEIN OLIGOMERIK PADA CONTOH HEMOGLOBIN
1. Banyak protein mengandungi beberapa rantai polipeptida. Protein sedemikian dipanggil oligomerik, dan litar individu protomer. Protomer dalam protein oligomerik disambungkan oleh banyak ikatan bukan kovalen yang lemah (hidrofobik, ionik, hidrogen). Interaksi
protomer dijalankan terima kasih kepada saling melengkapi permukaan sentuhan mereka.
Bilangan protomer dalam protein oligomerik boleh berbeza-beza: hemoglobin mengandungi 4 protomer, enzim aspartat aminotransferase - 12 protomer, dan protein virus mozek tembakau termasuk 2120 protomer yang disambungkan oleh ikatan bukan kovalen. Oleh itu, protein oligomerik boleh mempunyai berat molekul yang sangat tinggi.
Interaksi satu protomer dengan yang lain boleh dianggap sebagai kes khas interaksi protein dengan ligan, kerana setiap protomer berfungsi sebagai ligan untuk protomer lain. Nombor dan kaedah sambungan protomer dalam protein dipanggil struktur protein kuartener.
Protein boleh mengandungi protomer dengan struktur yang sama atau berbeza, contohnya, homodimer ialah protein yang mengandungi dua protomer yang sama, dan heterodimer ialah protein yang mengandungi dua protomer berbeza.
Jika protein mengandungi protomer yang berbeza, maka pusat pengikatan dengan ligan berbeza yang berbeza dalam struktur boleh terbentuk padanya. Apabila ligan mengikat ke pusat aktif, fungsi protein ini ditunjukkan. Pusat yang terletak pada protomer yang berbeza dipanggil allosteric (selain daripada aktif). Menghubungi ligan alosterik atau efektor, ia melaksanakan fungsi pengawalseliaan (Rajah 1.18). Interaksi pusat alosterik dengan efektor menyebabkan perubahan konformasi dalam struktur keseluruhan protein oligomerik kerana labiliti konformasinya. Ini menjejaskan pertalian tapak aktif untuk ligan tertentu dan mengawal fungsi protein tersebut. Perubahan dalam bentuk dan fungsi semua protomer semasa interaksi protein oligomerik dengan sekurang-kurangnya satu ligan dipanggil perubahan konformasi kooperatif. Efektor yang meningkatkan fungsi protein dipanggil pengaktif dan efektor yang menekan fungsinya - perencat.
Oleh itu, dalam protein oligomerik, serta protein dengan struktur domain, sifat baru muncul berbanding dengan protein monomerik - keupayaan untuk mengawal fungsi allosterically (peraturan dengan melampirkan ligan yang berbeza pada protein). Ini dapat dilihat dengan membandingkan struktur dan fungsi dua protein kompleks yang berkait rapat iaitu mioglobin dan hemoglobin.
 nasi. 1.18. Gambar rajah struktur protein dimerik
nasi. 1.18. Gambar rajah struktur protein dimerik
2. Pembentukan struktur ruang dan fungsi myoglobin.
Myoglobin (Mb) adalah protein yang terdapat dalam otot merah, fungsi utamanya ialah penciptaan rizab O 2 yang diperlukan untuk kerja otot yang sengit. MB ialah protein kompleks yang mengandungi bahagian protein - apoMB dan bahagian bukan protein - heme. Struktur utama apoMB menentukan konformasi globular padatnya dan struktur pusat aktif, di mana bahagian bukan protein myoglobin, heme, dilampirkan. Oksigen dari darah ke otot mengikat Fe + 2 heme dalam komposisi myoglobin. MB adalah protein monomerik dengan pertalian yang sangat tinggi untuk O 2, oleh itu, oksigen dibebaskan oleh myoglobin hanya semasa kerja otot yang sengit, apabila tekanan separa O 2 berkurangan dengan mendadak.
Pembentukan konformasi MB. Dalam otot merah, pada ribosom semasa terjemahan, sintesis struktur utama MB, yang diwakili oleh urutan tertentu 153 sisa asid amino, berlaku. Struktur sekunder Mv mengandungi lapan α-heliks, dipanggil huruf Latin dari A hingga H, di antaranya terdapat bahagian tidak berspiral. Struktur tertier Mv mempunyai bentuk globul padat, di dalam ceruknya, antara F dan E α-heliks, terdapat pusat aktif (Rajah 1.19).
 nasi. 1.19. Struktur mioglobin
nasi. 1.19. Struktur mioglobin
3. Ciri-ciri struktur dan fungsi pusat aktif MV. Pusat aktif Mv dibentuk terutamanya oleh radikal asid amino hidrofobik yang berjauhan antara satu sama lain dalam struktur primer (contohnya, Tri 3 9 dan Phen 138) Ligan yang kurang larut dalam air, heme dan O 2, dilekatkan pada pusat aktif. Heme ialah ligan apoMv tertentu (Rajah 1.20), yang berasaskan empat gelang pirol yang disambungkan oleh jambatan methenyl; di tengah, terdapat atom Fe+ 2 yang disambungkan kepada atom nitrogen cincin pirol oleh empat ikatan koordinasi. Sebagai tambahan kepada radikal hidrofobik asid amino, pusat aktif Mv juga mengandungi sisa dua asid amino dengan radikal hidrofilik - Gis E 7(Gis 64) dan Gis F 8(Nya 93) (Rajah 1.21).
 nasi. 1.20. Struktur heme - bahagian bukan protein myoglobin dan hemoglobin
nasi. 1.20. Struktur heme - bahagian bukan protein myoglobin dan hemoglobin
 nasi. 1.21. Lokasi heme dan O 2 dalam tapak aktif apomyoglobin dan protomer hemoglobin
nasi. 1.21. Lokasi heme dan O 2 dalam tapak aktif apomyoglobin dan protomer hemoglobin
Heme terikat secara kovalen kepada F 8-Nya melalui atom besi. O 2 melekat pada seterika pada bahagian lain satah heme. E 7nya diperlukan untuk orientasi O 2 yang betul dan memudahkan penambahan oksigen kepada Fe + 2 heme
Gis F 8 membentuk ikatan koordinasi dengan Fe+ 2 dan menetap dengan kuat heme di pusat aktif. Gis E 7 adalah perlu untuk orientasi yang betul di pusat aktif ligan lain - O 2 semasa interaksinya dengan Fe + 2 heme. Persekitaran mikro heme mewujudkan keadaan untuk pengikatan kuat tetapi boleh balik O 2 dengan Fe + 2 dan menghalang air daripada memasuki pusat aktif hidrofobik, yang boleh menyebabkan pengoksidaannya kepada Fe + 3 .
Struktur monomerik MB dan pusat aktifnya menentukan pertalian tinggi protein untuk O 2 .
4. Struktur oligomerik Hb dan peraturan pertalian Hb untuk O 2 oleh ligan. Hemoglobin manusia- keluarga protein, serta myoglobin yang berkaitan dengan protein kompleks (hemoprotein). Mereka mempunyai struktur tetramerik dan mengandungi dua rantai α, tetapi berbeza dalam struktur dua rantai polipeptida yang lain (rantai 2α-, 2x). Struktur rantai polipeptida kedua menentukan ciri-ciri fungsi bentuk Hb ini. Kira-kira 98% daripada hemoglobin dalam eritrosit dewasa adalah hemoglobin A(2α-, 2p-rantai).
Semasa perkembangan janin, terdapat dua jenis hemoglobin utama: HB embrio(2α, 2ε), yang terdapat pada peringkat awal perkembangan janin, dan hemoglobin F (janin)- (2α, 2γ), yang menggantikan hemoglobin janin awal pada bulan keenam perkembangan janin dan digantikan oleh Hb A hanya selepas kelahiran.
Hv A ialah protein yang berkaitan dengan mioglobin (Mv) yang terdapat dalam eritrosit dewasa. Struktur protomer individunya adalah serupa dengan mioglobin. Struktur sekunder dan tersier bagi protomer mioglobin dan hemoglobin adalah sangat serupa, walaupun pada hakikatnya hanya 24 sisa asid amino yang sama dalam struktur utama rantai polipeptida mereka (struktur sekunder protomer hemoglobin, seperti mioglobin, mengandungi lapan α-heliks, dilambangkan dengan huruf Latin dari A hingga H , dan struktur tertier mempunyai bentuk globul padat). Tetapi tidak seperti mioglobin, hemoglobin mempunyai struktur oligomerik, terdiri daripada empat rantai polipeptida yang disambungkan oleh ikatan bukan kovalen (Rajah 1.22).
Setiap protomer Hb dikaitkan dengan bahagian bukan protein - heme dan protomer jiran. Sambungan bahagian protein Hb dengan heme adalah serupa dengan mioglobin: di pusat aktif protein, bahagian hidrofobik heme dikelilingi oleh radikal asid amino hidrofobik, kecuali His F 8 dan His E 7 , yang terletak di kedua-dua belah satah heme dan memainkan peranan yang sama dalam fungsi protein dan pengikatannya dengan oksigen (lihat struktur mioglobin).
 nasi. 1.22. Struktur oligomerik hemoglobin
nasi. 1.22. Struktur oligomerik hemoglobin
selain itu, Gis E 7 melaksanakan sesuatu yang penting peranan tambahan dalam fungsi NV. Heme bebas mempunyai pertalian 25,000 kali lebih tinggi untuk CO daripada untuk O 2 . CO terbentuk dalam jumlah yang kecil dalam badan dan, memandangkan pertalian tinggi untuk heme, ia boleh mengganggu pengangkutan O 2 yang diperlukan untuk kehidupan sel. Walau bagaimanapun, dalam komposisi hemoglobin, pertalian heme untuk karbon monoksida melebihi pertalian untuk O 2 sebanyak 200 kali sahaja kerana kehadiran E 7 dalam pusat aktif His. Baki asid amino ini mencipta keadaan optimum untuk mengikat heme dengan O 2 dan melemahkan interaksi heme dengan CO.
5. Fungsi utama Hb ialah pengangkutan O 2 dari paru-paru ke tisu. Tidak seperti myoglobin monomerik, yang mempunyai pertalian yang sangat tinggi untuk O 2 dan melaksanakan fungsi menyimpan oksigen dalam otot merah, struktur oligomerik hemoglobin menyediakan:
1) ketepuan cepat Hb dengan oksigen dalam paru-paru;
2) keupayaan Hb untuk membebaskan oksigen dalam tisu pada tekanan separa yang agak tinggi O 2 (20-40 mm Hg);
3) kemungkinan mengawal selia pertalian Hb kepada O 2 .
6. Perubahan kooperatif dalam bentuk protomer hemoglobin mempercepatkan pengikatan O 2 dalam paru-paru dan kembali ke tisu. Di dalam paru-paru, tekanan separa O2 yang tinggi menggalakkan pengikatannya kepada Hb di tapak aktif empat protomer (2α dan 2β). Pusat aktif setiap protomer, seperti dalam mioglobin, terletak di antara dua heliks α (F dan E) dalam poket hidrofobik. Ia mengandungi bahagian bukan protein - heme, dilekatkan pada bahagian protein oleh banyak interaksi hidrofobik yang lemah dan satu ikatan kuat antara Fe 2 + heme dan F 8 Nya (lihat Rajah 1.21).
Dalam deoksihemoglobin, disebabkan hubungan ini dengan F 8-Nya, atom Fe 2 + terkeluar dari satah heme ke arah histidin. Pengikatan O 2 kepada Fe 2 + berlaku pada bahagian lain heme di rantau His E 7 dengan bantuan ikatan koordinasi bebas tunggal. E 7-nya menyediakan keadaan optimum untuk pengikatan O 2 dengan besi heme.
Penambahan O 2 pada atom Fe +2 satu protomer menyebabkan ia bergerak ke dalam satah heme, dan di belakangnya sisa histidin yang berkaitan dengannya
 nasi. 1.23. Perubahan dalam bentuk protomer hemoglobin apabila digabungkan dengan O 2
nasi. 1.23. Perubahan dalam bentuk protomer hemoglobin apabila digabungkan dengan O 2
Ini membawa kepada perubahan dalam konformasi semua rantai polipeptida disebabkan oleh kebolehkonformasian mereka. Mengubah konformasi rantai lain memudahkan interaksinya dengan molekul O 2 seterusnya.
Molekul O 2 keempat melekat pada hemoglobin 300 kali lebih mudah daripada yang pertama (Rajah 1.24).
 nasi. 1.24. Perubahan koperatif dalam pembentukan protomer hemoglobin semasa interaksinya dengan O 2
nasi. 1.24. Perubahan koperatif dalam pembentukan protomer hemoglobin semasa interaksinya dengan O 2
Dalam tisu, setiap molekul O 2 berikutnya lebih mudah dipecahkan daripada yang sebelumnya, juga disebabkan oleh perubahan kerjasama dalam konformasi protomer.
7. CO 2 dan H +, yang terbentuk semasa katabolisme bahan organik, mengurangkan pertalian hemoglobin untuk O 2 mengikut kadar kepekatannya. Tenaga yang diperlukan untuk fungsi sel dihasilkan terutamanya dalam mitokondria semasa pengoksidaan bahan organik menggunakan O 2 yang dihantar dari paru-paru oleh hemoglobin. Hasil daripada pengoksidaan bahan organik, produk akhir pereputannya terbentuk: CO 2 dan K 2 O, yang jumlahnya berkadar dengan keamatan proses pengoksidaan yang berterusan.
CO 2 meresap dari sel ke dalam darah dan memasuki eritrosit, di mana, di bawah tindakan enzim carbanhydrase, ia bertukar menjadi asid karbonik. Asid lemah ini terurai menjadi proton dan ion bikarbonat.
H+ dapat menyertai radikal GIS 14 6 dalam rantai α- dan β hemoglobin, i.e. di kawasan yang jauh dari heme. Protonasi hemoglobin mengurangkan pertalian untuk O 2, menggalakkan penyingkiran O 2 daripada oksiHb, pembentukan deoksiHb, dan meningkatkan bekalan oksigen ke tisu mengikut perkadaran dengan bilangan proton yang terbentuk (Rajah 1.25).
Peningkatan jumlah oksigen yang dibebaskan bergantung kepada peningkatan kepekatan H + dalam eritrosit dipanggil kesan Bohr (selepas ahli fisiologi Denmark Christian Bohr, yang pertama kali menemui kesan ini).
Di dalam paru-paru, tekanan separa oksigen yang tinggi menggalakkan pengikatannya kepada deoksiHb, yang mengurangkan pertalian protein untuk H+. Proton yang dibebaskan di bawah tindakan carbanhydrase berinteraksi dengan bikarbonat untuk membentuk CO 2 dan H 2 O

 nasi. 1.25. Pergantungan pertalian Hb kepada O 2 pada kepekatan CO 2 dan proton (kesan Bohr):
nasi. 1.25. Pergantungan pertalian Hb kepada O 2 pada kepekatan CO 2 dan proton (kesan Bohr):
TAPI- pengaruh kepekatan CO 2 dan H+ pada pembebasan O 2 dari kompleks dengan Hb (kesan Bohr); B- pengoksigenan deoksihemoglobin dalam paru-paru, pembentukan dan pembebasan CO 2 .
CO 2 yang terhasil memasuki ruang alveolar dan dikeluarkan dengan udara yang dihembus. Oleh itu, jumlah oksigen yang dikeluarkan oleh hemoglobin dalam tisu dikawal oleh produk katabolisme bahan organik: semakin kuat pecahan bahan, contohnya, semasa melakukan senaman fizikal, semakin tinggi kepekatan CO 2 dan H + dan semakin banyak. oksigen yang diterima oleh tisu hasil daripada penurunan pertalian H kepada O 2.
8. Peraturan alosterik pertalian Hb untuk O 2 oleh ligan - 2,3-bifosfogliserat. Dalam eritrosit, ligan alosterik hemoglobin, 2,3-bisphosphoglycerate (2,3-BPG), disintesis daripada produk pengoksidaan glukosa - 1,3-bisphosphoglycerate. Dalam keadaan biasa, kepekatan 2,3-BPG adalah tinggi dan setanding dengan Hb. 2,3-BPG mempunyai cas negatif kuat -5.
 Bifosfogliserat dalam kapilari tisu, dengan mengikat deoksihemoglobin, meningkatkan pengeluaran oksigen dalam tisu, mengurangkan pertalian Hb kepada O 2 .
Bifosfogliserat dalam kapilari tisu, dengan mengikat deoksihemoglobin, meningkatkan pengeluaran oksigen dalam tisu, mengurangkan pertalian Hb kepada O 2 .
Terdapat rongga di tengah-tengah molekul hemoglobin tetramerik. Ia dibentuk oleh sisa asid amino keempat-empat protomer (lihat Rajah 1.22). Dalam kapilari tisu, protonasi Hb (kesan Bohr) memutuskan ikatan antara besi heme dan O 2 . Dalam molekul
deoxyhemoglobin, berbanding dengan oxyhemoglobin, ikatan ionik tambahan muncul yang menghubungkan protomer, akibatnya saiz rongga pusat meningkat berbanding dengan oksihemoglobin. Rongga pusat adalah tapak perlekatan 2,3-BPG kepada hemoglobin. Disebabkan oleh perbezaan saiz rongga pusat, 2,3-BPG hanya boleh melekat pada deoksihemoglobin.
2,3-BPG berinteraksi dengan hemoglobin di kawasan yang jauh dari tapak aktif protein dan kepunyaan alosterik ligan (kawal selia), dan rongga pusat Hb ialah pusat alosterik. 2,3-BPG mempunyai cas negatif yang kuat dan berinteraksi dengan lima kumpulan bercas positif dua rantai β Hb: kumpulan α-amino N-terminal Val dan radikal Lys 82 Gis 143 (Rajah 1.26).
 nasi. 1.26. BPG dalam rongga pusat deoksihemoglobin
nasi. 1.26. BPG dalam rongga pusat deoksihemoglobin
BPG mengikat kepada tiga kumpulan bercas positif dalam setiap β-strand.
Dalam kapilari tisu, deoksihemoglobin yang terhasil berinteraksi dengan 2,3-BPG, dan ikatan ionik terbentuk antara radikal bercas positif rantai β dan ligan bercas negatif, yang mengubah konformasi protein dan mengurangkan pertalian Hb untuk O 2 . Pengurangan dalam pertalian Hb untuk O 2 menyumbang kepada pembebasan O 2 yang lebih cekap ke dalam tisu.
Di dalam paru-paru, pada tekanan separa yang tinggi, oksigen berinteraksi dengan Hb, bergabung dengan besi heme; dalam kes ini, konformasi protein berubah, rongga pusat berkurangan, dan 2,3-BPG dialihkan dari pusat alosterik
Oleh itu, protein oligomerik mempunyai sifat baru berbanding dengan protein monomerik. Lekatan ligan di tapak,
berjauhan secara ruang antara satu sama lain (allosterik), mampu menyebabkan perubahan konformasi dalam keseluruhan molekul protein. Disebabkan oleh interaksi dengan ligan pengawalseliaan, perubahan konformasi dan fungsi molekul protein menyesuaikan diri dengan perubahan persekitaran.
TOPIK 1.5. PENYELENGGARAAN KONFORMASI ASLI PROTEIN DALAM KEADAAN SEL
Dalam sel, semasa sintesis rantai polipeptida, pengangkutannya melalui membran ke bahagian sel yang sepadan, dalam proses lipatan (pembentukan konformasi asli) dan semasa pemasangan protein oligomerik, serta semasa berfungsi, perantaraan. , mudah terkumpul, konformasi tidak stabil timbul dalam struktur protein. Radikal hidrofobik, biasanya tersembunyi di dalam molekul protein dalam konformasi asalnya, muncul di permukaan dalam konformasi yang tidak stabil dan cenderung untuk bergabung dengan kumpulan protein lain yang juga kurang larut dalam air. Dalam sel semua organisma yang diketahui, protein khas telah ditemui yang menyediakan lipatan optimum protein sel, menstabilkan konformasi asalnya semasa berfungsi, dan, yang paling penting, mengekalkan struktur dan fungsi protein intrasel jika berlaku gangguan homeostasis. Protein ini dipanggil "pendamping" yang bermaksud "pengasuh" dalam bahasa Perancis.
1. Pendamping molekul dan peranannya dalam mencegah denaturasi protein.
Chaperones (III) dikelaskan mengikut jisim subunit. Pendamping berat molekul tinggi mempunyai jisim 60 hingga 110 kD. Antaranya, tiga kelas paling banyak dipelajari: Sh-60, Sh-70 dan Sh-90. Setiap kelas termasuk keluarga protein yang berkaitan. Oleh itu, Sh-70 mengandungi protein dengan berat molekul 66 hingga 78 kD. Pendamping berat molekul rendah mempunyai berat molekul 40 hingga 15 kD.
Antara chaperone ada konstitutif protein yang sintesis basalnya tinggi tidak bergantung pada kesan tekanan pada sel-sel badan, dan boleh diinduksi, sintesis yang dalam keadaan normal adalah lemah, tetapi meningkat dengan mendadak di bawah pengaruh tekanan. Inducible chaperones juga dipanggil "protein kejutan haba" kerana ia pertama kali ditemui dalam sel yang terdedah kepada suhu tinggi. Dalam sel, disebabkan oleh kepekatan protein yang tinggi, penjanaan semula spontan protein separa denaturasi adalah sukar. Sh-70 boleh menghalang proses denaturasi yang telah bermula dan membantu memulihkan konformasi asli protein. Molekul pendamping-70- kelas protein yang sangat terpelihara yang terdapat di semua bahagian sel: sitoplasma, nukleus, retikulum endoplasma, mitokondria. Pada hujung karboksil satu-satunya rantai polipeptida Sh-70, terdapat kawasan yang merupakan alur yang boleh berinteraksi dengan peptida panjang.
daripada 7 hingga 9 sisa asid amino yang diperkaya dengan radikal hidrofobik. Tapak sedemikian dalam protein globular berlaku kira-kira setiap 16 asid amino. Sh-70 mampu melindungi protein daripada penyahaktifan terma dan memulihkan konformasi dan aktiviti protein yang telah didenatur separa.
2. Peranan chaperone dalam lipatan protein. Semasa sintesis protein pada ribosom, kawasan N-terminal polipeptida disintesis sebelum rantau C-terminal. Urutan asid amino lengkap protein diperlukan untuk membentuk konformasi asli. Dalam proses sintesis protein, chaperones-70, disebabkan oleh struktur pusat aktifnya, dapat menutup kawasan rawan pengagregatan polipeptida yang diperkaya dalam radikal asid amino hidrofobik sehingga sintesis selesai (Rajah 1.27, A).
 nasi. 1.27. Penglibatan pendamping dalam lipatan protein
nasi. 1.27. Penglibatan pendamping dalam lipatan protein
A - penyertaan chaperones-70 dalam pencegahan interaksi hidrofobik antara tapak polipeptida yang disintesis; B - pembentukan konformasi protein asli dalam kompleks pendamping
Banyak protein berat molekul tinggi dengan konformasi kompleks, seperti struktur domain, berlipat dalam ruang khas yang dibentuk oleh W-60. Sh-60 berfungsi sebagai kompleks oligomerik yang terdiri daripada 14 subunit. Mereka membentuk dua cincin berongga, setiap satunya terdiri daripada tujuh subunit, cincin ini disambungkan antara satu sama lain. Setiap subunit III-60 terdiri daripada tiga domain: apikal (apikal), diperkaya dengan radikal hidrofobik yang menghadap rongga cincin, perantaraan dan khatulistiwa (Rajah 1.28).
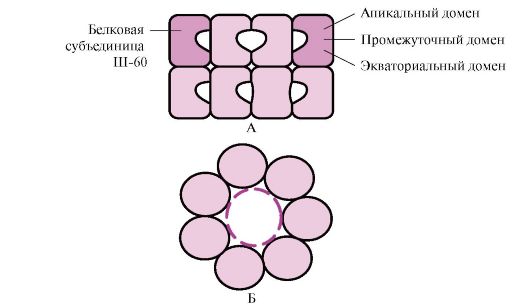 nasi. 1.28. Struktur kompleks chaperonin yang terdiri daripada 14 Sh-60
nasi. 1.28. Struktur kompleks chaperonin yang terdiri daripada 14 Sh-60
A - pandangan sisi; B - pandangan atas
Protein tersintesis dengan unsur permukaan yang bercirikan molekul terungkap, khususnya, radikal hidrofobik, memasuki rongga cincin pendamping. Dalam persekitaran khusus rongga ini, pengiraan konformasi yang mungkin berlaku sehingga satu-satunya, satu-satunya yang paling menguntungkan secara bertenaga ditemui (Rajah 1.27, B). Pembentukan konformasi dan pembebasan protein disertai oleh hidrolisis ATP di kawasan khatulistiwa. Biasanya, lipatan yang bergantung kepada pendamping memerlukan sejumlah besar tenaga.
Sebagai tambahan untuk mengambil bahagian dalam pembentukan struktur tiga dimensi protein dan renativasi protein yang didenatur separa, pendamping juga diperlukan untuk proses asas seperti pemasangan protein oligomerik, pengiktirafan dan pengangkutan protein yang didenaturasi ke dalam lisosom, pengangkutan protein. merentasi membran, dan penyertaan dalam pengawalseliaan aktiviti kompleks protein.
TOPIK 1.6. PELBAGAI PROTEIN. KELUARGA PROTEIN MENGENAI CONTOH IMMUNOGLOBULIN
1. Tupai bermain peranan yang menentukan dalam kehidupan sel-sel individu dan keseluruhan organisma multiselular, dan fungsi mereka sangat pelbagai. Ini ditentukan oleh keanehan struktur utama dan konformasi protein, struktur unik pusat aktif, dan keupayaan untuk mengikat ligan tertentu.
Hanya sebahagian kecil daripada semua kemungkinan varian rantai peptida boleh menggunakan struktur spatial yang stabil; majoriti
daripada mereka boleh mengambil banyak konformasi dengan lebih kurang tenaga Gibbs yang sama, tetapi dengan pelbagai sifat. Struktur utama protein yang paling terkenal, dipilih evolusi biologi, memberikan kestabilan yang luar biasa bagi salah satu konformasi, yang menentukan ciri-ciri fungsi protein ini.
2. Keluarga protein. Dalam spesies biologi yang sama, penggantian sisa asid amino boleh membawa kepada kemunculan protein berbeza yang menjalankan fungsi berkaitan dan mempunyai urutan asid amino homolog. Protein berkaitan ini mempunyai konformasi yang sangat serupa: bilangan dan susunan α-heliks dan/atau struktur β, dan kebanyakan lilitan dan lipatan rantai polipeptida adalah serupa atau serupa. Protein dengan kawasan homolog rantai polipeptida, konformasi serupa dan fungsi yang berkaitan diasingkan ke dalam keluarga protein. Contoh keluarga protein: proteinase serine, keluarga immunoglobulin, keluarga mioglobin.
Proteinase serin- keluarga protein yang melaksanakan fungsi enzim proteolitik. Ini termasuk enzim pencernaan - chymotrypsin, trypsin, elastase dan banyak faktor pembekuan darah. Protein ini mempunyai 40% asid amino yang sama dan bentuk yang sangat serupa (Rajah 1.29).

nasi. 1.29. Struktur spatial elastase (A) dan chymotrypsin (B)
Beberapa penggantian asid amino telah membawa kepada perubahan dalam kekhususan substrat protein ini dan kemunculan kepelbagaian fungsi dalam keluarga.
3. Keluarga imunoglobulin. Dalam kerja sistem imun peranan yang besar protein main dari superfamili immunoglobulin, yang merangkumi tiga keluarga protein:
Antibodi (imunoglobulin);
Reseptor T-limfosit;
Protein kompleks histokompatibiliti utama - MHC kelas 1 dan 2 (Kompleks Histokompatibiliti Utama).
Semua protein ini mempunyai struktur domain, terdiri daripada domain seperti imun homolog dan melakukan fungsi yang serupa: ia berinteraksi dengan struktur asing, sama ada larut dalam darah, limfa atau cecair antara sel (antibodi), atau terletak pada permukaan sel (sendiri atau asing).
4. Antibodi- protein khusus yang dihasilkan oleh B-limfosit sebagai tindak balas kepada pengambilan struktur asing yang dipanggil antigen.
Ciri-ciri struktur antibodi
Molekul antibodi yang paling mudah terdiri daripada empat rantai polipeptida: dua rantai ringan yang sama - L, mengandungi kira-kira 220 asid amino, dan dua rantai berat yang sama - H, yang terdiri daripada 440-700 asid amino. Kesemua empat rantai dalam molekul antibodi disambungkan oleh banyak ikatan bukan kovalen dan empat ikatan disulfida (Rajah 1.30).
Rantaian ringan antibodi terdiri daripada dua domain: pembolehubah (VL), terletak di kawasan terminal N rantai polipeptida, dan pemalar (CL), terletak di terminal C. Rantaian berat biasanya mempunyai empat domain: satu pembolehubah (VH) pada terminal-N dan tiga pemalar (CH1, CH2, CH3) (lihat Rajah 1.30). Setiap domain imunoglobulin mempunyai superstruktur β-pleated di mana dua sisa sistein dikaitkan dengan ikatan disulfida.
Di antara dua domain malar CH1 dan CH2 terdapat kawasan yang mengandungi sejumlah besar sisa prolin, yang menghalang pembentukan struktur sekunder dan interaksi rantai H jiran dalam segmen ini. Kawasan engsel ini memberikan fleksibiliti molekul antibodi. Di antara domain pembolehubah rantai berat dan ringan terdapat dua tapak pengikat antigen yang sama (tapak aktif untuk mengikat antigen), jadi antibodi seperti itu sering dipanggil. bivalen. Pengikatan antigen kepada antibodi tidak melibatkan keseluruhan jujukan asid amino bagi kawasan pembolehubah kedua-dua rantai, tetapi hanya 20-30 asid amino yang terletak di kawasan hipervariable setiap rantai. Kawasan inilah yang menentukan keupayaan unik setiap jenis antibodi untuk berinteraksi dengan antigen pelengkap yang sepadan.
Antibodi adalah salah satu garis pertahanan badan terhadap pencerobohan organisma asing. Fungsi mereka boleh dibahagikan kepada dua peringkat: peringkat pertama ialah pengiktirafan dan pengikatan antigen pada permukaan organisma asing, yang mungkin disebabkan oleh kehadiran tapak pengikat antigen dalam struktur antibodi; peringkat kedua ialah permulaan proses penyahaktifan dan pemusnahan antigen. Kekhususan peringkat kedua bergantung pada kelas antibodi. Terdapat lima kelas rantai berat yang berbeza antara satu sama lain dalam struktur domain tetap: α, δ, ε, γ dan μ, yang mana lima kelas imunoglobulin dibezakan: A, D, E, G dan M.
Ciri-ciri struktur rantai berat memberikan kawasan engsel dan kawasan terminal C bagi rantai berat satu ciri konformasi bagi setiap kelas. Sebaik sahaja antigen mengikat antibodi, perubahan konformasi dalam domain malar menentukan laluan untuk penyingkiran antigen.
 nasi. 1. 30. Struktur domain IgG
nasi. 1. 30. Struktur domain IgG
Imunoglobulin M
Imunoglobulin M mempunyai dua bentuk.
Bentuk monomerik- Antibodi kelas pertama yang dihasilkan oleh limfosit B yang sedang berkembang. Selepas itu, banyak sel B bertukar kepada menghasilkan kelas antibodi lain, tetapi dengan tapak pengikat antigen yang sama. IgM dimasukkan ke dalam membran dan bertindak sebagai reseptor pengecam antigen. Penggabungan IgM ke dalam membran sel adalah mungkin disebabkan oleh kehadiran 25 sisa asid amino hidrofobik di bahagian ekor rantau ini.
Bentuk rembesan IgM mengandungi lima subunit monomerik yang dihubungkan antara satu sama lain oleh ikatan disulfida dan rantaian J polipeptida tambahan (Rajah 1.31). Monomer rantai berat dalam bentuk ini tidak mengandungi ekor hidrofobik. Pentamer mempunyai 10 tapak pengikat antigen dan oleh itu berkesan dalam mengenali dan mengeluarkan antigen yang telah memasuki badan buat kali pertama. Bentuk rembesan IgM ialah kelas utama antibodi yang dirembeskan ke dalam darah semasa tindak balas imun primer. Pengikatan IgM kepada antigen mengubah bentuk IgM dan mendorong pengikatannya kepada komponen protein pertama sistem pelengkap (sistem pelengkap ialah satu set protein yang terlibat dalam pemusnahan antigen) dan pengaktifan sistem ini. Jika antigen terletak pada permukaan mikroorganisma, sistem pelengkap menyebabkan pelanggaran integriti membran sel dan kematian sel bakteria.
Imunoglobulin G
Dari segi kuantitatif, kelas imunoglobulin ini mendominasi dalam darah (75% daripada semua Ig). IgG - monomer, kelas utama antibodi yang dirembeskan ke dalam darah semasa tindak balas imun sekunder. Selepas interaksi IgG dengan antigen permukaan mikroorganisma, kompleks antigen-antibodi dapat mengikat dan mengaktifkan protein sistem pelengkap atau boleh berinteraksi dengan reseptor tertentu pada makrofaj dan neutrofil. interaksi dengan fagosit
 nasi. 1.31. Struktur bentuk rembesan IgM
nasi. 1.31. Struktur bentuk rembesan IgM
kepada penyerapan kompleks antigen-antibodi dan pemusnahannya dalam fagosom sel. IgG adalah satu-satunya kelas antibodi yang boleh melepasi halangan plasenta dan melindungi janin daripada jangkitan dalam rahim.
Imunoglobulin A
Kelas utama antibodi yang terdapat dalam rembesan (susu, air liur, rembesan pernafasan, dan saluran usus). IgA dirembeskan terutamanya dalam bentuk dimerik, di mana monomer dihubungkan antara satu sama lain melalui rantai-J tambahan (Rajah 1.32).
IgA tidak berinteraksi dengan sistem pelengkap dan sel fagositik, tetapi dengan mengikat mikroorganisma, antibodi menghalangnya daripada melekat pada sel epitelium dan menembusi ke dalam badan.
Imunoglobulin E
Imunoglobulin E diwakili oleh monomer di mana rantaian ε berat mengandungi, serta rantaian μ imunoglobulin M, satu pembolehubah dan empat domain malar. IgE selepas rembesan mengikat dengan mereka sendiri
 nasi. 1.32. Struktur IgA
nasi. 1.32. Struktur IgA
Kawasan terminal-C dengan reseptor yang sepadan pada permukaan sel mast dan basofil. Akibatnya, ia menjadi reseptor untuk antigen pada permukaan sel ini (Rajah 1.33).
 nasi. 1.33. Interaksi IgE dengan antigen pada permukaan sel mast
nasi. 1.33. Interaksi IgE dengan antigen pada permukaan sel mast
Selepas antigen dilekatkan pada tapak IgE yang mengikat antigen yang sepadan, sel menerima isyarat untuk merembeskan bahan aktif biologi (histamin, serotonin), yang sebahagian besarnya bertanggungjawab untuk perkembangan tindak balas keradangan dan untuk manifestasi tindak balas alahan seperti. asma, urtikaria, demam hay.
Imunoglobulin D
Imunoglobulin D terdapat dalam serum dalam sangat bilangan yang kecil, mereka adalah monomer. Rantaian δ berat mempunyai satu pembolehubah dan tiga domain malar. IgD bertindak sebagai reseptor untuk B-limfosit, fungsi lain masih tidak diketahui. Interaksi antigen tertentu dengan reseptor pada permukaan B-limfosit (IgD) membawa kepada penghantaran isyarat ini ke dalam sel dan pengaktifan mekanisme yang memastikan pembiakan klon limfosit ini.
TOPIK 1.7. SIFAT-SIFAT FIZIKO-KIMIA PROTEIN DAN KAEDAH UNTUK PEMISAHNYA
1. Protein individu berbeza dalam sifat fizikokimianya:
Bentuk molekul;
Berat molekul;
Jumlah caj, nilainya bergantung kepada nisbah kumpulan anionik dan kationik asid amino;
Nisbah radikal asid amino polar dan bukan polar pada permukaan molekul;
Darjah rintangan kepada pelbagai agen penyahwarna.
2. Keterlarutan protein bergantung pada sifat-sifat protein yang disenaraikan di atas, serta pada komposisi medium di mana protein larut (nilai pH, komposisi garam, suhu, kehadiran bahan organik lain yang boleh berinteraksi dengan protein). Magnitud cas molekul protein adalah salah satu faktor yang mempengaruhi keterlarutannya. Apabila cas hilang pada titik isoelektrik, protein lebih mudah teragregat dan mendakan. Ini adalah benar terutamanya untuk protein ternyahatur, yang mempunyai radikal asid amino hidrofobik di permukaan.
Pada permukaan molekul protein, terdapat radikal asid amino bercas positif dan negatif. Bilangan kumpulan ini, dan oleh itu jumlah cas protein, bergantung pada pH medium, i.e. nisbah kepekatan kumpulan H + - dan OH -. Dalam persekitaran berasid peningkatan dalam kepekatan H+ membawa kepada penindasan penceraian kumpulan karboksil -COO - + H+ > -COOH dan penurunan cas negatif protein. Dalam persekitaran alkali, pengikatan lebihan OH - proton yang terbentuk semasa penceraian kumpulan amino -NH 3 + + OH - - NH 2 + H 2 O dengan pembentukan air, membawa kepada penurunan cas positif protein. Nilai pH di mana protein mempunyai cas bersih sifar dipanggil titik isoelektrik (IEP). Dalam IET, bilangan kumpulan bercas positif dan negatif adalah sama, i.e. protein berada dalam keadaan isoelektrik.
3. Pemisahan protein individu. Ciri-ciri struktur dan fungsi badan bergantung pada set protein yang disintesis di dalamnya. Kajian tentang struktur dan sifat protein adalah mustahil tanpa pengasingan daripada sel dan penulenan daripada protein lain dan molekul organik. Peringkat pengasingan dan penulenan protein individu:
kemusnahan sel daripada tisu yang dikaji dan mendapatkan homogenat.
Pemisahan homogenat kepada pecahan sentrifugasi, mendapatkan pecahan nuklear, mitokondria, sitosol atau lain-lain yang mengandungi protein yang dikehendaki.
Denaturasi haba terpilih- pemanasan jangka pendek larutan protein, di mana bahagian kekotoran protein yang didenaturasi boleh dialihkan (sekiranya protein secara relatifnya stabil dari segi haba).
Masin keluar. Pelbagai protein mengendap apabila kepekatan yang berbeza garam dalam larutan. Dengan meningkatkan kepekatan garam secara beransur-ansur, adalah mungkin untuk mendapatkan beberapa pecahan individu dengan kandungan utama protein yang dirembes dalam salah satu daripadanya. Pecahan protein yang paling biasa digunakan ialah ammonium sulfat. Protein dengan keterlarutan terendah mendakan pada kepekatan garam yang rendah.
Penapisan gel- kaedah menapis molekul melalui butiran Sephadex yang bengkak (rantai polisakarida dextran tiga dimensi dengan liang). Kadar laluan protein melalui lajur yang diisi dengan Sephadex akan bergantung pada berat molekulnya: semakin kecil jisim molekul protein, semakin mudah ia menembusi ke dalam butiran dan tinggal di sana lebih lama, semakin besar jisim, semakin cepat ia dicairkan daripada kolum.
Ultrasentrifugasi- kaedah yang terdiri daripada fakta bahawa protein dalam tiub emparan diletakkan di dalam pemutar ultrasentrifuge. Apabila rotor berputar, kadar pemendapan protein adalah berkadar dengan berat molekulnya: pecahan protein yang lebih berat terletak lebih dekat ke bahagian bawah tiub, yang lebih ringan lebih dekat ke permukaan.
elektroforesis- kaedah berdasarkan perbezaan kelajuan pergerakan protein dalam medan elektrik. Nilai ini adalah berkadar dengan cas protein. Elektroforesis protein dijalankan di atas kertas (dalam kes ini, kelajuan protein berkadar hanya dengan casnya) atau dalam gel poliakrilamida dengan saiz liang tertentu (kelajuan protein berkadar dengan cas dan berat molekulnya).
Kromatografi pertukaran ion- kaedah pecahan berdasarkan pengikatan kumpulan protein terion dengan kumpulan resin pertukaran ion bercas bertentangan (tidak larut bahan polimer). Kekuatan mengikat protein kepada resin adalah berkadar dengan cas protein. Protein yang terserap pada polimer pertukaran ion boleh dibasuh dengan peningkatan kepekatan larutan NaCl; semakin rendah cas protein, semakin rendah kepekatan NaCl diperlukan untuk membasuh protein yang berkaitan dengan kumpulan ionik resin.
Kromatografi pertalian- kaedah paling khusus untuk mengasingkan protein individu. Ligan protein dilekatkan secara kovalen pada polimer lengai. Apabila larutan protein dialirkan melalui lajur dengan polimer, disebabkan oleh pengikatan pelengkap protein kepada ligan, hanya protein khusus untuk ligan ini terjerap pada lajur.
Dialisis- kaedah yang digunakan untuk mengeluarkan sebatian berat molekul rendah daripada larutan protein terpencil. Kaedah ini berdasarkan ketidakupayaan protein untuk melalui membran separa telap, tidak seperti bahan berat molekul rendah. Ia digunakan untuk membersihkan protein daripada kekotoran berat molekul rendah, contohnya, daripada garam selepas diasinkan.
TUGASAN UNTUK KERJA EKSTRAKURIKULUM
1. Isi jadual. 1.4.
Jadual 1.4. Analisis perbandingan struktur dan fungsi protein yang berkaitan - myoglobin dan hemoglobin
a) ingat struktur pusat aktif Mb dan Hb. Apakah peranan yang dimainkan oleh radikal hidrofobik asid amino dalam pembentukan pusat aktif protein ini? Terangkan struktur pusat aktif Mb dan Hb serta mekanisme ikatan ligan padanya. Apakah peranan yang dimainkan oleh sisa-sisa F 8 dan E 7-Nya dalam fungsi tapak aktif Mv dan Hv?
b) apakah sifat baharu berbanding mioglobin monomerik yang dimiliki oleh protein oligomerik, hemoglobin, yang berkait rapat? Terangkan peranan perubahan koperatif dalam pengukuhan protomer dalam molekul hemoglobin, kesan CO 2 dan kepekatan proton ke atas pertalian hemoglobin kepada oksigen, dan peranan 2,3-BPG dalam pengawalan alosterik fungsi Hb.
2. Huraikan ciri-ciri pendamping molekul, memberi perhatian kepada hubungan antara struktur dan fungsinya.
3. Apakah protein yang dikelompokkan ke dalam keluarga? Menggunakan contoh keluarga imunoglobulin, tentukan ciri struktur yang serupa dan fungsi berkaitan protein keluarga ini.
4. Selalunya, protein individu yang disucikan diperlukan untuk aplikasi biokimia dan perubatan. Terangkan tentang sifat fizikokimia protein berdasarkan kaedah yang digunakan untuk pengasingan dan penulenannya.
TUGASAN UNTUK KAWALAN DIRI
1. Pilih jawapan yang betul.
Fungsi hemoglobin:
A. O 2 transport from lungs to tissues B. H + transport from tissues to lungs
B. Mengekalkan pH darah yang malar D. Pengangkutan CO2 dari paru-paru ke tisu
D. Pengangkutan CO 2 dari tisu ke paru-paru
2. Pilih jawapan yang betul. liganα -Hb protomer ialah: A. Heme
B. Oksigen
B. CO D. 2,3-BPG
D. β-Protomer
3. Pilih jawapan yang betul.
Hemoglobin berbeza daripada mioglobin:
A. Mempunyai struktur kuaternari
B. Struktur sekunder hanya diwakili oleh α-heliks
B. Merujuk kepada protein kompleks
D. Berinteraksi dengan ligan alosterik D. Terikat secara kovalen kepada heme
4. Pilih jawapan yang betul.
Perkaitan Hb untuk O 2 berkurangan:
A. Apabila satu molekul O 2 dicantumkan B. Apabila satu molekul O 2 disingkirkan
B. Apabila berinteraksi dengan 2,3-BPG
D. Apabila dilekatkan pada protomer H + D. Apabila kepekatan 2,3-BPG berkurangan
5. Tetapkan padanan.
Untuk jenis Hb ia adalah ciri:
A. Membentuk agregat fibrillar dalam bentuk deoksi B. Mengandungi dua rantai α- dan dua δ
B. Bentuk utama Hb dalam eritrosit dewasa D. Ia mengandungi heme dengan Fe + 3 di pusat aktif
D. Mengandungi dua rantai α- dan dua γ 1. HvA 2.
6. Tetapkan padanan.
Ligan Hb:
A. Mengikat Hb di pusat alosterik
B. Mempunyai pertalian yang sangat tinggi untuk tapak aktif Hb
B. Mencantum, meningkatkan pertalian Hb kepada O 2 D. Mengoksidakan Fe + 2 kepada Fe + 3
D. Membentuk ikatan kovalen dengan hysF8
7. Pilih jawapan yang betul.
Pendamping:
A. Protein terdapat dalam semua bahagian sel
B. Sintesis dipertingkatkan di bawah pengaruh tekanan
B. Mengambil bahagian dalam hidrolisis protein denaturasi
D. Mengambil bahagian dalam mengekalkan konformasi asli protein
D. Cipta organel di mana pembentukan protein terbentuk
8. Perlawanan. Imunoglobulin:
A. Bentuk rembesan ialah pentamerik
B. Kelas Ig yang melepasi halangan plasenta
B. Ig - reseptor sel mast
D. Kelas utama Ig terdapat dalam rembesan sel epitelium. D. B-limfosit reseptor, pengaktifan yang memastikan pembiakan sel
9. Pilih jawapan yang betul.
Imunoglobulin E:
A. Dihasilkan oleh makrofaj B. Mempunyai rantai ε yang berat.
B. Tertanam dalam membran T-limfosit
D. Bertindak sebagai reseptor membran untuk antigen pada sel mast dan basofil
D. Bertanggungjawab untuk manifestasi tindak balas alahan
10. Pilih jawapan yang betul.
Kaedah untuk mengasingkan protein adalah berdasarkan perbezaan berat molekulnya:
A. Penapisan gel
B. Ultrasentrifugasi
B. Elektroforesis gel poliakrilamida D. Kromatografi pertukaran ion
D. Kromatografi pertalian
11. Pilih jawapan yang betul.
Kaedah untuk mengasingkan protein adalah berdasarkan perbezaan keterlarutannya dalam air:
A. Penapisan gel B. Penggaraman
B. Kromatografi pertukaran ion D. Kromatografi pertalian
E. Elektroforesis gel poliakrilamida
STANDARD JAWAPAN KEPADA "TUGASAN UNTUK KAWALAN DIRI"
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-D
6. 1-C, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-C
TERMA DAN KONSEP ASAS
1. Protein oligomerik, protomer, struktur kuaternari protein
2. Perubahan koperasi dalam konformasi protomer
3. Kesan Bohr
4. Peraturan alosterik fungsi protein, pusat alosterik dan efektor alosterik
5. Pendamping molekul, protein kejutan haba
6. Keluarga protein (protease serin, imunoglobulin)
7. IgM-, G-, E-, A-sambungan struktur dengan fungsi
8. Jumlah cas protein, titik isoelektrik protein
9. Elektroforesis
10. Masin
11. Penapisan gel
12. Kromatografi pertukaran ion
13. Ultrasentrifugasi
14. Kromatografi pertalian
15. Elektroforesis protein plasma
TUGASAN UNTUK KERJA AUDITIONAL
1. Bandingkan kebergantungan darjah ketepuan hemoglobin (Hb) dan mioglobin (Mb) dengan oksigen pada tekanan separanya dalam tisu
 nasi. 1.34. Kebergantungan ketepuan MV danHboksigen daripada tekanan separanya
nasi. 1.34. Kebergantungan ketepuan MV danHboksigen daripada tekanan separanya
Sila ambil perhatian bahawa bentuk lengkung ketepuan oksigen protein adalah berbeza: untuk myoglobin - hiperbola, untuk hemoglobin - bentuk sigmoid.
1. Bandingkan nilai tekanan separa oksigen di mana Mb dan Hb tepu dengan O 2 sebanyak 50%. Antara protein ini yang manakah mempunyai pertalian yang lebih tinggi untuk O 2 ?
2. Apakah ciri struktur MB yang menentukan pertalian tingginya untuk O 2 ?
3. Apakah ciri-ciri struktur Hb yang membolehkannya melepaskan O 2 dalam kapilari tisu rehat (pada tekanan separa yang agak tinggi O 2) dan secara mendadak meningkatkan pulangan ini dalam otot yang bekerja? Apakah sifat protein oligomerik yang memberikan kesan ini?
4. Kira berapa jumlah O 2 (dalam%) memberikan hemoglobin beroksigen kepada otot yang berehat dan bekerja?
5. membuat kesimpulan tentang hubungan antara struktur protein dan fungsinya.
2. Jumlah oksigen yang dikeluarkan oleh hemoglobin dalam kapilari bergantung kepada keamatan proses katabolisme dalam tisu (kesan Bohr). Bagaimanakah perubahan dalam metabolisme tisu mengawal pertalian Hb untuk O 2? Kesan CO 2 dan H+ pada pertalian Hb kepada O 2
 1. Terangkan kesan Bohr.
1. Terangkan kesan Bohr.
2. ke arah manakah proses yang ditunjukkan dalam rajah itu mengalir:
a) dalam kapilari paru-paru;
b) dalam kapilari tisu?
3. Apakah kepentingan fisiologi kesan Bohr?
4. Mengapakah interaksi Hb dengan H+ di tapak yang jauh dari heme mengubah pertalian protein untuk O 2 ?
3. Perkaitan Hb kepada O 2 bergantung pada kepekatan ligannya, 2,3-biphosphoglycerate, yang merupakan pengatur alosterik pertalian Hb kepada O 2 . Mengapakah interaksi ligan di tapak yang jauh dari tapak aktif menjejaskan fungsi protein? Bagaimanakah 2,3-BPG mengawal pertalian Hb untuk O 2? Untuk menyelesaikan masalah, jawab soalan berikut:
1. Di mana dan dari apakah 2,3-biphosphoglycerate (2,3-BPG) disintesis? Tulis formulanya, nyatakan cas molekul ini.
2. Apakah bentuk hemoglobin (oksi atau deoksi) yang BPG berinteraksi dan mengapa? Di kawasan manakah molekul Hb interaksi berlaku?
3. ke arah manakah proses yang ditunjukkan dalam rajah itu berjalan?
a) dalam kapilari tisu;
b) dalam kapilari paru-paru?
4. di mana sepatutnya kepekatan tertinggi kompleks
Nv-2,3-BFG:
a) dalam kapilari otot semasa rehat,
b) dalam kapilari otot yang bekerja (dengan mengandaikan kepekatan BPG yang sama dalam eritrosit)?
5. Bagaimanakah pertalian Hb untuk oksigen akan berubah apabila seseorang menyesuaikan diri dengan keadaan altitud tinggi, jika kepekatan BPG dalam eritrosit meningkat? Apakah kepentingan fisiologi fenomena ini?
4. Pemusnahan 2,3-BPG semasa penyimpanan darah terpelihara mengganggu fungsi Hb. Bagaimanakah pertalian Hb kepada O 2 dalam darah terpelihara akan berubah jika kepekatan 2,3-BPG dalam eritrosit boleh berkurangan daripada 8 kepada 0.5 mmol/l. Adakah mungkin untuk memindahkan darah sedemikian kepada pesakit yang sakit serius jika kepekatan 2,3-BPG dipulihkan tidak lebih awal daripada selepas tiga hari? Adakah mungkin untuk memulihkan fungsi eritrosit dengan menambahkan 2,3-BPG ke dalam darah?
5. Ingat semula struktur molekul imunoglobulin yang paling ringkas. Apakah peranan yang dimainkan oleh imunoglobulin dalam sistem imun? Mengapa Igs sering dirujuk sebagai bivalen? Bagaimanakah struktur Igs berkaitan dengan fungsinya? (Huraikan menggunakan contoh kelas imunoglobulin.)
Sifat fiziko-kimia protein dan kaedah pemisahannya.
6. Bagaimanakah cas bersih protein mempengaruhi keterlarutannya?
a) tentukan jumlah cas peptida pada pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) bagaimanakah cas peptida ini akan berubah pada pH >7, pH<7, рН <<7?
c) apakah titik isoelektrik protein (IEP) dan dalam persekitaran apakah ia terletak
IET peptida ini?
d) pada nilai pH berapakah keterlarutan paling sedikit peptida ini dapat diperhatikan.
7. Mengapakah susu masam, tidak seperti susu segar, "membeku" apabila direbus (iaitu, protein susu kasein memendakan)? Molekul kasein dalam susu segar mempunyai cas negatif.
8. Penapisan gel digunakan untuk memisahkan protein individu. Campuran yang mengandungi protein A, B, C dengan berat molekul bersamaan dengan 160,000, 80,000 dan 60,000, masing-masing, telah dianalisis dengan penapisan gel (Rajah 1.35). Butiran gel yang bengkak boleh telap kepada protein dengan berat molekul kurang daripada 70,000. Apakah prinsip yang mendasari kaedah pengasingan ini? Antara graf yang manakah mewakili keputusan pecahan dengan betul? Nyatakan susunan pembebasan protein A, B dan C daripada lajur.
 nasi. 1.35. Menggunakan Kaedah Penapisan Gel untuk Mengasingkan Protein
nasi. 1.35. Menggunakan Kaedah Penapisan Gel untuk Mengasingkan Protein
9. Pada rajah. 1.36, A menunjukkan gambar rajah elektroforesis di atas kertas protein dalam serum darah orang yang sihat. Jumlah relatif pecahan protein yang diperoleh menggunakan kaedah ini ialah: albumin 54-58%, α 1 -globulin 6-7%, α 2 -globulin 8-9%, β-globulin 13%, γ-globulin 11-12% .
 nasi. 1.36 Elektroforesis pada kertas protein plasma darah orang yang sihat (A) dan pesakit (B)
nasi. 1.36 Elektroforesis pada kertas protein plasma darah orang yang sihat (A) dan pesakit (B)
I - γ-globulin; II - β-globulin; III -α 2 - globulin; IV-α 2 - globulin; V - albumin
Banyak penyakit disertai dengan perubahan kuantitatif dalam komposisi protein whey (dysproteinemia). Sifat perubahan ini diambil kira semasa membuat diagnosis dan menilai keterukan dan peringkat penyakit.
Menggunakan data yang diberikan dalam jadual. 1.5, buat andaian tentang penyakit ini, yang dicirikan oleh profil elektroforesis yang dibentangkan dalam rajah. 1.36.
Jadual 1.5. Perubahan dalam kepekatan protein serum darah dalam patologi
Topik: PEMINDAHAN TRANSMEMBRAN
Reseptor intraselular: https://www.youtube.com/watch?v=Nm9u4lNCPyM
Reseptor membran metabotropik yang dikaitkan dengan sistem pemesejan kedua: https://www.youtube.com/watch?v=dQ4yVuLAbH0
Reseptor membran metabotropik yang dikaitkan dengan aktiviti tyrosine kinase:
Jenis pemindahan transmembran.
Jenis saluran pengangkutan transmembran.
Konsep bahan kutub dan bukan kutub.
Kebolehtelapan terpilih transmembran mengekalkan homeostasis selular, kandungan optimum ion, air, enzim dan substrat dalam sel. Cara melaksanakan kebolehtelapan membran terpilih: pengangkutan pasif, pengangkutan bermangkin (penyebaran terfasilitasi), pengangkutan aktif. Sifat hidrofobik teras dwilapisan menentukan kemungkinan (atau kemustahilan) penembusan langsung melalui membran pelbagai bahan dari sudut pandangan fizikokimia (terutamanya polar dan nonpolar).
Bahan bukan kutub(contohnya, kolesterol dan derivatifnya) bebas menembusi membran biologi. Atas sebab ini, endositosis dan eksositosis sebatian polar (contohnya, hormon peptida) berlaku dengan bantuan vesikel membran, manakala rembesan hormon steroid berlaku tanpa penyertaan vesikel tersebut. Atas sebab yang sama, reseptor untuk molekul bukan kutub (contohnya, hormon steroid) terletak di dalam sel.
bahan polar(cth. protein dan ion) tidak boleh merentas membran biologi. Itulah sebabnya reseptor untuk molekul polar (contohnya, hormon peptida) dibina ke dalam membran plasma, dan penghantaran isyarat ke petak sel lain dijalankan oleh utusan kedua. Atas sebab yang sama, pemindahan transmembran sebatian kutub dijalankan oleh sistem khas yang dibina ke dalam membran biologi.
Kebolehtelapan terpilih disediakan oleh membran sel; fungsi reseptor dilaksanakan oleh glikoprotein, bahagian karbohidrat yang terletak di glikokaliks; pemeliharaan bentuk dan mobiliti disediakan oleh protein fibrillar dan tiub dalam lapisan submembran, dsb.
Konsep reseptor dan ligan
Reseptor sel- molekul pada permukaan sel, nukleus, organel sel atau terlarut dalam sitoplasma. Reseptor sel secara khusus bertindak balas dengan menukar konfigurasi spatial (bentuk) kepada lampiran molekul bahan kimia tertentu kepadanya - ligan menghantar isyarat kawalan luaran. Ini seterusnya menghantar isyarat ini ke bahagian dalam sel atau organel sel. Tapak pada reseptor di mana ia melekat ligan dipanggil tapak. Reseptor yang sama boleh mempunyai beberapa tapak. Reseptor selular boleh dibahagikan kepada dua kelas utama - reseptor membran (terletak pada membran yang memisahkan sel daripada persekitaran luaran) dan reseptor intrasel.
Bahan yang mengikat secara khusus kepada reseptor dipanggil ligan (utusan) reseptor ini. Oleh itu, ligan (sinonim: utusan) ialah bahan kimia yang mampu berinteraksi dengan reseptor. Hasil interaksi ini mungkin berbeza. Jika ligan (utusan) membawa kepada perubahan bentuk reseptor dan pengaktifannya dipanggil agonis . Jika ligan (messenger) mengubah bentuk (konformasi) reseptor dan menyekat reseptor ini, ia dipanggil antagonis.
Apabila ia datang kepada organ deria, ligan (messenger) adalah bahan yang bertindak pada reseptor bau atau rasa.
Terdapat juga protein reseptor termosensitif dan protein reseptor yang bertindak balas terhadap perubahan potensi membran.
Reseptor untuk ligan larut air (utusan) - hormon protein, adrenalin, noradrenalin - terletak di permukaan membran (reseptor membran), ini disebabkan oleh fakta bahawa ligan hidrofilik tidak boleh melalui permukaan hidrofobik membran. Ligan larut lemak (utusan) mudah melalui dwilapisan fosfolipid membran sel dan nukleus, dan oleh itu sel mempunyai reseptor (reseptor intraselular) untuk mereka di dalam: pada organel, nukleus. Contoh ligan larut lemak boleh menjadi hormon steroid kelenjar adrenal, gonad.
Di samping itu, ligan boleh dipisahkan kepada eksogen(datang dari luar) dan endogen(dihasilkan di dalam badan). Sebagai peraturan, jika sesetengah bahan eksogen mempunyai reseptor pada sel, maka terdapat ligan endogen untuk reseptor ini di dalam badan. Jadi, sebagai contoh, ligan endogen reseptor cannabinoid, yang mengikat alkaloid rami, adalah bahan anandamide, yang dihasilkan oleh badan daripada asid lemak arakidonik. Atau reseptor endorphin (memainkan peranan penting dalam pembentukan kesakitan dan keadaan emosi): mereka boleh berhubung dengan ligan endogen - endorfin, atau mereka boleh mengikat ubat-ubatan kumpulan morfin.
Kekhususan tinggi protein yang mengikat ligan disediakan oleh pelengkap struktur tapak aktif protein dengan struktur ligan.
Pelengkap difahami sebagai korespondensi spatial dan kimia bagi molekul yang berinteraksi. Ligan mesti boleh masuk dan secara spatial bertepatan dengan konformasi tapak aktif. Kebetulan ini mungkin tidak lengkap, tetapi disebabkan labiliti konformasi protein, pusat aktif mampu melakukan perubahan kecil dan "dilaraskan" kepada ligan. Di samping itu, antara kumpulan berfungsi ligan dan radikal asid amino yang membentuk pusat aktif, harus ada ikatan yang menahan ligan di pusat aktif. Ikatan antara ligan dan pusat aktif protein boleh sama ada bukan kovalen (ionik, hidrogen, hidrofobik) atau kovalen.
1. Ciri-ciri pusat aktif
Pusat aktif protein adalah tapak, agak terpencil dari persekitaran sekitar protein, dibentuk oleh residu asid amino. Di kawasan ini, setiap sisa, kerana saiz individu dan kumpulan berfungsi, membentuk "pelepasan" pusat aktif.
Menggabungkan asid amino sedemikian ke dalam kompleks berfungsi tunggal mengubah kereaktifan radikalnya, sama seperti bunyi alat muzik berubah dalam ensembel. Oleh itu, sisa asid amino yang membentuk tapak aktif sering dirujuk sebagai "ensembel" asid amino.
Sifat unik pusat aktif bergantung bukan sahaja pada sifat kimia asid amino yang membentuknya, tetapi juga pada orientasi bersama yang tepat di angkasa. Oleh itu, walaupun sedikit gangguan dalam konformasi umum protein akibat perubahan titik dalam struktur utamanya atau keadaan persekitaran boleh membawa kepada perubahan dalam sifat kimia dan fungsian radikal yang membentuk pusat aktif, mengganggu pengikatan protein kepada ligan dan fungsinya. Semasa denaturasi, pusat aktif protein dimusnahkan, dan aktiviti biologinya hilang.
Pusat aktif sering dibentuk sedemikian rupa sehingga akses air kepada kumpulan berfungsi radikalnya terhad; keadaan dicipta untuk mengikat ligan kepada radikal asid amino.
Dalam sesetengah kes, ligan dilekatkan pada hanya satu daripada atom yang mempunyai kereaktifan tertentu, contohnya, penambahan O 2 kepada besi mioglobin atau hemoglobin. Walau bagaimanapun, sifat atom tertentu untuk berinteraksi secara selektif dengan O 2 ditentukan oleh sifat radikal yang mengelilingi atom besi dalam komposisi topik. Heme juga terdapat dalam protein lain, seperti sitokrom. Walau bagaimanapun, fungsi atom besi dalam sitokrom adalah berbeza, ia berfungsi sebagai perantara untuk pemindahan elektron dari satu bahan ke bahan lain, manakala besi menjadi divalen atau trivalen.
Sifat utama protein yang mendasari fungsinya ialah selektiviti melekatkan ligan tertentu pada bahagian tertentu molekul protein.
2. Kepelbagaian ligan
Ligan boleh menjadi bukan organik (selalunya ion logam) dan bahan organik, berat molekul rendah dan bahan berat molekul tinggi;
terdapat ligan yang mengubah struktur kimianya apabila dilekatkan pada pusat aktif protein (perubahan substrat dalam pusat aktif enzim);
terdapat ligan yang melekat pada protein hanya pada masa berfungsi (contohnya, O 2 diangkut oleh hemoglobin), dan ligan yang sentiasa dikaitkan dengan protein dan memainkan peranan tambahan dalam fungsi protein (contohnya, besi, yang merupakan sebahagian daripada hemoglobin).
Dalam kes apabila sisa asid amino yang membentuk pusat aktif tidak dapat memastikan fungsi protein ini, molekul bukan protein boleh melekat pada bahagian tertentu pusat aktif. Jadi, di pusat aktif banyak enzim terdapat ion logam (kofaktor) atau molekul bukan protein organik (koenzim). Bahagian bukan protein, sangat dikaitkan dengan tapak aktif protein dan diperlukan untuk berfungsi, dipanggil "kumpulan prostat". Mioglobin, hemoglobin dan sitokrom mempunyai kumpulan prostetik di pusat aktif - heme yang mengandungi besi.
Sambungan protomer dalam protein oligomerik adalah contoh interaksi ligan berat molekul tinggi. Setiap protomer yang disambungkan kepada protomer lain berfungsi sebagai ligan untuk mereka, sama seperti mereka untuknya.
Kadangkala penambahan ligan mengubah konformasi protein, mengakibatkan pembentukan tapak pengikatan dengan ligan lain. Sebagai contoh, protein calmodulin, selepas mengikat empat ion Ca 2+ di kawasan tertentu, memperoleh keupayaan untuk berinteraksi dengan enzim tertentu, mengubah aktivitinya.
8. Struktur kuaternari protein. Ciri-ciri struktur dan fungsi protein oligomerik pada contoh hemoglobin. Perubahan koperasi dalam konformasi protomer. Kemungkinan peraturan fungsi biologi protein oligomerik oleh ligan alosterik.
Di bawah struktur Kuaternari bermaksud cara meletakkan rantai polipeptida individu di angkasa dengan struktur primer, sekunder atau tertier yang sama (atau berbeza), dan pembentukan pembentukan makromolekul tunggal dalam aspek struktur dan fungsi. Banyak protein berfungsi terdiri daripada beberapa rantai polipeptida yang disambungkan bukan oleh ikatan kovalen, tetapi oleh ikatan bukan kovalen (serupa dengan yang memberikan kestabilan kepada struktur tertier). Setiap rantai polipeptida individu, dipanggil protomer, monomer atau subunit, selalunya tidak mempunyai aktiviti biologi. Protein memperoleh keupayaan ini dengan cara perkaitan spatial tertentu protomer konstituennya, i.e. terdapat kualiti baru yang bukan ciri protein monomerik. Molekul yang terhasil biasanya dipanggil oligomer (atau multimer). Protein oligomerik selalunya dibina daripada bilangan protomer genap (dari 2 hingga 4, jarang dari 6 hingga 8) dengan berat molekul yang sama atau berbeza - dari beberapa ribu hingga ratusan ribu. Khususnya, molekul hemoglobin terdiri daripada dua rantai α- dan dua β-polipeptida yang serupa, i.e. ialah tetramer.
Perubahan koperasi dalam konformasi protomer.
Perubahan dalam bentuk dan, akibatnya, dalam sifat fungsi semua protomer protein oligomerik apabila ligan dilekatkan pada hanya satu daripadanya dipanggil perubahan kerjasama dalam pengukuhan protomer.
Peraturan alosterik . Enzim mengubah aktiviti melalui efektor yang tidak berkaitan secara kovalen. Pengikatan berlaku di kawasan itu, secara spatial jauh dari tapak aktif (mangkin). Pengikatan ini menyebabkan perubahan konformasi dalam molekul protein, yang membawa kepada perubahan dalam geometri khusus tapak pemangkin. Aktiviti boleh meningkat - ini adalah pengaktifan enzim, atau berkurangan - ini adalah perencatan. "Mesej" mengenai lampiran pengaktif alosterik dihantar melalui perubahan konformasi kepada subunit pemangkin, yang menjadi pelengkap kepada substrat, dan enzim "dihidupkan pada". Apabila pengaktif dikeluarkan, enzim sekali lagi masuk ke dalam bentuk tidak aktif dan "dimatikan". Regulasi alosterik ialah mod utama pengawalseliaan laluan metabolik.
Kimia biologi Lelevich Vladimir Valeryanovich
Fungsi protein
Fungsi protein
Setiap protein individu, mempunyai struktur dan konformasi primer yang unik, juga mempunyai fungsi unik yang membezakannya daripada semua protein lain. Satu set protein individu melakukan banyak fungsi yang pelbagai dan kompleks dalam sel.
Keadaan yang diperlukan untuk berfungsi protein ialah penambahan bahan lain kepadanya, yang dipanggil ligan. Ligan boleh menjadi bahan molekul rendah dan makromolekul. Interaksi protein dengan ligan adalah sangat spesifik, yang ditentukan oleh struktur kawasan protein yang dipanggil tapak pengikat protein-ligan atau tapak aktif.
Pusat aktif protein dan selektiviti pengikatannya kepada ligan
Pusat aktif protein ialah kawasan khusus molekul protein, biasanya terletak di ceruknya, dibentuk oleh radikal asid amino yang terhimpun di kawasan ruang tertentu semasa pembentukan struktur tertier dan mampu mengikat pelengkap kepada ligan. Dalam urutan linear rantai polipeptida, radikal yang membentuk pusat aktif boleh terletak pada jarak yang agak jauh antara satu sama lain.
Kekhususan tinggi protein yang mengikat ligan disediakan oleh pelengkap struktur pusat aktif protein dan struktur ligan.
Pelengkap difahami sebagai korespondensi spatial dan kimia bagi molekul yang berinteraksi. Ligan mesti boleh masuk dan secara spatial bertepatan dengan konformasi tapak aktif. Padanan ini mungkin tidak lengkap, tetapi disebabkan labiliti konformasi protein, tapak aktif mampu melakukan perubahan kecil dan "sesuai" dengan ligan. Di samping itu, antara kumpulan berfungsi ligan dan radikal asid amino yang membentuk pusat aktif, harus ada ikatan yang menahan ligan di pusat aktif. Ikatan antara ligan dan pusat aktif protein boleh sama ada bukan kovalen (ionik, hidrogen, hidrofobik) atau kovalen.
Ciri-ciri pusat aktif
Pusat aktif protein adalah tapak, agak terpencil dari persekitaran sekitar protein, dibentuk oleh residu asid amino. Di kawasan ini, setiap sisa, kerana saiz individu dan kumpulan berfungsi, membentuk "pelepasan" pusat aktif.
Sifat unik pusat aktif bergantung bukan sahaja pada sifat kimia asid amino yang membentuknya, tetapi juga pada orientasi bersama yang tepat di angkasa. Oleh itu, walaupun sedikit gangguan dalam konformasi umum protein akibat perubahan titik dalam struktur utamanya atau keadaan persekitaran boleh membawa kepada perubahan dalam sifat kimia dan fungsian radikal yang membentuk pusat aktif, mengganggu pengikatan protein kepada ligan dan fungsinya. Semasa denaturasi, pusat aktif protein dimusnahkan, dan aktiviti biologinya hilang.
Pusat aktif sering dibentuk sedemikian rupa sehingga akses air kepada kumpulan berfungsi radikalnya terhad; keadaan dicipta untuk mengikat ligan kepada radikal asid amino.
Tapak pengikatan protein kepada ligan selalunya terletak di antara domain. Sebagai contoh, enzim proteolitik trypsin, yang terlibat dalam hidrolisis ikatan peptida protein makanan dalam usus, mempunyai 2 domain yang dipisahkan oleh alur. Permukaan dalaman alur dibentuk oleh radikal asid amino domain ini, yang berjauhan dalam rantai polipeptida (Ser177, His40, Asp85).
Domain yang berbeza dalam protein boleh bergerak relatif antara satu sama lain apabila berinteraksi dengan ligan, yang memudahkan fungsi protein selanjutnya. Sifat utama protein yang mendasari fungsinya ialah selektiviti perlekatan ligan tertentu pada bahagian tertentu molekul protein.
Pelbagai ligan:
1. Ligan boleh menjadi bukan organik (selalunya ion logam) dan bahan organik, berat molekul rendah dan bahan berat molekul tinggi;
2. terdapat ligan yang mengubah struktur kimianya apabila dilekatkan pada pusat aktif protein (perubahan substrat pada pusat aktif enzim);
3. Terdapat ligan yang melekat pada protein hanya pada masa berfungsi (contohnya, O 2 diangkut oleh hemoglobin), dan ligan yang dikaitkan secara kekal dengan protein dan memainkan peranan tambahan dalam fungsi protein (contohnya, besi, yang merupakan sebahagian daripada hemoglobin).
Daripada buku Pembiakan Anjing pengarang Kovalenko Elena EvgenievnaFungsi sistem pembiakan Aktiviti sistem pembiakan dikawal oleh hormon - bahan yang bersifat protein dengan aktiviti biologi yang tinggi dan selektiviti tindakan. Sifat hormon inilah yang menyediakan komunikasi humoral antara organ,
Daripada buku Age Anatomy and Physiology pengarang Antonova Olga Alexandrovna4.5. Struktur dan fungsi saraf tunjang Saraf tunjang ialah kord yang panjang (pada orang dewasa) panjang kira-kira 45 cm. Di bahagian atas ia masuk ke medulla oblongata, di bahagian bawah (di kawasan vertebra lumbar I-II) saraf tunjang menyempit dan mempunyai bentuk kon,
Dari buku Biologi [Panduan lengkap untuk persediaan menghadapi peperiksaan] pengarang Lerner Georgy Isaakovich4.6. Struktur dan fungsi otak
Daripada buku The Missing Link pengarang Edie Maitland Daripada buku Perbualan tentang Kehidupan pengarang Galaksinov Stanislav GennadievichPokok Keluarga (Bukti Protein) Pokok Keluarga (Bukti Protein) Perbezaan dalam protein dua spesies mencerminkan perubahan evolusi dalam spesies ini selepas pemisahan mereka daripada nenek moyang yang sama. Analisis menunjukkan bahawa antara cimpanzi darah serum albumin
Daripada buku Evolution [Idea klasik berdasarkan penemuan baharu] pengarangBab 2. Seni bina molekul protein Jangan kita sembunyikan: setelah selesai dengan bab pertama, pengarang (dan mungkin pembaca) mengalami sedikit kelegaan. Lagipun, tujuannya hanya untuk memberi pembaca maklumat yang diperlukan untuk memahami bab berikut,
Daripada buku Evolusi Manusia. Buku 1. Monyet, tulang dan gen pengarang Markov Alexander VladimirovichAlam Semesta Protein Purba Terus Berkembang Pada tahun 2010, Nature menerbitkan kertas kerja yang menarik mengenai pergerakan evolusi protein merentasi landskap kecergasan (Povolotskaya dan Kondrashov, 2010). Pengarang kerja memutuskan untuk membandingkan urutan asid amino 572 protein purba,
Daripada buku Biological Chemistry pengarang Lelevich Vladimir ValeryanovichPerubahan Protein Bahagian-bahagian genom yang mengkodkan protein telah berubah secara mengejutkan sedikit. Perbezaan dalam urutan asid amino protein pada manusia dan cimpanzi adalah kurang daripada 1%, dan daripada beberapa perbezaan ini, kebanyakannya sama ada tidak
Dari buku pengarangBab 2. Struktur dan fungsi protein Protein ialah sebatian organik yang mengandungi nitrogen molekul tinggi, terdiri daripada asid amino yang disambungkan ke dalam rantai polipeptida menggunakan ikatan peptida, dan mempunyai organisasi struktur yang kompleks.Sejarah kajian protein Pada tahun 1728
Dari buku pengarangTahap organisasi struktur protein Struktur primer ialah urutan linear asid amino yang ditakrifkan dengan ketat dalam rantai polipeptida. Prinsip strategik untuk mengkaji struktur utama protein telah mengalami perubahan ketara semasa pembangunan dan
Dari buku pengarangPerubahan selepas translasi dalam protein Banyak protein disintesis dalam bentuk tidak aktif (prekursor) dan, selepas bergabung dengan ribosom, menjalani pengubahsuaian struktur pasca sintetik. Perubahan konformasi dan struktur ini dalam rantai polipeptida
Dari buku pengarangBab 23 Keadaan dinamik protein badan Kepentingan asid amino untuk badan terutamanya terletak pada fakta bahawa ia digunakan untuk sintesis protein, metabolisme yang menduduki tempat yang istimewa dalam proses metabolisme antara badan dan
Dari buku pengarangPencernaan protein dalam saluran gastrousus Pencernaan protein bermula di dalam perut di bawah tindakan enzim dalam jus gastrik. Sehingga 2.5 liter dikeluarkan setiap hari dan ia berbeza daripada jus pencernaan lain dalam tindak balas berasid yang kuat, disebabkan oleh kehadiran
Dari buku pengarangPembelahan protein dalam tisu Ia dijalankan dengan bantuan enzim lisosom proteolitik cathepsin. Mengikut struktur pusat aktif, sistein, serin, carboxyl dan metalloprotein cathepsin dibezakan. Peranan cathepsin: 1. penciptaan aktif secara biologi
Dari buku pengarangPeranan hati dalam metabolisme asid amino dan protein Hati memainkan peranan penting dalam metabolisme protein dan sebatian lain yang mengandungi nitrogen. Ia melaksanakan fungsi berikut: 1. sintesis protein plasma tertentu: - di dalam hati disintesis: 100% albumin, 75 - 90% ?-globulin, 50%
Dari buku pengarangPencirian protein serum darah Protein sistem pelengkap - sistem ini merangkumi 20 protein yang beredar dalam darah dalam bentuk prekursor tidak aktif. Pengaktifan mereka berlaku di bawah tindakan bahan tertentu dengan aktiviti proteolitik.
1 Dalam kimia tak organik
o 1.1 Tatanama ligan
o 1.2 Ciri-ciri ligan
§ 1.2.1 Struktur elektronik
§ 1.2.2 Pergigian
§ 1.2.3 Kaedah penyelarasan
2 Nota
Dalam kimia tak organik
Selalunya, pengikatan sedemikian berlaku dengan pembentukan ikatan penderma-penerima yang dipanggil "koordinasi", di mana ligan bertindak sebagai asas Lewis, iaitu, mereka adalah penderma pasangan elektron. Apabila ligan dilekatkan pada atom pusat, sifat kimia agen pengkompleks dan ligan itu sendiri sering mengalami perubahan yang ketara.
Tatanama ligan[sunting | edit teks wiki]
1. yang pertama dalam nama sebatian dalam kes nominatif ialah anion, dan kemudian dalam genitif - kation
2. atas nama ion kompleks, ligan disenaraikan dahulu dalam susunan abjad, dan kemudian atom pusat
3. Atom pusat dalam kompleks kationik neutral dipanggil nama Rusia, dan dalam anion akar nama Latin dengan akhiran "at". Selepas nama atom pusat, keadaan pengoksidaan ditunjukkan.
4. Bilangan ligan yang melekat pada atom pusat ditunjukkan oleh awalan "mono", "di", "tiga", "tetra", "penta", dll.
Ciri-ciri ligan[sunting | edit teks wiki]
Struktur elektronik[sunting | edit teks wiki]
Sebenarnya, ciri ligan yang paling penting, yang membolehkan seseorang menilai dan meramalkan keupayaannya untuk pembentukan kompleks dan pemusnahan diri D-orbital - pemusnahan kompaun secara keseluruhan. Dalam anggaran pertama, ia termasuk bilangan pasangan elektron yang ligan dapat memperuntukkan untuk penciptaan ikatan koordinasi dan keelektronegatifan atom penderma atau kumpulan berfungsi.
Pergigian[sunting | edit teks wiki]
Bilangan tapak koordinasi atom pusat (atau atom) yang diduduki oleh ligan dipanggil ketumpatan (otlat. dens, dent- - gigi). Ligan yang menduduki satu tapak koordinasi dipanggil mono pergigian (contohnya, N H 3), dua - bi dentate (anion oksalat [ O-C(=O)-C(=O) -O] 2−). Ligan yang boleh menduduki lebih banyak tempat biasanya dilambangkan sebagai poli dentate. Sebagai contoh, asid ethylenediaminetetraacetic (EDTA), yang boleh menduduki enam tapak koordinasi.
Selain ketumpatan, terdapat ciri yang mencerminkan bilangan atom ligan yang dikaitkan dengan satu tapak koordinasi atom pusat. Dalam kesusasteraan Inggeris ia dilambangkan dengan perkataan kebahagiaan dan mempunyai sebutan nomenklatur η dengan superskrip yang sepadan. Walaupun dia nampaknya tidak mempunyai istilah yang mapan dalam bahasa Rusia, dalam beberapa sumber seseorang boleh menemui kertas surih "kebahagiaan". Sebagai contoh, kita boleh memberikan ligan cyclopentadienyl dalam kompleks pusat logam, yang menduduki satu tapak koordinasi (iaitu, ia adalah monodentate) dan terikat melalui semua lima atom karbon: η 5 - - .
Kaedah penyelarasan[sunting | edit teks wiki]

Kompleks kelatEDTA 4−
Ligan yang mempunyai lebih daripada dua ketumpatan dapat terbentuk kompleks kelat(Greek χηλή - cakar) - kompleks di mana atom pusat termasuk dalam satu atau lebih kitaran dengan molekul ligan. Ligan sedemikian dipanggil kelat. Sebagai contoh, kita boleh memetik kompleks tetraanion EDTA yang sama, dengan menyatakan bahawa beberapa daripada empat ikatan M-O di dalamnya secara rasmi boleh ionik.
Dalam pembentukan kompleks chelate, ia sering diperhatikan kesan kelat- kestabilan mereka yang lebih tinggi berbanding kompleks ligan bukan kelat yang serupa. Ia dicapai kerana perisai atom pusat yang lebih besar daripada pengaruh penggantian dan kesan entropi. Sebagai contoh, pemalar pemisahan kompleks ammonia kadmium 2+ hampir 1500 kali lebih rendah daripada kompleks dengan etilenadiamine 2+ . Sebabnya ialah, apabila ion kadmium(II) terhidrat berinteraksi dengan etilenadiamina, dua molekul ligan menyesarkan empat molekul air. Dalam kes ini, bilangan zarah bebas dalam sistem meningkat dengan ketara, dan entropi sistem meningkat (dan susunan dalaman kompleks meningkat dengan sewajarnya). Iaitu, punca kesan kelat adalah peningkatan dalam entropi sistem apabila ligan monodentat digantikan oleh yang polidentat dan, akibatnya, penurunan tenaga Gibbs.

Kitaran porphyrin
Di antara ligan pengkelat, seseorang boleh memilih kelas ligan makrosiklik, iaitu, molekul dengan ruang intrasiklik yang mencukupi untuk menampung atom yang kompleks. Contoh sebatian tersebut ialah asas porfirin - asas bagi kompleks biokimia yang paling penting, seperti hemoglobin, klorofil dan bacteriochlorophyll. Crown ethers, calixarenes, dsb. juga boleh bertindak sebagai ligan makrosiklik.
Ligan juga boleh merapatkan, membentuk ikatan antara atom pusat yang berbeza dalam kompleks bi- atau polinuklear. Ligan berjambatan dilambangkan dengan huruf Yunani μ ( mu).
LIGAN
ABCDEZHZYKLMNOPRSTUFHTSCHSHSHCHEYUYA
LIGAN(dari bahasa Latin ligo - I mengikat), molekul neutral, ion atau radikal yang berkaitan dengan pusat. atom sebatian kompleks. Mereka m. b. ion (H - , Hal - , NO 3 - , NCS - dan lain-lain), inorg. molekul (H 2, C n, N 2, P n, O 2, S n, CO, CO 2, NH 3, NO, SO 2, NO 2, COS, dll.), org. comp., mengandungi unsur subkumpulan utama V, VI, VII gr. berkala sistem atau fungsi penderma p. Sekumpulan besar ligan, penting secara biologi Comm. (asid amino, peptida, protein, purin, porfirin, korin, makrolid) dan sintetiknya. analog (eter mahkota, cryptand), serta polimer dengan atom penderma dan kumpulan chelating. Ligan boleh dikaitkan dengan atom pusat melalui ikatan s-, p-, dan d-dua-pusat atau berbilang pusat. Dalam kes pembentukan ikatan dua pusat dalam ligan, pusat penderma boleh diasingkan (biasanya atom N, O, S, Cl atau berbilang ikatan). Pengikatan berbilang pusat dijalankan kerana sistem p-aromatik. ligan (benzena, anion siklopentadienida) atau heteroaromatik. ligan (pirol, tiofen, metilpiridin). Kuantiti yang paling penting. ciri keupayaan penderma-penerima ligan - ketumpatan, ditentukan oleh bilangan pusat penderma ligan yang terlibat dalam koordinasi. Atas dasar ini, ligan dibahagikan kepada mono-, di-, ... polidentat. Penyelarasan bilangan agen pengkompleks untuk ligan monodentat bertepatan dengan bilangannya, bagi yang lain ia adalah sama dengan hasil darab bilangan ligan dan ketumpatannya. Sifat ligan menentukan jenis koordinasi. samb. (aquacomplexes, amminocomplexes, acidocomplexes, mol. adducts, chelates, p-complexes, dsb.); Saint-va, struktur dan tindak balas bergantung padanya. keupayaan Comm kompleks. dan kemungkinan praktikal mereka aplikasi.
Ligan adalah komponen penting protein kompleks
Protein kompleks, sebagai tambahan kepada rantai protein, mempunyai kumpulan bukan protein tambahan - ligan(lat. ligo- I mengikat), iaitu molekul yang dikaitkan dengan protein. Jika ligan membawa beban struktur dan/atau fungsian, ia dipanggil kumpulan prostetik.
sebagai ligan Mana-mana molekul boleh
Molekul yang berfungsi dalam protein struktur fungsi - lipid, karbohidrat, asid nukleik, unsur mineral, sebarang sebatian organik lain: heme dalam hemoglobin, karbohidrat dalam glikoprotein, DNA dan RNA dalam nukleoprotein, kuprum dalam ceruloplasmin,
· mudah alih protein molekul: besi dalam transferrin, hemoglobin dalam haptoglobin, heme dalam hemopexin,
· substrat untuk enzim - sebarang molekul dan juga protein lain.
Pengiktirafan ligan disediakan:
· saling melengkapi struktur pusat pengikatan protein kepada struktur ligan, dengan kata lain, korespondensi spatial dan kimia protein dan ligan. Mereka sesuai bersama seperti kunci kepada kunci, cth padanan enzim dan substrat,
Kadangkala pengiktirafan mungkin bergantung pada kereaktifan atom yang terikat dengan ligan. Contohnya, pengikatan oksigen oleh besi hemoglobin, atau asid lemak kepada albumin.
Fungsi ligan dalam komposisi protein kompleks adalah pelbagai:
· menukar sifat protein (cas, keterlarutan, labiliti terma), cth. asid fosforik dalam fosfoprotein atau sisa monosakarida dalam glikoprotein,
· melindungi protein daripada proteolisis di luar dan di dalam sel, contohnya, bahagian karbohidrat dalam glikoprotein,
Disediakan sebagai ligan pengangkutan sebatian tidak larut air, seperti pengangkutan lemak oleh lipoprotein,
melekat aktiviti biologi dan mentakrifkan fungsi protein, contohnya asid nukleik dalam nukleoprotein, heme dalam hemoglobin, karbohidrat dalam protein reseptor,
· memberi kesan penembusan membran, penghijrahan intrasel, pengasingan dan rembesan protein. Ini dilakukan, sebagai peraturan, oleh sisa karbohidrat.
Apa lagi yang perlu dibaca
NOTA TERAKHIR
- Kembang kol goreng: cepat, sedap dan sihat Kembang kol goreng tanpa dimasak
- Cara menggoreng kembang kol dalam kuali Berapa minit untuk menggoreng kembang kol dalam kuali
- Lebih lanjut mengenai kebersihan diri
- Borscht ayam yang lazat: resipi langkah demi langkah dengan foto (dalam periuk, dalam periuk perlahan) Cara memasak borscht ayam merah yang lazat
- Kebersihan diri dan kesihatan manusia
