แกนด์. ศูนย์กลางของโปรตีนและปฏิกิริยากับลิแกนด์
โครงสร้างโมดูล | ธีม |
หน่วยโมดูลาร์ 1 | 1.1. การจัดระเบียบโครงสร้างของโปรตีน ขั้นตอนของการก่อตัวของรูปแบบดั้งเดิมของโปรตีน 1.2. พื้นฐานของการทำงานของโปรตีน ยาที่เป็นแกนด์ที่มีผลต่อการทำงานของโปรตีน 1.3. การเปลี่ยนสภาพของโปรตีนและความเป็นไปได้ของการฟื้นฟูโดยธรรมชาติ |
หน่วยโมดูลาร์2 | 1.4. คุณสมบัติของโครงสร้างและการทำงานของโปรตีนโอลิโกเมอร์ในตัวอย่างของเฮโมโกลบิน 1.5. รักษารูปแบบดั้งเดิมของโปรตีนในเซลล์ 1.6. โปรตีนหลากหลายชนิด ตระกูลโปรตีนในตัวอย่างของอิมมูโนโกลบูลิน 1.7. คุณสมบัติทางกายภาพและเคมีของโปรตีนและวิธีการแยกออก |
หน่วยโมดูลาร์ 1 การจัดโครงสร้างโปรตีนโมโนเมอร์และพื้นฐานของการทำงาน
วัตถุประสงค์การเรียนรู้ เพื่อให้สามารถ:
1. ใช้ความรู้เกี่ยวกับลักษณะโครงสร้างของโปรตีนและการพึ่งพาการทำงานของโปรตีนในโครงสร้างเพื่อทำความเข้าใจกลไกของการพัฒนาของกรรมพันธุ์และโปรตีนที่ได้มา
2. อธิบายกลไกการรักษาของยาบางชนิดในรูปของลิแกนด์ที่ทำปฏิกิริยากับโปรตีนและเปลี่ยนแปลงกิจกรรมของยา
3. ใช้ความรู้เกี่ยวกับโครงสร้างและความสามารถในการกำหนดโครงสร้างของโปรตีนเพื่อทำความเข้าใจความไม่แน่นอนของโครงสร้างและหน้าที่การใช้งาน และแนวโน้มที่จะเสื่อมสภาพภายใต้สภาวะที่เปลี่ยนแปลง
4. อธิบายการใช้สารทำให้เสียสภาพเป็นวิธีการฆ่าเชื้อวัสดุและอุปกรณ์ทางการแพทย์ รวมทั้งยาฆ่าเชื้อ
รู้:
1. ระดับ โครงสร้างองค์กรโปรตีน
2. ความสำคัญของโครงสร้างหลักของโปรตีนซึ่งกำหนดความหลากหลายทางโครงสร้างและหน้าที่ของโปรตีน
3. กลไกการก่อตัวในโปรตีน แอคทีฟเซ็นเตอร์และปฏิสัมพันธ์เฉพาะกับลิแกนด์ซึ่งรองรับการทำงานของโปรตีน
4. ตัวอย่างอิทธิพลของลิแกนด์จากภายนอก (ยา สารพิษ สารพิษ) ที่มีต่อโครงสร้างและการทำงานของโปรตีน
5. สาเหตุและผลกระทบของการเสื่อมสภาพของโปรตีน ปัจจัยที่ก่อให้เกิดการเสียสภาพ
6. ตัวอย่างการใช้ปัจจัยที่ทำให้เสียสภาพในยาเป็นน้ำยาฆ่าเชื้อ และวิธีการฆ่าเชื้อเครื่องมือแพทย์
หัวข้อ 1.1. การจัดระเบียบโครงสร้างของโปรตีน ขั้นตอนการสร้างชาวพื้นเมือง
โครงสร้างโปรตีน
โปรตีนเป็นโมเลกุลของพอลิเมอร์ซึ่งมีโมโนเมอร์เพียง 20 α-amino acids ชุดและลำดับการเชื่อมต่อของกรดอะมิโนในโปรตีนถูกกำหนดโดยโครงสร้างของยีนใน DNA ของแต่ละบุคคล โปรตีนแต่ละตัวทำหน้าที่ของตัวเองตามโครงสร้างเฉพาะ ชุดของโปรตีนของสิ่งมีชีวิตที่กำหนดจะกำหนดลักษณะฟีโนไทป์ของมันเช่นเดียวกับการปรากฏตัวของโรคทางพันธุกรรมหรือความโน้มเอียงในการพัฒนาของพวกเขา
1. กรดอะมิโนที่ประกอบเป็นโปรตีน พันธะเปปไทด์โปรตีนเป็นโพลีเมอร์ที่สร้างจากโมโนเมอร์ - กรด α-อะมิโน 20 ตัว สูตรทั่วไปที่
กรดอะมิโนแตกต่างกันในโครงสร้าง ขนาด คุณสมบัติทางเคมีกายภาพของอนุมูลที่ติดอยู่กับอะตอมของ α-คาร์บอน กลุ่มการทำงานของกรดอะมิโนกำหนดคุณสมบัติของคุณสมบัติของกรดα-อะมิโนต่างๆ อนุมูลที่พบในกรด α-amino สามารถแบ่งออกเป็นหลายกลุ่ม:
โพรลีนแตกต่างจากโปรตีนโมโนเมอร์ 19 ชนิดอื่น ๆ ไม่ใช่กรดอะมิโน แต่เป็นกรดอิมิโน เรดิคัลในโพรลีนสัมพันธ์กับทั้งอะตอม α-คาร์บอนและกลุ่มอิมิโน
 กรดอะมิโนมีความสามารถในการละลายในน้ำแตกต่างกันนี่เป็นเพราะความสามารถของอนุมูลอิสระในการทำปฏิกิริยากับน้ำ
กรดอะมิโนมีความสามารถในการละลายในน้ำแตกต่างกันนี่เป็นเพราะความสามารถของอนุมูลอิสระในการทำปฏิกิริยากับน้ำ
ถึง ชอบน้ำรวมถึงอนุมูลที่มีหมู่ฟังก์ชันประจุลบ ประจุบวก และขั้วที่ไม่มีประจุ
ถึง ชอบน้ำรวมถึงอนุมูลที่มีหมู่เมทิล สายโซ่อะลิฟาติกหรือวัฏจักร
2. พันธะเปปไทด์เชื่อมโยงกรดอะมิโนเข้ากับเปปไทด์ในระหว่างการสังเคราะห์เปปไทด์ กลุ่ม α-carboxyl ของกรดอะมิโนหนึ่งตัวจะทำปฏิกิริยากับกลุ่ม α-amino ของกรดอะมิโนอีกตัวหนึ่งเพื่อสร้าง พันธะเปปไทด์:
โปรตีนเป็นโพลีเปปไทด์ กล่าวคือ พอลิเมอร์เชิงเส้นของกรดα-อะมิโนที่เชื่อมต่อด้วยพันธะเปปไทด์ (รูปที่ 1.1.)
 ข้าว. 1.1. คำศัพท์ที่ใช้อธิบายโครงสร้างของเปปไทด์
ข้าว. 1.1. คำศัพท์ที่ใช้อธิบายโครงสร้างของเปปไทด์
โมโนเมอร์ของกรดอะมิโนที่ประกอบเป็นโพลีเปปไทด์เรียกว่า กรดอะมิโนตกค้างห่วงโซ่ของกลุ่มที่ทำซ้ำ - NH-CH-CO- แบบฟอร์ม กระดูกสันหลังเปปไทด์เรซิดิวกรดอะมิโนที่มีหมู่ α-อะมิโนอิสระเรียกว่าปลาย N และตัวที่มีหมู่ α-คาร์บอกซิลอิสระเรียกว่าปลาย C เปปไทด์เขียนและอ่านจากปลาย N ถึงปลาย C
พันธะเปปไทด์ที่เกิดจากกลุ่มอิมิโนของโพรลีนแตกต่างจากพันธะเปปไทด์อื่น: อะตอมไนโตรเจนของกลุ่มเปปไทด์ขาดไฮโดรเจน
แต่มีพันธะกับอนุมูลอิสระ ส่งผลให้ด้านหนึ่งของวัฏจักรรวมอยู่ในกระดูกสันหลังของเปปไทด์:
 เปปไทด์ต่างกันในองค์ประกอบของกรดอะมิโน จำนวนกรดอะมิโนและลำดับของกรดอะมิโน เช่น Ser-Ala-Glu-Gis และ His-Glu-Ala-Ser เป็นเปปไทด์สองชนิดที่แตกต่างกัน
เปปไทด์ต่างกันในองค์ประกอบของกรดอะมิโน จำนวนกรดอะมิโนและลำดับของกรดอะมิโน เช่น Ser-Ala-Glu-Gis และ His-Glu-Ala-Ser เป็นเปปไทด์สองชนิดที่แตกต่างกัน
พันธะเปปไทด์มีความแข็งแรงมาก และการไฮโดรไลซิสที่ไม่ใช่เอนไซม์ของพวกมันต้องการสภาวะที่รุนแรง: โปรตีนที่จะวิเคราะห์จะถูกไฮโดรไลซ์ในกรดไฮโดรคลอริกเข้มข้นที่อุณหภูมิประมาณ 110°C เป็นเวลา 24 ชั่วโมง ในเซลล์ที่มีชีวิต พันธะเปปไทด์สามารถถูกทำลายได้โดย เอนไซม์โปรตีโอไลติก,เรียกว่า โปรตีเอสหรือ เปปไทด์ไฮโดรเลส
3. โครงสร้างหลักของโปรตีนกรดอะมิโนตกค้างในสายโซ่เปปไทด์ของโปรตีนต่างๆ ไม่ได้สลับกันแบบสุ่ม แต่จะจัดเรียงตามลำดับที่แน่นอน ลำดับเชิงเส้นหรือลำดับของเรซิดิวกรดอะมิโนในสายพอลิเปปไทด์เรียกว่า โครงสร้างหลักของโปรตีน
โครงสร้างหลักของโปรตีนแต่ละชนิดถูกเข้ารหัสในโมเลกุลดีเอ็นเอ (ในบริเวณที่เรียกว่ายีน) และนำไปใช้ในระหว่างการถอดรหัส (เขียนข้อมูลใหม่บน mRNA) และการแปล (การสังเคราะห์โครงสร้างหลักของโปรตีน) ดังนั้นโครงสร้างหลักของโปรตีนของแต่ละบุคคลจึงเป็นข้อมูลที่สืบทอดมาจากพ่อแม่สู่ลูกซึ่งกำหนดลักษณะโครงสร้างของโปรตีนของสิ่งมีชีวิตที่กำหนดซึ่งหน้าที่ของโปรตีนที่มีอยู่ขึ้นอยู่กับ (รูปที่ 1.2.)
 ข้าว. 1.2. ความสัมพันธ์ระหว่างจีโนไทป์และโครงสร้างของโปรตีนที่สังเคราะห์ในร่างกายของแต่ละบุคคล
ข้าว. 1.2. ความสัมพันธ์ระหว่างจีโนไทป์และโครงสร้างของโปรตีนที่สังเคราะห์ในร่างกายของแต่ละบุคคล
โปรตีนแต่ละตัวในร่างกายมนุษย์ประมาณ 100,000 ตัวมี มีเอกลักษณ์โครงสร้างหลัก โมเลกุลของโปรตีนชนิดหนึ่ง (เช่น อัลบูมิน) มีการสลับของกรดอะมิโนที่ตกค้างเหมือนกัน ซึ่งแยกอัลบูมินออกจากโปรตีนแต่ละชนิด
ลำดับของเรซิดิวกรดอะมิโนในสายเปปไทด์ถือได้ว่าเป็นรูปแบบของการบันทึกข้อมูล ข้อมูลนี้กำหนดช่องว่างเชิงพื้นที่ของสายเปปไทด์เชิงเส้นให้เป็นโครงสร้างสามมิติที่มีขนาดกะทัดรัดมากขึ้นซึ่งเรียกว่า โครงสร้างกระรอก. กระบวนการของการก่อตัวของโครงสร้างโปรตีนที่ใช้งานได้เรียกว่า พับ.
4. โครงสร้างของโปรตีนการหมุนอย่างอิสระในกระดูกสันหลังของเปปไทด์เป็นไปได้ระหว่างอะตอมไนโตรเจนของกลุ่มเปปไทด์กับอะตอม α-คาร์บอนที่อยู่ใกล้เคียง เช่นเดียวกับระหว่างอะตอมของคาร์บอนิล-คาร์บอนและกลุ่มคาร์บอนิล เนื่องจากการทำงานร่วมกันของหมู่ฟังก์ชันของกรดอะมิโนตกค้าง โครงสร้างหลักของโปรตีนจึงสามารถได้รับโครงสร้างเชิงพื้นที่ที่ซับซ้อนมากขึ้น ในโปรตีนทรงกลมการพับสองระดับหลักของโครงสร้างของเปปไทด์มีความโดดเด่น: รองและ โครงสร้างระดับอุดมศึกษา
โครงสร้างรองโปรตีน- นี่คือโครงสร้างเชิงพื้นที่ที่เกิดขึ้นจากการก่อตัวของพันธะไฮโดรเจนระหว่างหมู่ฟังก์ชัน -C=O และ -NH- ของแกนหลักของเปปไทด์ ในกรณีนี้ ห่วงโซ่เปปไทด์สามารถรับโครงสร้างปกติได้สองประเภท: α-helicesและ โครงสร้าง β
ที่ α-helicesพันธะไฮโดรเจนเกิดขึ้นระหว่างอะตอมออกซิเจนของกลุ่มคาร์บอนิลและไฮโดรเจนของอะไมด์ไนโตรเจนของกรดอะมิโนที่ 4 จากนั้น สายข้างของกรดอะมิโนตกค้าง
ตั้งอยู่รอบนอกของเกลียวไม่มีส่วนร่วมในการก่อตัวของโครงสร้างรอง (รูปที่ 1.3.)
อนุมูลขนาดใหญ่หรืออนุมูลที่มีประจุเดียวกันป้องกันการก่อตัวของ α-helix สารตกค้างของโพรลีนซึ่งมีโครงสร้างเป็นวงแหวนจะขัดขวาง α-helix เนื่องจากการขาดไฮโดรเจนที่อะตอมไนโตรเจนในสายโซ่เปปไทด์จึงเป็นไปไม่ได้ที่จะสร้างพันธะไฮโดรเจน พันธะระหว่างไนโตรเจนกับอะตอม α-คาร์บอนเป็นส่วนหนึ่งของวัฏจักรโพรลีน ดังนั้นกระดูกสันหลังของเปปไทด์จึงเกิดการโค้งงอในที่นี้
β-โครงสร้างเกิดขึ้นระหว่างบริเวณเส้นตรงของแกนหลักของเปปไทด์ของสายพอลิเปปไทด์หนึ่งสาย ทำให้เกิดโครงสร้างที่พับ สายโพลีเปปไทด์หรือส่วนของพวกมันสามารถก่อรูปได้ ขนานหรือ โครงสร้าง β ที่ต้านขนานกันในกรณีแรก ขั้ว N- และ C ของสายเปปไทด์ที่มีปฏิสัมพันธ์ตรงกัน และในกรณีที่สอง ขั้วทั้งสองมีทิศทางตรงกันข้าม (รูปที่ 1.4)
ข้าว. 1.3. โครงสร้างรองของโปรตีน - α-helix
 ข้าว. 1.4. โครงสร้างจีบแบบขนานและแบบคู่ขนาน
ข้าว. 1.4. โครงสร้างจีบแบบขนานและแบบคู่ขนาน
โครงสร้าง β ถูกระบุด้วยลูกศรกว้าง: A - โครงสร้างต้านขนาน β B - โครงสร้างจีบแบบคู่ขนาน
ในโปรตีนบางชนิด โครงสร้าง β สามารถเกิดขึ้นได้เนื่องจากการก่อตัวของพันธะไฮโดรเจนระหว่างอะตอมของแกนหลักเปปไทด์ของสายโซ่โพลีเปปไทด์ที่ต่างกัน
ยังพบในโปรตีน พื้นที่ที่มีระดับทุติยภูมิผิดปกติโครงสร้างซึ่งรวมถึงส่วนโค้ง ลูป การหมุนของแกนหลักโพลีเปปไทด์ พวกมันมักจะอยู่ในสถานที่ที่ทิศทางของห่วงโซ่เปปไทด์เปลี่ยนไป ตัวอย่างเช่น ระหว่างการก่อตัวของโครงสร้างแผ่น β ขนาน
ด้วยการมีอยู่ของ α-helices และ β-โครงสร้าง โปรตีนทรงกลมสามารถแบ่งออกเป็นสี่ประเภท
ข้าว. 1.5. โครงสร้างรองของ myoglobin (A) และ hemoglobin β-chain (B) ซึ่งประกอบด้วย α-helices แปดตัว
 ข้าว. 1.6. โครงสร้างรองของไอโซเมอเรสไตรโอสฟอสเฟตและโดเมนไคเนสไพรูเวต
ข้าว. 1.6. โครงสร้างรองของไอโซเมอเรสไตรโอสฟอสเฟตและโดเมนไคเนสไพรูเวต
 ข้าว. 1.7. โครงสร้างรองของโดเมนคงที่อิมมูโนโกลบูลิน (A) และเอนไซม์ซูเปอร์ออกไซด์ดิสมิวเตส (B)
ข้าว. 1.7. โครงสร้างรองของโดเมนคงที่อิมมูโนโกลบูลิน (A) และเอนไซม์ซูเปอร์ออกไซด์ดิสมิวเตส (B)
ที่ หมวดที่สี่รวมโปรตีนที่มีโครงสร้างรองปกติจำนวนเล็กน้อยในองค์ประกอบ โปรตีนเหล่านี้รวมถึงโปรตีนขนาดเล็กที่อุดมด้วยซิสเทอีนหรือเมทัลโลโปรตีน
โครงสร้างตติยของโปรตีน- ประเภทของโครงสร้างที่เกิดขึ้นจากการทำงานร่วมกันระหว่างอนุมูลของกรดอะมิโนซึ่งสามารถอยู่ในระยะที่ห่างจากกันมากในสายเปปไทด์ ในกรณีนี้ โปรตีนส่วนใหญ่สร้างโครงสร้างเชิงพื้นที่คล้ายกับทรงกลม (โปรตีนทรงกลม)
เนื่องจากอนุมูลที่ไม่ชอบน้ำของกรดอะมิโนมักจะรวมกันด้วยความช่วยเหลือของสิ่งที่เรียกว่า ปฏิกิริยาที่ไม่ชอบน้ำและแรงระหว่างโมเลกุลของ van der Waals แกนกลางที่ไม่ชอบน้ำหนาแน่นจะก่อตัวขึ้นภายในโปรตีนทรงกลม อนุมูลอิสระที่ชอบน้ำและไม่แตกตัวเป็นไอออนส่วนใหญ่ตั้งอยู่บนผิวของโปรตีนและกำหนดความสามารถในการละลายในน้ำ
 ข้าว. 1.8. ประเภทของพันธะที่เกิดขึ้นระหว่างอนุมูลของกรดอะมิโนระหว่างการก่อตัวของโครงสร้างระดับอุดมศึกษาของโปรตีน
ข้าว. 1.8. ประเภทของพันธะที่เกิดขึ้นระหว่างอนุมูลของกรดอะมิโนระหว่างการก่อตัวของโครงสร้างระดับอุดมศึกษาของโปรตีน
1 - พันธะไอออนิก- เกิดขึ้นระหว่างกลุ่มฟังก์ชันที่มีประจุบวกและลบ
2 - พันธะไฮโดรเจน- เกิดขึ้นระหว่าง hydrophilic uncharged และ hydrophilic group อื่น ๆ
3 - ปฏิกิริยาที่ไม่ชอบน้ำ- เกิดขึ้นระหว่างอนุมูลที่ไม่ชอบน้ำ
4 - พันธะซัลไฟด์- เกิดขึ้นจากการเกิดออกซิเดชันของกลุ่ม SH ของซิสเทอีนตกค้างและปฏิสัมพันธ์ซึ่งกันและกัน
สารตกค้างของกรดอะมิโนที่ชอบน้ำภายในแกนที่ไม่ชอบน้ำสามารถโต้ตอบกันได้โดยใช้ ไอออนิกและ พันธะไฮโดรเจน(รูปที่ 1.8).
พันธะไอออนิกและไฮโดรเจน เช่นเดียวกับปฏิกิริยาที่ไม่ชอบน้ำ เป็นหนึ่งในพันธะที่อ่อนแอ: พลังงานของพวกมันจะมากกว่าพลังงานของการเคลื่อนที่ด้วยความร้อนของโมเลกุลที่อุณหภูมิห้องเล็กน้อย โครงสร้างของโปรตีนจะคงอยู่โดยการเกิดพันธะที่อ่อนแอดังกล่าวจำนวนมาก เนื่องจากอะตอมที่ประกอบเป็นโปรตีนมีการเคลื่อนที่อย่างต่อเนื่อง จึงเป็นไปได้ที่จะทำลายพันธะที่อ่อนแอและสร้างพันธะอื่นๆ ซึ่งนำไปสู่การเคลื่อนไหวเล็กๆ ของแต่ละส่วนของสายโซ่โพลีเปปไทด์ คุณสมบัติของโปรตีนนี้ในการเปลี่ยนรูปแบบอันเป็นผลมาจากการทำลายบางส่วนและสร้างพันธะที่อ่อนแออื่น ๆ เรียกว่า lability เชิงโครงสร้าง
ร่างกายมนุษย์มีระบบที่รองรับ สภาวะสมดุล- ความคงตัวของสภาพแวดล้อมภายในภายในขอบเขตที่ยอมรับได้สำหรับสิ่งมีชีวิตที่มีสุขภาพดี ภายใต้สภาวะของสภาวะสมดุล การเปลี่ยนแปลงเล็กน้อยในโครงสร้างจะไม่รบกวนโครงสร้างและหน้าที่โดยรวมของโปรตีน โครงสร้างที่ออกฤทธิ์ตามหน้าที่ของโปรตีนเรียกว่า รูปแบบพื้นเมืองการเปลี่ยนแปลงสภาพแวดล้อมภายใน (เช่น ความเข้มข้นของกลูโคส ไอออนของ Ca โปรตอน ฯลฯ) นำไปสู่การเปลี่ยนแปลงในรูปแบบและการหยุดชะงักของหน้าที่ของโปรตีน
โครงสร้างระดับอุดมศึกษาของโปรตีนบางชนิดมีความเสถียร พันธะซัลไฟด์,เกิดขึ้นจากอันตรกิริยาของหมู่ -SH ของสองเรซิดิว
 ข้าว. 1.9. การก่อตัวของพันธะไดซัลไฟด์ในโมเลกุลโปรตีน
ข้าว. 1.9. การก่อตัวของพันธะไดซัลไฟด์ในโมเลกุลโปรตีน
ซิสเทอีน (รูปที่ 1.9) โปรตีนภายในเซลล์ส่วนใหญ่ไม่มีพันธะโควาเลนต์ไดซัลไฟด์ในโครงสร้างระดับอุดมศึกษา การปรากฏตัวของพวกมันเป็นลักษณะของโปรตีนที่หลั่งออกมาจากเซลล์ ซึ่งทำให้มั่นใจในความเสถียรที่มากขึ้นในสภาวะนอกเซลล์ ดังนั้นพันธะซัลไฟด์จึงมีอยู่ในโมเลกุลของอินซูลินและอิมมูโนโกลบูลิน
อินซูลิน- ฮอร์โมนโปรตีนที่สังเคราะห์ขึ้นในเซลล์ β ของตับอ่อนและหลั่งเข้าสู่กระแสเลือดเพื่อตอบสนองต่อการเพิ่มความเข้มข้นของกลูโคสในเลือด ในโครงสร้างของอินซูลิน มีพันธะไดซัลไฟด์สองพันธะที่เชื่อมต่อสายโซ่ A และ B ของโพลีเปปไทด์ และพันธะไดซัลไฟด์หนึ่งพันธะภายในสาย A (รูปที่ 1.10)
 ข้าว. 1.10. พันธะซัลไฟด์ในโครงสร้างของอินซูลิน
ข้าว. 1.10. พันธะซัลไฟด์ในโครงสร้างของอินซูลิน
5. โครงสร้างรองสุดยอดของโปรตีนในโปรตีนที่แตกต่างกันในโครงสร้างและหน้าที่หลัก บางครั้ง การรวมกันและการวางซ้อนของโครงสร้างทุติยภูมิที่คล้ายคลึงกันซึ่งเรียกว่าโครงสร้าง supersecondary มันครองตำแหน่งกลางระหว่างโครงสร้างทุติยภูมิและตติยภูมิเนื่องจากเป็นส่วนผสมเฉพาะขององค์ประกอบโครงสร้างทุติยภูมิในระหว่างการก่อตัวของโครงสร้างระดับอุดมศึกษาของโปรตีน โครงสร้าง supersecondary มีชื่อเฉพาะเช่น "α-helix-turn-a-helix", "leucine zipper", "zinc finger" เป็นต้น โครงสร้าง supersecondary ดังกล่าวเป็นลักษณะของโปรตีนที่จับกับดีเอ็นเอ
"ลิวซีนซิป".โครงสร้างซูเปอร์ทุติยภูมิประเภทนี้ใช้เชื่อมต่อโปรตีนสองชนิด บนพื้นผิวของโปรตีนที่มีปฏิสัมพันธ์กันมีบริเวณลาน α-helical ที่มีลิวซีนตกค้างอย่างน้อยสี่ตัว ลิวซีนตกค้างใน α-helix มีกรดอะมิโน 6 ตัวแยกจากกัน เนื่องจากแต่ละรอบของ α-helix มีเรซิดิวกรดอะมิโน 3.6 ตัว จึงพบอนุมูลลิวซีนบนผิวของเทิร์นอื่นๆ ตกค้าง leucine ของ α-helix ของโปรตีนหนึ่งสามารถโต้ตอบกับ leucine ตกค้างของโปรตีนอื่น (ปฏิกิริยาไม่ชอบน้ำ) เชื่อมต่อเข้าด้วยกัน (รูปที่ 1.11) โปรตีนที่จับกับดีเอ็นเอจำนวนมากทำงานเป็นส่วนหนึ่งของสารเชิงซ้อนโอลิโกเมอริก ซึ่งแต่ละหน่วยย่อยจะเชื่อมโยงถึงกันโดย "ลิวซีนซิป"
 ข้าว. 1.11. "ลิวซีนซิป" ระหว่างบริเวณ α-helical ของโปรตีนสองตัว
ข้าว. 1.11. "ลิวซีนซิป" ระหว่างบริเวณ α-helical ของโปรตีนสองตัว
ฮิสโตนเป็นตัวอย่างของโปรตีนดังกล่าว ฮิสโตนส์- โปรตีนนิวเคลียร์ซึ่งรวมถึง จำนวนมากของกรดอะมิโนที่มีประจุบวก - อาร์จินีนและไลซีน (มากถึง 80%) โมเลกุลของฮิสโตนถูกรวมเข้ากับสารเชิงซ้อนโอลิโกเมอร์ที่มีโมโนเมอร์แปดตัวโดยใช้ "สารยึดลิวซีน" แม้ว่าจะมีประจุที่มีนัยสำคัญของโมเลกุลเหล่านี้ก็ตาม
"นิ้วสังกะสี"- ความแตกต่างของโครงสร้าง supersecondary ซึ่งเป็นลักษณะของโปรตีนที่จับกับ DNA มีรูปแบบของชิ้นส่วนที่ยืดออกบนพื้นผิวของโปรตีนและมีกรดอะมิโนตกค้างประมาณ 20 ชนิด (รูปที่ 1.12) รูปร่างของ "นิ้วที่เหยียด" ได้รับการสนับสนุนโดยอะตอมของสังกะสีที่เกี่ยวข้องกับอนุมูลของกรดอะมิโนสี่ตัว - ซิสเทอีนตกค้างสองตัวและฮิสทิดีนสองตัว ในบางกรณี แทนที่จะเป็นสารตกค้างของฮิสทิดีน มีซิสเทอีนตกค้างอยู่ ซิสเทอีนตกค้าง 2 ตัวที่เว้นระยะห่างอย่างใกล้ชิดนั้นแยกออกจากส่วนที่เหลือของ Gisili อีก 2 ตัวโดยลำดับ Cys ของกรดอะมิโนประมาณ 12 ตัว บริเวณนี้ของโปรตีนก่อตัวเป็นเกลียว α ซึ่งอนุมูลซึ่งสามารถจับกับบริเวณควบคุมของร่องหลักของ DNA ได้โดยเฉพาะ ความจำเพาะของการผูกมัดของแต่ละบุคคล
 ข้าว. 1.12. โครงสร้างหลักของส่วนของโปรตีนที่จับกับดีเอ็นเอที่สร้างโครงสร้าง "นิ้วสังกะสี" (ตัวอักษรระบุถึงกรดอะมิโนที่ประกอบเป็นโครงสร้างนี้)
ข้าว. 1.12. โครงสร้างหลักของส่วนของโปรตีนที่จับกับดีเอ็นเอที่สร้างโครงสร้าง "นิ้วสังกะสี" (ตัวอักษรระบุถึงกรดอะมิโนที่ประกอบเป็นโครงสร้างนี้)
โปรตีนที่จับกับดีเอ็นเอควบคุมจะขึ้นอยู่กับลำดับของกรดอะมิโนตกค้างที่อยู่ใน "นิ้วสังกะสี" โดยเฉพาะอย่างยิ่ง โครงสร้างดังกล่าวประกอบด้วยตัวรับฮอร์โมนสเตียรอยด์ที่เกี่ยวข้องกับการควบคุมการถอดรหัส (การอ่านข้อมูลจาก DNA ไปยัง RNA)
หัวข้อ 1.2. พื้นฐานของการทำงานของโปรตีน ยาที่เป็นแกนด์ที่มีผลต่อการทำงานของโปรตีน
1. ศูนย์กลางของโปรตีนและการมีปฏิสัมพันธ์กับแกนด์ในระหว่างการก่อตัวของโครงสร้างระดับอุดมศึกษา บนพื้นผิวของโปรตีนที่ใช้งานได้ซึ่งมักจะอยู่ในช่อง ไซต์จะถูกสร้างขึ้นโดยอนุมูลของกรดอะมิโนที่อยู่ห่างไกลกันในโครงสร้างหลัก ไซต์นี้ซึ่งมีโครงสร้างเฉพาะสำหรับโปรตีนที่กำหนดและสามารถโต้ตอบอย่างจำเพาะกับโมเลกุลบางตัวหรือกลุ่มของโมเลกุลที่คล้ายคลึงกัน เรียกว่าไซต์การจับโปรตีนที่มีลิแกนด์หรือไซต์ที่ทำงานอยู่ แกนด์เป็นโมเลกุลที่ทำปฏิกิริยากับโปรตีน
ความจำเพาะสูงปฏิสัมพันธ์ของโปรตีนกับลิแกนด์ได้รับการประกันโดยความสมบูรณ์ของโครงสร้างของศูนย์แอคทีฟที่มีโครงสร้างของลิแกนด์
การเติมเต็มคือความสัมพันธ์เชิงพื้นที่และทางเคมีของพื้นผิวที่มีปฏิสัมพันธ์กัน ศูนย์แอคทีฟจะต้องไม่สัมพันธ์เชิงพื้นที่กับลิแกนด์ที่รวมอยู่ในนั้นเท่านั้น แต่พันธะ (อันตรกิริยาของไอออนิก ไฮโดรเจน และไม่ชอบน้ำ) จะต้องก่อตัวขึ้นระหว่างกลุ่มการทำงานของอนุมูลที่รวมอยู่ในศูนย์กลางแอคทีฟและลิแกนด์ ซึ่งทำให้ลิแกนด์อยู่ใน ศูนย์แอคทีฟ (รูปที่ 1.13 )
 ข้าว. 1.13. ปฏิกิริยาเสริมของโปรตีนกับลิแกนด์
ข้าว. 1.13. ปฏิกิริยาเสริมของโปรตีนกับลิแกนด์
ลิแกนด์บางตัวเมื่อยึดติดกับศูนย์กลางของโปรตีน จะมีบทบาทสำคัญในการทำงานของโปรตีน ลิแกนด์ดังกล่าวเรียกว่าโคแฟคเตอร์และโปรตีนที่มีองค์ประกอบที่ไม่ใช่โปรตีนเรียกว่า โปรตีนที่ซับซ้อน(ตรงกันข้ามกับโปรตีนอย่างง่าย ประกอบด้วยส่วนโปรตีนเท่านั้น) ส่วนที่ไม่ใช่โปรตีนที่ยึดติดกับโปรตีนอย่างแน่นหนาเรียกว่า กลุ่มเทียมตัวอย่างเช่น องค์ประกอบของ myoglobin, hemoglobin และ cytochromes มีกลุ่มเทียมที่ติดอยู่กับศูนย์ที่ใช้งานอยู่อย่างแน่นหนา - heme ที่มีไอออนเหล็ก โปรตีนเชิงซ้อนที่มี heme เรียกว่า hemoproteins
เมื่อลิแกนด์จำเพาะต่อโปรตีน หน้าที่ของโปรตีนเหล่านี้จะแสดงออกมา ดังนั้นอัลบูมินซึ่งเป็นโปรตีนที่สำคัญที่สุดในพลาสมาจึงแสดงหน้าที่การขนส่งโดยยึดแกนด์ที่ไม่ชอบน้ำเข้ากับศูนย์กลางที่ทำงานอยู่ เช่น กรดไขมัน, บิลิรูบิน, ยาบางชนิด เป็นต้น (รูปที่ 1.14)
ลิแกนด์ที่ทำปฏิกิริยากับโครงสร้างสามมิติของสายเปปไทด์ไม่เพียงแต่เป็นโมเลกุลอินทรีย์และอนินทรีย์ที่มีน้ำหนักโมเลกุลต่ำเท่านั้น แต่ยังรวมถึงโมเลกุลขนาดใหญ่ด้วย:
ดีเอ็นเอ (ตัวอย่างที่อภิปรายข้างต้นด้วยโปรตีนที่จับกับดีเอ็นเอ);
โพลีแซ็กคาไรด์;
 ข้าว. 1.14. ความสัมพันธ์ระหว่างจีโนไทป์และฟีโนไทป์
ข้าว. 1.14. ความสัมพันธ์ระหว่างจีโนไทป์และฟีโนไทป์
โครงสร้างหลักอันเป็นเอกลักษณ์ของโปรตีนของมนุษย์ ซึ่งเข้ารหัสไว้ในโมเลกุลดีเอ็นเอ ถูกทำให้เป็นจริงในเซลล์ในรูปแบบของโครงสร้างที่มีลักษณะเฉพาะ โครงสร้างแอคทีฟไซต์ และหน้าที่ของโปรตีน
ในกรณีเหล่านี้ โปรตีนรับรู้บริเวณจำเพาะของลิแกนด์ที่สมส่วนกับตำแหน่งการจับ ดังนั้นบนพื้นผิวของเซลล์ตับจึงมีโปรตีนตัวรับสำหรับฮอร์โมนอินซูลินซึ่งมีโครงสร้างโปรตีนด้วย ปฏิสัมพันธ์ของอินซูลินกับตัวรับทำให้เกิดการเปลี่ยนแปลงในรูปแบบและการกระตุ้นระบบสัญญาณซึ่งนำไปสู่การสะสมของสารอาหารในเซลล์ตับหลังรับประทานอาหาร
ดังนั้น, การทำงานของโปรตีนขึ้นอยู่กับปฏิสัมพันธ์เฉพาะของศูนย์กลางการทำงานของโปรตีนกับแกนด์
2. โครงสร้างโดเมนและบทบาทในการทำงานของโปรตีนสายโพลีเปปไทด์แบบยาวของโปรตีนทรงกลมมักจะพับเป็นบริเวณที่มีขนาดกะทัดรัดและค่อนข้างอิสระหลายแห่ง พวกมันมีโครงสร้างตติยภูมิอิสระ คล้ายกับโปรตีนทรงกลม และเรียกว่า โดเมนเนื่องจากโครงสร้างโดเมนของโปรตีน โครงสร้างระดับตติยภูมิจึงง่ายต่อการสร้าง
ในโปรตีนของโดเมน ตำแหน่งการจับลิแกนด์มักจะตั้งอยู่ระหว่างโดเมน ดังนั้นทริปซินจึงเป็นเอนไซม์ย่อยโปรตีนที่ผลิตโดยส่วนตับอ่อนของตับอ่อนและจำเป็นสำหรับการย่อยโปรตีนในอาหาร มีโครงสร้างแบบสองโดเมน และตำแหน่งจับของทริปซินกับลิแกนด์ - โปรตีนจากอาหาร - ตั้งอยู่ในร่องระหว่างสองโดเมน ในศูนย์ปฏิบัติการ สภาวะที่จำเป็นสำหรับการจับอย่างมีประสิทธิภาพของตำแหน่งเฉพาะของโปรตีนในอาหารและการไฮโดรไลซิสของพันธะเปปไทด์จะถูกสร้างขึ้น
โดเมนที่แตกต่างกันในโปรตีนสามารถเคลื่อนที่สัมพันธ์กันเมื่อศูนย์กลางที่ทำงานโต้ตอบกับลิแกนด์ (รูปที่ 1.15)
เฮกโซคินาเสะ- เอ็นไซม์ที่เร่งปฏิกิริยาฟอสโฟรีเลชั่นของกลูโคสด้วยความช่วยเหลือของเอทีพี แอคทีฟไซต์ของเอ็นไซม์อยู่ในรอยแยกระหว่างสองโดเมน เมื่อเฮกโซไคเนสจับกับกลูโคส โดเมนโดยรอบจะปิดและซับสเตรตจะถูกดักจับ ซึ่งเกิดฟอสโฟรีเลชัน (ดูรูปที่ 1.15)
 ข้าว. 1.15. การจับโดเมนเฮกโซไคเนสกับกลูโคส
ข้าว. 1.15. การจับโดเมนเฮกโซไคเนสกับกลูโคส
ในโปรตีนบางชนิด โดเมนทำหน้าที่อิสระโดยจับกับลิแกนด์ต่างๆ โปรตีนดังกล่าวเรียกว่ามัลติฟังก์ชั่น
3. ยา-ลิแกนด์ที่ส่งผลต่อการทำงานของโปรตีนปฏิสัมพันธ์ของโปรตีนกับลิแกนด์มีความเฉพาะเจาะจง อย่างไรก็ตาม เนื่องจากความสามารถในการระบุโครงสร้างของโปรตีนและตำแหน่งที่ทำงานของมัน จึงเป็นไปได้ที่จะเลือกสารอื่นที่สามารถโต้ตอบกับโปรตีนในบริเวณที่ทำงานหรือส่วนอื่นของโมเลกุลได้
สารที่มีโครงสร้างคล้ายกับลิแกนด์ตามธรรมชาติเรียกว่า อะนาล็อกโครงสร้างของลิแกนด์หรือแกนด์ที่ผิดธรรมชาติ นอกจากนี้ยังทำปฏิกิริยากับโปรตีนในบริเวณที่ทำงานอยู่ โครงสร้างแอนะล็อกของลิแกนด์สามารถเพิ่มการทำงานของโปรตีนได้ (ตัวเอก)แล้วก็ลด (ศัตรู).ลิแกนด์และโครงสร้างที่คล้ายคลึงกันจะแข่งขันกันเพื่อจับโปรตีนที่ตำแหน่งเดียวกัน สารดังกล่าวเรียกว่า โมดูเลเตอร์การแข่งขัน(ตัวควบคุม) ของการทำงานของโปรตีน มากมาย ยาทำหน้าที่เป็นตัวยับยั้งโปรตีน บางส่วนได้มาจากการดัดแปลงทางเคมีของแกนด์ตามธรรมชาติ สารยับยั้งการทำงานของโปรตีนอาจเป็นยาและสารพิษ
Atropine เป็นตัวยับยั้งการแข่งขันของตัวรับ M-cholinergicอะเซทิลโคลีนเป็นสารสื่อประสาทสำหรับส่งผ่านแรงกระตุ้นของเส้นประสาทผ่านไซแนปส์ cholinergic ในการกระตุ้นให้เกิดการกระตุ้น acetylcholine ที่ปล่อยออกมาในช่อง synaptic จะต้องโต้ตอบกับโปรตีน - ตัวรับของเยื่อหุ้มเซลล์ postsynaptic พบสองประเภท ตัวรับ cholinergic:
ตัวรับ Mนอกจาก acetylcholine แล้วยังเลือกโต้ตอบกับ muscarine (fly agaric toxin) M - ตัวรับ cholinergic มีอยู่ในกล้ามเนื้อเรียบและเมื่อมีปฏิสัมพันธ์กับ acetylcholine จะทำให้เกิดการหดตัว
ตัวรับ Hผูกติดกับนิโคตินโดยเฉพาะ ตัวรับ N-cholinergic พบได้ใน synapses ของ striated กล้ามเนื้อลาย.
สารยับยั้งจำเพาะ ตัวรับ M-cholinergicคืออะโทรพีน พบในพืชจำพวกเบลลาดอนน่าและเฮนเบน
 Atropine มีกลุ่มการทำงานและการจัดเรียงเชิงพื้นที่คล้ายกับ acetylcholine ในโครงสร้าง ดังนั้นจึงเป็นของตัวยับยั้งการแข่งขันของตัวรับ M-cholinergic เนื่องจากการจับกันของ acetylcholine กับตัวรับ M-cholinergic ทำให้เกิดการหดตัวของกล้ามเนื้อเรียบ atropine จึงถูกใช้เป็นยาที่ช่วยบรรเทาอาการกระตุก (ต้านอาการกระสับกระส่าย).ดังนั้นจึงเป็นที่ทราบกันดีว่าการใช้ atropine เพื่อผ่อนคลายกล้ามเนื้อตาเมื่อดูอวัยวะและบรรเทาอาการกระตุกในอาการจุกเสียดในทางเดินอาหาร ตัวรับ M-cholinergic ยังมีอยู่ที่ส่วนกลาง ระบบประสาท(CNS) ดังนั้นการให้ atropine ในปริมาณมากอาจทำให้เกิดปฏิกิริยาที่ไม่พึงประสงค์จากระบบประสาทส่วนกลาง: การเคลื่อนไหวและจิตใจที่ปั่นป่วน, ภาพหลอน, การชัก
Atropine มีกลุ่มการทำงานและการจัดเรียงเชิงพื้นที่คล้ายกับ acetylcholine ในโครงสร้าง ดังนั้นจึงเป็นของตัวยับยั้งการแข่งขันของตัวรับ M-cholinergic เนื่องจากการจับกันของ acetylcholine กับตัวรับ M-cholinergic ทำให้เกิดการหดตัวของกล้ามเนื้อเรียบ atropine จึงถูกใช้เป็นยาที่ช่วยบรรเทาอาการกระตุก (ต้านอาการกระสับกระส่าย).ดังนั้นจึงเป็นที่ทราบกันดีว่าการใช้ atropine เพื่อผ่อนคลายกล้ามเนื้อตาเมื่อดูอวัยวะและบรรเทาอาการกระตุกในอาการจุกเสียดในทางเดินอาหาร ตัวรับ M-cholinergic ยังมีอยู่ที่ส่วนกลาง ระบบประสาท(CNS) ดังนั้นการให้ atropine ในปริมาณมากอาจทำให้เกิดปฏิกิริยาที่ไม่พึงประสงค์จากระบบประสาทส่วนกลาง: การเคลื่อนไหวและจิตใจที่ปั่นป่วน, ภาพหลอน, การชัก
Ditilin เป็นตัวเร่งการแข่งขันของตัวรับ H-cholinergic ที่ยับยั้งการทำงานของประสาทและกล้ามเนื้อ synapses
 ประสาทและกล้ามเนื้อของกล้ามเนื้อโครงร่างประกอบด้วยตัวรับ H-cholinergic การมีปฏิสัมพันธ์กับ acetylcholine ทำให้กล้ามเนื้อหดตัว ในการผ่าตัดบางอย่างเช่นเดียวกับในการศึกษาส่องกล้อง ใช้ยาที่ทำให้กล้ามเนื้อโครงร่างผ่อนคลาย (ยาคลายกล้ามเนื้อ).ซึ่งรวมถึงไดไทลินซึ่งเป็นอะซิติลโคลีนที่มีโครงสร้างคล้ายคลึงกัน มันยึดติดกับตัวรับ H-cholinergic แต่ต่างจาก acetylcholine เอนไซม์ acetylcholinesterase ถูกทำลายอย่างช้าๆ อันเป็นผลมาจากการเปิดช่องไอออนเป็นเวลานานและการสลับขั้วของเมมเบรนอย่างต่อเนื่อง การนำกระแสประสาทจะหยุดชะงักและเกิดการคลายตัวของกล้ามเนื้อ ในขั้นต้นพบคุณสมบัติเหล่านี้ในพิษของ curare ดังนั้นจึงเรียกว่ายาดังกล่าว คูราริฟอร์ม
ประสาทและกล้ามเนื้อของกล้ามเนื้อโครงร่างประกอบด้วยตัวรับ H-cholinergic การมีปฏิสัมพันธ์กับ acetylcholine ทำให้กล้ามเนื้อหดตัว ในการผ่าตัดบางอย่างเช่นเดียวกับในการศึกษาส่องกล้อง ใช้ยาที่ทำให้กล้ามเนื้อโครงร่างผ่อนคลาย (ยาคลายกล้ามเนื้อ).ซึ่งรวมถึงไดไทลินซึ่งเป็นอะซิติลโคลีนที่มีโครงสร้างคล้ายคลึงกัน มันยึดติดกับตัวรับ H-cholinergic แต่ต่างจาก acetylcholine เอนไซม์ acetylcholinesterase ถูกทำลายอย่างช้าๆ อันเป็นผลมาจากการเปิดช่องไอออนเป็นเวลานานและการสลับขั้วของเมมเบรนอย่างต่อเนื่อง การนำกระแสประสาทจะหยุดชะงักและเกิดการคลายตัวของกล้ามเนื้อ ในขั้นต้นพบคุณสมบัติเหล่านี้ในพิษของ curare ดังนั้นจึงเรียกว่ายาดังกล่าว คูราริฟอร์ม
หัวข้อ 1.3. การสลายตัวของโปรตีนและความเป็นไปได้ของการฟื้นฟูที่เกิดขึ้นเอง
1. เนื่องจากรูปแบบดั้งเดิมของโปรตีนยังคงอยู่เนื่องจากการโต้ตอบที่อ่อนแอ การเปลี่ยนแปลงองค์ประกอบและคุณสมบัติของสภาพแวดล้อมรอบ ๆ โปรตีน ผลกระทบ สารเคมีและปัจจัยทางกายภาพทำให้เกิดการเปลี่ยนแปลงในโครงสร้างของพวกเขา (คุณสมบัติของความสามารถในการกำหนดรูปแบบ) การแตกของพันธะจำนวนมากนำไปสู่การทำลายโครงสร้างดั้งเดิมและการเสื่อมสภาพของโปรตีน
การเสื่อมสภาพของโปรตีน- นี่คือการทำลายโครงสร้างดั้งเดิมของพวกมันภายใต้การกระทำของสารทำให้เสียสภาพซึ่งเกิดจากการแตกของพันธะที่อ่อนแอซึ่งทำให้โครงสร้างเชิงพื้นที่ของโปรตีนเสถียร การเปลี่ยนสภาพจะมาพร้อมกับการทำลายโครงสร้างสามมิติที่เป็นเอกลักษณ์และศูนย์กลางการทำงานของโปรตีนและการสูญเสียกิจกรรมทางชีวภาพ (รูปที่ 1.16)
โมเลกุลที่แปลงสภาพทั้งหมดของโปรตีนหนึ่งตัวจะได้รับโครงสร้างแบบสุ่มที่แตกต่างจากโมเลกุลอื่นของโปรตีนเดียวกัน อนุมูลของกรดอะมิโนที่ก่อตัวเป็นศูนย์แอคทีฟกลับกลายเป็นว่าห่างไกลจากกันเชิงพื้นที่ กล่าวคือ บริเวณจับเฉพาะของโปรตีนที่มีแกนด์ถูกทำลาย ในระหว่างการแปลงสภาพ โครงสร้างหลักของโปรตีนยังคงไม่เปลี่ยนแปลง
การใช้สารทำให้เสียสภาพในการวิจัยทางชีววิทยาและการแพทย์ในการศึกษาทางชีวเคมี ก่อนการหาสารประกอบที่มีน้ำหนักโมเลกุลต่ำในวัสดุชีวภาพ โปรตีนมักจะถูกกำจัดออกจากสารละลายก่อน ด้วยเหตุนี้จึงมักใช้กรดไตรคลอโรอะซิติก (TCA) หลังจากเติม TCA ลงในสารละลาย โปรตีนที่แปลงสภาพจะตกตะกอนและกรองออกได้ง่าย (ตารางที่ 1.1)
ในทางการแพทย์ สารทำให้เสียสภาพมักใช้ในการฆ่าเชื้อเครื่องมือทางการแพทย์และวัสดุในหม้อนึ่งความดัน (สารทำให้เสียสภาพ - อุณหภูมิสูง) และใช้เป็นน้ำยาฆ่าเชื้อ (แอลกอฮอล์ ฟีนอล คลอรามีน) เพื่อรักษาพื้นผิวที่ปนเปื้อนที่มีจุลินทรีย์ที่ทำให้เกิดโรค
2. การสร้างโปรตีนขึ้นใหม่โดยธรรมชาติ- การพิสูจน์การกำหนดโครงสร้างหลัก โครงสร้าง และหน้าที่ของโปรตีน โปรตีนแต่ละชนิดเป็นผลิตภัณฑ์ของยีนหนึ่งตัวที่มีลำดับกรดอะมิโนเหมือนกันและได้รับโครงสร้างที่เหมือนกันในเซลล์ ข้อสรุปพื้นฐานที่ว่าโครงสร้างหลักของโปรตีนมีข้อมูลเกี่ยวกับโครงสร้างและหน้าที่ของมันอยู่แล้วบนพื้นฐานของความสามารถของโปรตีนบางชนิด (โดยเฉพาะ ribonuclease และ myoglobin) ในการฟื้นสภาพที่เกิดขึ้นเองตามธรรมชาติ - การฟื้นฟูโครงสร้างดั้งเดิมของพวกมันหลังจากการเสียสภาพ
การก่อตัวของโครงสร้างเชิงพื้นที่ของโปรตีนนั้นดำเนินการโดยวิธีการประกอบตัวเอง - กระบวนการที่เกิดขึ้นเองซึ่งสายโซ่โพลีเปปไทด์ซึ่งมีโครงสร้างหลักที่เป็นเอกลักษณ์มีแนวโน้มที่จะแก้ปัญหาด้วยโครงสร้างที่เล็กที่สุด พลังงานฟรี. ความสามารถในการสร้างโปรตีนใหม่ที่คงโครงสร้างหลักของพวกมันไว้หลังจากการเสียสภาพได้อธิบายไว้ในการทดลองกับเอนไซม์ไรโบนิวคลีเอส
ไรโบนิวคลีเอสเป็นเอนไซม์ที่ทำลายพันธะระหว่างนิวคลีโอไทด์แต่ละตัวในโมเลกุลอาร์เอ็นเอ โปรตีนทรงกลมนี้มีสายโพลีเปปไทด์หนึ่งสาย โครงสร้างระดับอุดมศึกษาซึ่งมีความเสถียรด้วยพันธะไดซัลไฟด์ที่อ่อนแอจำนวนมากและสี่พันธะ
การบำบัดไรโบนิวคลีเอสด้วยยูเรียซึ่งทำลายพันธะไฮโดรเจนในโมเลกุล และตัวรีดิวซ์ซึ่งทำลายพันธะไดซัลไฟด์ นำไปสู่การเสื่อมสภาพของเอนไซม์และการสูญเสียกิจกรรม
การกำจัดสารเปลี่ยนสภาพโดยการฟอกไตจะนำไปสู่การฟื้นฟูโครงสร้างและหน้าที่ของโปรตีน กล่าวคือ เพื่อฟื้นคืนชีพ (รูปที่ 1.17).
 ข้าว. 1.17. การเปลี่ยนสภาพและการสร้างใหม่ของไรโบนิวคลีเอส
ข้าว. 1.17. การเปลี่ยนสภาพและการสร้างใหม่ของไรโบนิวคลีเอส
เอ - โครงสร้างดั้งเดิมของไรโบนิวคลีเอสในโครงสร้างตติยภูมิซึ่งมีพันธะซัลไฟด์สี่พันธะ B - โมเลกุลไรโบนิวคลีเอสที่ทำให้เสียสภาพ
B - โมเลกุลไรโบนิวคลีเอสรีเนทีฟพร้อมโครงสร้างและหน้าที่ฟื้นฟู
1. กรอกตาราง 1.2
ตารางที่ 1.2. การจำแนกกรดอะมิโนตามขั้วของอนุมูล
2. เขียนสูตรของเตตราเปปไทด์:
Asp - Pro - เฟิน - Liz
ก) แยกกลุ่มที่เกิดซ้ำในเปปไทด์ที่ก่อรูปกระดูกสันหลังของเปปไทด์และกลุ่มตัวแปรที่แสดงโดยอนุมูลของกรดอะมิโน
b) กำหนด N- และ C-termi;
c) ขีดเส้นใต้พันธะเปปไทด์;
d) เขียนเปปไทด์อื่นที่ประกอบด้วยกรดอะมิโนเดียวกัน
จ) นับจำนวน ตัวเลือก tetrapeptide ที่มีองค์ประกอบของกรดอะมิโนเหมือนกัน
3. อธิบายบทบาทของโครงสร้างหลักของโปรตีนโดยใช้ตัวอย่างการวิเคราะห์เปรียบเทียบฮอร์โมนเปปไทด์ที่มีโครงสร้างคล้ายคลึงกันและวิวัฒนาการอย่างใกล้ชิดสองชนิดของ neurohypophysis ของสัตว์เลี้ยงลูกด้วยนม - ออกซีโตซินและวาโซเพรสซิน (ตารางที่ 1.3)
ตาราง 1.3. โครงสร้างและหน้าที่ของออกซิโทซินและวาโซเพรสซิน
 สำหรับสิ่งนี้:
สำหรับสิ่งนี้:
ก) เปรียบเทียบองค์ประกอบและลำดับกรดอะมิโนของเปปไทด์สองตัว
b) ค้นหาความคล้ายคลึงกันของโครงสร้างหลักของเปปไทด์ทั้งสองและความคล้ายคลึงกันของการกระทำทางชีวภาพของพวกมัน
c) ค้นหาความแตกต่างในโครงสร้างของเปปไทด์ทั้งสองและความแตกต่างในหน้าที่ของพวกมัน
d) ทำการสรุปเกี่ยวกับอิทธิพลของโครงสร้างหลักของเปปไทด์ที่มีต่อหน้าที่ของเปปไทด์
4. อธิบายขั้นตอนหลักในการก่อตัวของโครงสร้างของโปรตีนทรงกลม (โครงสร้างทุติยภูมิ, โครงสร้างตติยภูมิ, แนวคิดของโครงสร้าง supersecondary) ระบุประเภทของพันธะที่เกี่ยวข้องกับการก่อตัวของโครงสร้างโปรตีน อนุมูลของกรดอะมิโนชนิดใดสามารถมีส่วนร่วมในการก่อตัวของปฏิกิริยาที่ไม่ชอบน้ำ พันธะไอออนิก ไฮโดรเจน
ยกตัวอย่าง.
5. กำหนดแนวคิดของ "ความสามารถในการกำหนดรูปแบบโปรตีน" ระบุสาเหตุของการมีอยู่และความสำคัญของมัน
6. อธิบายความหมายของวลีต่อไปนี้: "การทำงานของโปรตีนตามปฏิสัมพันธ์เฉพาะของพวกมันกับลิแกนด์" โดยใช้คำศัพท์และอธิบายความหมายของพวกมัน: โครงสร้างของโปรตีน, แอคทีฟไซต์, ลิแกนด์, คอมพลีเมนต์, ฟังก์ชันโปรตีน
7. ใช้ตัวอย่างใดตัวอย่างหนึ่งเพื่ออธิบายว่าโดเมนคืออะไรและมีบทบาทอย่างไรต่อการทำงานของโปรตีน
งานเพื่อการควบคุมตนเอง
1. ตั้งค่าการแข่งขัน
กลุ่มหน้าที่ในอนุมูลของกรดอะมิโน:
A. กลุ่มคาร์บอกซิล B. กลุ่มไฮดรอกซิล C กลุ่ม Guanidine D. กลุ่มธีออล E. กลุ่มอะมิโน
2. เลือกคำตอบที่ถูกต้อง.
กรดอะมิโนที่มีขั้วไม่มีประจุคือ:
A. Tsis B. Asn
บี กลู จี สาม
3. เลือกคำตอบที่ถูกต้อง.
อนุมูลของกรดอะมิโน:
ก. จัดให้มีความจำเพาะของโครงสร้างหลัก ข. มีส่วนร่วมในการก่อตัวของโครงสร้างตติยภูมิ
B. ตั้งอยู่บนพื้นผิวของโปรตีน พวกมันส่งผลต่อความสามารถในการละลายของโปรตีน D. สร้างศูนย์กลางที่แอคทีฟ
D. มีส่วนร่วมในการก่อตัวของพันธะเปปไทด์
4. เลือกคำตอบที่ถูกต้อง.
ปฏิกิริยาที่ชอบน้ำสามารถเกิดขึ้นได้ระหว่างอนุมูลของกรดอะมิโน:
A. Tre Lay B. Pro สาม
B. Met Ile G. Tir Ala D. Val Fen
5. เลือกคำตอบที่ถูกต้อง.
พันธะไอออนิกสามารถเกิดขึ้นได้ระหว่างอนุมูลของกรดอะมิโน:
A. Gln Asp B. เมษายน Liz
B. Liz Glu G. Geese Asp D. Asn Apr
6. เลือกคำตอบที่ถูกต้อง.
พันธะไฮโดรเจนสามารถเกิดขึ้นได้ระหว่างอนุมูลของกรดอะมิโน:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. ตั้งค่าการแข่งขัน
ประเภทของพันธะที่เกี่ยวข้องกับการก่อตัวของโครงสร้างโปรตีน:
ก. โครงสร้างปฐมภูมิ ข. โครงสร้างรอง
ข. โครงสร้างระดับตติยภูมิ
ง. โครงสร้าง supersecondary E. โครงสร้าง.
1. พันธะไฮโดรเจนระหว่างอะตอมของกระดูกสันหลังของเปปไทด์
2. พันธะที่อ่อนแอระหว่างกลุ่มหน้าที่ของอนุมูลของกรดอะมิโน
3. พันธะระหว่างกรดอะมิโนกลุ่ม α-amino และ α-carboxyl
8. เลือกคำตอบที่ถูกต้อง. ทริปซิน:
ก. เอ็นไซม์โปรตีโอไลติก ข. ประกอบด้วยสองโดเมน
B. แป้งไฮโดรไลซ์
ง. ศูนย์ปฏิบัติการตั้งอยู่ระหว่างโดเมน ง. ประกอบด้วยสายโซ่โพลีเปปไทด์สองสาย
9. เลือกคำตอบที่ถูกต้อง. อะโทรพีน:
ก. สารสื่อประสาท
B. โครงสร้างอะนาล็อกของอะเซทิลโคลีน
B. โต้ตอบกับตัวรับ H-cholinergic
G. ช่วยเพิ่มการนำกระแสประสาทผ่าน cholinergic synapses
D. ตัวยับยั้งการแข่งขันของตัวรับ M-cholinergic
10. เลือกข้อความที่ถูกต้อง ในโปรตีน:
A. โครงสร้างหลักประกอบด้วยข้อมูลเกี่ยวกับโครงสร้างของไซต์ที่ใช้งานอยู่
B. ศูนย์แอคทีฟถูกสร้างขึ้นที่ระดับของโครงสร้างหลัก
B. โครงสร้างได้รับการแก้ไขอย่างเข้มงวดโดยพันธะโควาเลนต์
D. ไซต์ที่ใช้งานสามารถโต้ตอบกับกลุ่มของลิแกนด์ที่คล้ายคลึงกัน
เนื่องจากความสามารถในการกำหนดโครงสร้างของโปรตีน D. Change สิ่งแวดล้อม, สามารถส่งผลต่อความสัมพันธ์ของแอคทีฟ
ศูนย์ลิแกนด์
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
ข้อกำหนดและแนวคิดพื้นฐาน
1. โปรตีน โพลีเปปไทด์ กรดอะมิโน
2. โครงสร้างโปรตีนระดับประถมศึกษา มัธยมศึกษา ระดับอุดมศึกษา
3. โครงสร้าง โครงสร้างโปรตีนพื้นเมือง
4. พันธะโควาเลนต์และอ่อนแอในโปรตีน
5. ความสามารถในการจัดรูปแบบ
6. ไซต์ที่ใช้งานโปรตีน
7. แกนด์
8. การพับโปรตีน
9. โครงสร้างแอนะล็อกของลิแกนด์
10. โดเมนโปรตีน
11. โปรตีนที่ง่ายและซับซ้อน
12. การเปลี่ยนสภาพโปรตีน, สารทำให้เสียสภาพ
13. การสร้างโปรตีนใหม่
แก้ปัญหา
"การจัดโครงสร้างโปรตีนและพื้นฐานของการทำงาน"
1. หน้าที่หลักของโปรตีน - เฮโมโกลบิน A (HbA) - คือการขนส่งออกซิเจนไปยังเนื้อเยื่อ ในประชากรมนุษย์ โปรตีนหลายรูปแบบนี้มีคุณสมบัติและหน้าที่เปลี่ยนแปลงไป ซึ่งเรียกว่าฮีโมโกลบินผิดปกติ ตัวอย่างเช่น ฮีโมโกลบิน S ที่พบในเม็ดเลือดแดงของผู้ป่วยที่มีโรคเม็ดเลือดรูปเคียว (HbS) พบว่ามีความสามารถในการละลายต่ำภายใต้สภาวะของความดันบางส่วนของออกซิเจนต่ำ (เช่นเดียวกับที่เกิดขึ้นในเลือดดำ) สิ่งนี้นำไปสู่การก่อตัวของมวลรวมของโปรตีนนี้ โปรตีนสูญเสียการทำงาน ตกตะกอน และเม็ดเลือดแดงได้รับ รูปร่างผิดปกติ(บางชนิดเป็นรูปเคียว) และถูกทำลายเร็วกว่าปกติในม้าม เป็นผลให้เกิดโรคโลหิตจางเซลล์เคียว
ความแตกต่างเพียงอย่างเดียวในโครงสร้างหลักของ HvA พบได้ในบริเวณปลาย N ของสาย β ของเฮโมโกลบิน เปรียบเทียบบริเวณปลาย N ของสาย β และแสดงให้เห็นว่าการเปลี่ยนแปลงในโครงสร้างหลักของโปรตีนส่งผลต่อคุณสมบัติและหน้าที่ของโปรตีนอย่างไร
 สำหรับสิ่งนี้:
สำหรับสิ่งนี้:
ก) เขียนสูตรกรดอะมิโนโดยที่ HvA ต่างกันและเปรียบเทียบคุณสมบัติของกรดอะมิโนเหล่านี้ (ขั้ว ประจุ)
b) หาข้อสรุปเกี่ยวกับสาเหตุของการลดลงของความสามารถในการละลายและการละเมิดการขนส่งออกซิเจนในเนื้อเยื่อ
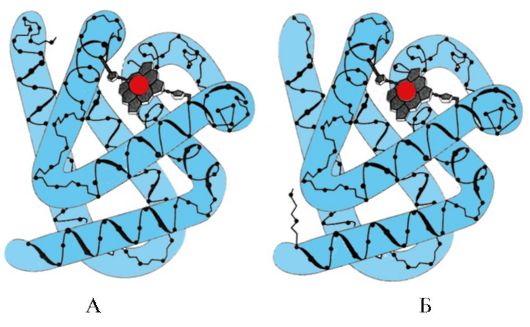
2. รูปแสดงแผนผังโครงสร้างของโปรตีนที่มีแกนด์ที่ยึดกับแกนกลาง (ศูนย์แอคทีฟ) อธิบายว่าเหตุใดโปรตีนจึงถูกคัดเลือกในการเลือกลิแกนด์ สำหรับสิ่งนี้:
ก) จำว่าจุดศูนย์กลางแอคทีฟของโปรตีนคืออะไร และพิจารณาโครงสร้างของศูนย์กลางแอคทีฟของโปรตีนที่แสดงในรูป
b) เขียนสูตรของอนุมูลของกรดอะมิโนที่ประกอบขึ้นเป็นศูนย์ที่ใช้งานอยู่
c) วาดลิแกนด์ที่สามารถโต้ตอบอย่างเฉพาะเจาะจงกับไซต์ที่ทำงานของโปรตีน ระบุกลุ่มการทำงานที่สามารถสร้างพันธะกับอนุมูลของกรดอะมิโนที่ประกอบขึ้นเป็นศูนย์ที่ใช้งานอยู่
d) ระบุประเภทของพันธะที่เกิดขึ้นระหว่างลิแกนด์และอนุมูลของกรดอะมิโนของศูนย์แอคทีฟ
จ) อธิบายพื้นฐานสำหรับความจำเพาะของปฏิสัมพันธ์ของโปรตีนกับลิแกนด์
 3.
รูปแสดงตำแหน่งแอกทีฟไซต์ของโปรตีนและลิแกนด์หลายตัว
3.
รูปแสดงตำแหน่งแอกทีฟไซต์ของโปรตีนและลิแกนด์หลายตัว
พิจารณาว่าแกนด์ใดมีแนวโน้มที่จะโต้ตอบกับไซต์ที่ทำงานอยู่ของโปรตีนและทำไม
 พันธะประเภทใดที่เกิดขึ้นระหว่างการก่อตัวของโปรตีนลิแกนด์คอมเพล็กซ์?
พันธะประเภทใดที่เกิดขึ้นระหว่างการก่อตัวของโปรตีนลิแกนด์คอมเพล็กซ์?
4. โครงสร้างแอนะล็อกของลิแกนด์โปรตีนธรรมชาติสามารถใช้เป็นยาในการเปลี่ยนแปลงกิจกรรมของโปรตีน
Acetylcholine เป็นตัวกลางในการส่งสัญญาณกระตุ้นในประสาทและกล้ามเนื้อประสาท เมื่อ acetylcholine ทำปฏิกิริยากับโปรตีน - ตัวรับของเยื่อหุ้มเซลล์ postsynaptic ของกล้ามเนื้อโครงร่าง ช่องไอออนจะเปิดขึ้นและเกิดการหดตัวของกล้ามเนื้อ Dithylin เป็นยาที่ใช้ในการผ่าตัดบางอย่างเพื่อผ่อนคลายกล้ามเนื้อ เนื่องจากจะไปขัดขวางการส่งสัญญาณของเส้นประสาทผ่านทางประสาทและกล้ามเนื้อ อธิบายกลไกการออกฤทธิ์ของไดไทลินเป็นยาคลายกล้ามเนื้อ สำหรับสิ่งนี้:
ก) เขียนสูตรของ acetylcholine และ dithyline และเปรียบเทียบโครงสร้างของพวกมัน
b) อธิบายกลไกของการกระทำที่ผ่อนคลายของ dithylin
5. ในบางโรค อุณหภูมิร่างกายของผู้ป่วยสูงขึ้น ซึ่งถือเป็นปฏิกิริยาป้องกันของร่างกาย อย่างไรก็ตาม อุณหภูมิสูงเป็นอันตรายต่อโปรตีนในร่างกาย อธิบายว่าเหตุใดที่อุณหภูมิสูงกว่า 40 °C การทำงานของโปรตีนจึงหยุดชะงักและเป็นอันตรายต่อชีวิตมนุษย์ เมื่อต้องการทำเช่นนี้ จำไว้ว่า:
1) โครงสร้างของโปรตีนและพันธะที่มีโครงสร้างอยู่ในรูปแบบดั้งเดิม
2) โครงสร้างและหน้าที่ของโปรตีนเปลี่ยนแปลงไปตามอุณหภูมิที่เพิ่มขึ้นอย่างไร;
3) สภาวะสมดุลคืออะไรและเหตุใดการรักษาสุขภาพของมนุษย์จึงมีความสำคัญ
ยูนิตโมดูลาร์ 2 OLIGOMERIC PROTEINS เป็นเป้าหมายสำหรับอิทธิพลด้านกฎระเบียบ โปรตีนหลากหลายโครงสร้างและหน้าที่การใช้งาน การแยกโปรตีนและวิธีการทำให้บริสุทธิ์
วัตถุประสงค์การเรียนรู้ เพื่อให้สามารถ:
1. ใช้ความรู้เกี่ยวกับคุณลักษณะของโครงสร้างและหน้าที่ของโปรตีน oligomeric เพื่อทำความเข้าใจกลไกการปรับตัวของการควบคุมการทำงานของพวกมัน
2. อธิบายบทบาทของพี่เลี้ยงในการสังเคราะห์และบำรุงรักษาโครงสร้างโปรตีนในเซลล์
3. เพื่ออธิบายความหลากหลายของการสำแดงชีวิตด้วยความหลากหลายของโครงสร้างและหน้าที่ของโปรตีนที่สังเคราะห์ขึ้นในร่างกาย
4. วิเคราะห์ความสัมพันธ์ระหว่างโครงสร้างของโปรตีนและหน้าที่ของโปรตีนโดยเปรียบเทียบเฮโมโกลบินที่เกี่ยวข้อง - ไมโอโกลบินและเฮโมโกลบิน ตลอดจนตัวแทนของโปรตีนห้าชั้นของตระกูลอิมมูโนโกลบูลิน
5. ใช้ความรู้เกี่ยวกับคุณสมบัติทางเคมีกายภาพของโปรตีนเพื่อเลือกวิธีการทำให้บริสุทธิ์จากโปรตีนและสิ่งเจือปนอื่นๆ
6. ตีความผลลัพธ์ขององค์ประกอบเชิงปริมาณและคุณภาพของโปรตีนในเลือดเพื่อยืนยันหรือชี้แจงการวินิจฉัยทางคลินิก
รู้:
1. คุณสมบัติของโครงสร้างของโปรตีน oligomeric และกลไกการปรับตัวของการควบคุมการทำงานของพวกมันในตัวอย่างของเฮโมโกลบิน
2. โครงสร้างและหน้าที่ของพี่เลี้ยงและความสำคัญในการรักษาโครงสร้างโปรตีนในเซลล์
3. หลักการจัดกลุ่มโปรตีนออกเป็นครอบครัวตามความคล้ายคลึงกันของโครงสร้างและหน้าที่ในตัวอย่างของอิมมูโนโกลบูลิน
4. วิธีการแยกโปรตีนตามคุณสมบัติของคุณสมบัติทางเคมีกายภาพ
5. อิเล็กโตรโฟรีซิสของพลาสมาเลือดเป็นวิธีการประเมินองค์ประกอบเชิงคุณภาพและเชิงปริมาณของโปรตีน
หัวข้อ 1.4. คุณสมบัติของโครงสร้างและการทำงานของโปรตีนโอลิโกเมอร์ในตัวอย่างของเฮโมโกลบิน
1. โปรตีนหลายชนิดประกอบด้วยสายโซ่โพลีเปปไทด์หลายสาย โปรตีนดังกล่าวเรียกว่า oligomeric,และแต่ละวงจร โปรโตเมอร์โปรโตเมอร์ในโปรตีนโอลิโกเมอร์เชื่อมต่อกันด้วยพันธะที่ไม่ใช่โควาเลนต์ที่อ่อนแอจำนวนมาก (ไม่ชอบน้ำ อิออน ไฮโดรเจน) ปฏิสัมพันธ์
protomers จะดำเนินการด้วย การเติมเต็มพื้นผิวสัมผัสของพวกเขา
จำนวนโปรโตเมอร์ในโปรตีนโอลิโกเมอร์อาจแตกต่างกันมาก: เฮโมโกลบินประกอบด้วย 4 โปรโตเมอร์ เอนไซม์แอสพาเทตอะมิโนทรานสเฟอเรส - 12 โปรโตเมอร์ และโปรตีนของไวรัสโมเสคยาสูบประกอบด้วยโปรโตเมอร์ 2120 ตัวที่เชื่อมต่อกันด้วยพันธะที่ไม่ใช่โควาเลนต์ ดังนั้นโปรตีนโอลิโกเมอร์จึงสามารถมีน้ำหนักโมเลกุลสูงมาก
ปฏิสัมพันธ์ของโปรโตเมอร์หนึ่งกับคนอื่นถือได้ว่าเป็นกรณีพิเศษของปฏิสัมพันธ์ของโปรตีนกับลิแกนด์เนื่องจากโปรโตเมอร์แต่ละตัวทำหน้าที่เป็นลิแกนด์สำหรับโปรโตเมอร์อื่น จำนวนและวิธีการเชื่อมต่อโปรโตเมอร์ในโปรตีนเรียกว่า โครงสร้างโปรตีนสี่ส่วน
โปรตีนสามารถมีโปรโตเมอร์ที่มีโครงสร้างเหมือนกันหรือต่างกัน ตัวอย่างเช่น โฮโมไดเมอร์คือโปรตีนที่มีโปรโตเมอร์ที่เหมือนกันสองตัว และเฮเทอโรไดเมอร์คือโปรตีนที่มีโปรโตเมอร์ที่ต่างกันสองตัว
หากโปรตีนมีโปรโตเมอร์ต่างกัน ศูนย์การจับกับลิแกนด์ที่แตกต่างกันซึ่งมีโครงสร้างต่างกันก็สามารถก่อตัวขึ้นได้ เมื่อลิแกนด์จับกับศูนย์กลางที่ทำงานอยู่ หน้าที่ของโปรตีนนี้จะปรากฏออกมา ศูนย์ที่อยู่บนโปรโตเมอร์อื่นเรียกว่าอัลโลสเตอริก (นอกเหนือจากแอคทีฟ) การติดต่อ ลิแกนด์อัลโลสเตอริกหรือเอฟเฟกเตอร์มันทำหน้าที่กำกับดูแล (รูปที่ 1.18) การทำงานร่วมกันของศูนย์ allosteric กับเอฟเฟกต์ทำให้เกิดการเปลี่ยนแปลงเชิงโครงสร้างในโครงสร้างของโปรตีน oligomeric ทั้งหมดเนื่องจากความสามารถในการกำหนดรูปแบบ สิ่งนี้ส่งผลต่อสัมพรรคภาพของไซต์แอคทีฟสำหรับลิแกนด์จำเพาะและควบคุมการทำงานของโปรตีนนั้น การเปลี่ยนแปลงในโครงสร้างและหน้าที่ของโปรโตเมอร์ทั้งหมดระหว่างอันตรกิริยาของโปรตีนโอลิโกเมอร์กับลิแกนด์อย่างน้อยหนึ่งตัวเรียกว่าการเปลี่ยนแปลงโครงสร้างแบบร่วมมือ เอฟเฟคเตอร์ที่เสริมการทำงานของโปรตีนเรียกว่า ตัวกระตุ้นและเอฟเฟกต์ที่กดดันการทำงานของมัน - สารยับยั้ง
ดังนั้นในโปรตีน oligomeric เช่นเดียวกับโปรตีนที่มีโครงสร้างโดเมน คุณสมบัติใหม่จะปรากฏขึ้นเมื่อเปรียบเทียบกับโปรตีนโมโนเมอร์ - ความสามารถในการควบคุมการทำงานแบบ allosterically (การควบคุมโดยแนบลิแกนด์ที่แตกต่างกันกับโปรตีน) สิ่งนี้สามารถเห็นได้โดยการเปรียบเทียบโครงสร้างและหน้าที่ของโปรตีนที่ซับซ้อนสองชนิดที่เกี่ยวข้องกันอย่างใกล้ชิดคือไมโอโกลบินและเฮโมโกลบิน
 ข้าว. 1.18. แผนภาพโครงสร้างของโปรตีนไดเมอริก
ข้าว. 1.18. แผนภาพโครงสร้างของโปรตีนไดเมอริก
2. การก่อตัวของโครงสร้างเชิงพื้นที่และการทำงานของ myoglobin
Myoglobin (Mb) เป็นโปรตีนที่พบในกล้ามเนื้อสีแดง หน้าที่หลักคือการสร้าง O 2 สำรองที่จำเป็นสำหรับการทำงานของกล้ามเนื้อที่รุนแรง MB เป็นโปรตีนเชิงซ้อนที่มีส่วนโปรตีน - apoMB และส่วนที่ไม่ใช่โปรตีน - heme โครงสร้างหลักของ apoMB กำหนดโครงสร้างทรงกลมขนาดกะทัดรัดและโครงสร้างของศูนย์แอ็คทีฟซึ่งแนบส่วนที่ไม่ใช่โปรตีนของ myoglobin, heme ออกซิเจนจากเลือดไปยังกล้ามเนื้อจับกับ Fe + 2 heme ในองค์ประกอบของ myoglobin MB เป็นโปรตีนโมโนเมอร์ที่มีความสัมพันธ์กับ O 2 สูงมาก ดังนั้น myoglobin จะปล่อยออกซิเจนเฉพาะในระหว่างการทำงานของกล้ามเนื้อที่รุนแรงเท่านั้น เมื่อความดันบางส่วนของ O 2 ลดลงอย่างรวดเร็ว
การก่อตัวของรูปแบบ MB.ในกล้ามเนื้อสีแดง บนไรโบโซมระหว่างการแปล การสังเคราะห์โครงสร้างหลักของ MB ซึ่งแสดงโดยลำดับเฉพาะของ 153 กรดอะมิโนตกค้างเกิดขึ้น โครงสร้างทุติยภูมิของ Mv ประกอบด้วย α-helices แปดตัว เรียกว่าตัวอักษรละตินจาก A ถึง H ซึ่งจะมีส่วนที่ไม่เป็นเกลียว โครงสร้างระดับตติยภูมิของ Mv มีรูปทรงกลมขนาดกะทัดรัด ซึ่งอยู่ระหว่าง F และ E α-helices มีจุดศูนย์กลางที่แอคทีฟ (รูปที่ 1.19)
 ข้าว. 1.19. โครงสร้างของไมโอโกลบิน
ข้าว. 1.19. โครงสร้างของไมโอโกลบิน
3. คุณสมบัติของโครงสร้างและการทำงานของศูนย์แอคทีฟ MVศูนย์กลางแอคทีฟของ Mv ส่วนใหญ่เกิดจากอนุมูลของกรดอะมิโนที่ไม่ชอบน้ำซึ่งอยู่ห่างไกลจากกันในโครงสร้างปฐมภูมิ (เช่น Tri 3 9 และเพ็ญ 138) ลิแกนด์ที่ละลายได้ไม่ดีในน้ำ heme และ O 2 ติดอยู่ที่ศูนย์แอคทีฟ Heme เป็นลิแกนด์ apoMv เฉพาะ (รูปที่ 1.20) ซึ่งอิงจากวงแหวนไพร์โรลสี่วงที่เชื่อมต่อด้วยสะพานเมธินิล ตรงกลางมีอะตอม Fe+ 2 เชื่อมต่อกับอะตอมไนโตรเจนของวงแหวนไพร์โรลด้วยพันธะประสาน 4 พันธะ นอกจากอนุมูลที่ไม่ชอบน้ำของกรดอะมิโนแล้ว ศูนย์กลางของ Mv ยังประกอบด้วยสารตกค้างของกรดอะมิโนสองชนิดที่มีอนุมูลที่ชอบน้ำ - Gis E7(GIS 64) และ Gis F 8(พระองค์ 93) (รูปที่ 1.21).
 ข้าว. 1.20. โครงสร้างของ heme - ส่วนที่ไม่ใช่โปรตีนของ myoglobin และ hemoglobin
ข้าว. 1.20. โครงสร้างของ heme - ส่วนที่ไม่ใช่โปรตีนของ myoglobin และ hemoglobin
 ข้าว. 1.21. ตำแหน่งของ heme และ O 2 ในบริเวณแอกทีฟไซต์ของ apomyoglobin และ hemoglobin protomers
ข้าว. 1.21. ตำแหน่งของ heme และ O 2 ในบริเวณแอกทีฟไซต์ของ apomyoglobin และ hemoglobin protomers
Heme ถูกพันธะโควาเลนต์กับ F 8 ของเขาผ่านอะตอมของเหล็ก O 2 ยึดติดกับเหล็กที่อีกด้านหนึ่งของระนาบ heme E 7 ของเขาจำเป็นสำหรับการวางแนวที่ถูกต้องของ O 2 และอำนวยความสะดวกในการเพิ่มออกซิเจนให้กับ Fe + 2 heme
Gis F 8สร้างพันธะประสานงานกับ Fe+ 2 และแก้ไข heme อย่างแน่นหนาในบริเวณที่ทำงานอยู่ Gis E7จำเป็นสำหรับการวางแนวที่ถูกต้องในศูนย์กลางของแกนด์อื่น - O 2 ในระหว่างการโต้ตอบกับ Fe + 2 heme สภาวะแวดล้อมจุลภาคของ heme สร้างสภาวะสำหรับการยึดเกาะที่แข็งแรงแต่สามารถย้อนกลับของ O 2 กับ Fe + 2 และป้องกันไม่ให้น้ำเข้าสู่ศูนย์แอคทีฟที่ไม่ชอบน้ำ ซึ่งสามารถนำไปสู่การออกซิเดชันของ Fe + 3 ได้
โครงสร้างโมโนเมอร์ของ MB และศูนย์กลางที่แอคทีฟกำหนดความสัมพันธ์สูงของโปรตีนสำหรับ O 2
4. โครงสร้าง Oligomeric ของ Hb และการควบคุมความสัมพันธ์ของ Hb สำหรับ O 2 โดยลิแกนด์ ฮีโมโกลบินของมนุษย์- ตระกูลของโปรตีน เช่นเดียวกับ myoglobin ที่เกี่ยวข้องกับโปรตีนเชิงซ้อน (hemoproteins) พวกมันมีโครงสร้างเตตระเมอร์และประกอบด้วยสาย α สองสาย แต่โครงสร้างของสายโพลีเปปไทด์อีกสองสายต่างกัน (2α-, 2x-chains) โครงสร้างของสายพอลิเปปไทด์ที่สองกำหนดคุณลักษณะของการทำงานของรูปแบบเหล่านี้ของ Hb ประมาณ 98% ของฮีโมโกลบินในเม็ดเลือดแดงของผู้ใหญ่คือ เฮโมโกลบิน A(2α-, 2p-เชน)
ในระหว่างการพัฒนาของทารกในครรภ์มีฮีโมโกลบินสองประเภทหลัก: HB .ตัวอ่อน(2α, 2ε) ซึ่งพบได้ในระยะแรกของการพัฒนาของทารกในครรภ์และ เฮโมโกลบิน F (ทารกในครรภ์)- (2α, 2γ) ซึ่งแทนที่ฮีโมโกลบินของทารกในครรภ์ในระยะแรกในเดือนที่หกของการพัฒนาของทารกในครรภ์และจะถูกแทนที่ด้วย Hb A หลังคลอดเท่านั้น
Hv A เป็นโปรตีนที่เกี่ยวข้องกับ myoglobin (Mv) ที่พบในเม็ดเลือดแดงของผู้ใหญ่ โครงสร้างของโปรโตเมอร์แต่ละตัวนั้นคล้ายกับของไมโอโกลบิน โครงสร้างทุติยภูมิและตติยภูมิของ myoglobin และ hemoglobin protomers มีความคล้ายคลึงกันมาก แม้ว่าจะมีกรดอะมิโนเหลืออยู่เพียง 24 ชนิดเท่านั้นที่เหมือนกันในโครงสร้างหลักของสายโพลีเปปไทด์ (โครงสร้างรองของโปรโตเมอร์เฮโมโกลบิน เช่น myoglobin มี α-helices อยู่แปดตัว แสดงด้วยตัวอักษรละตินจาก A ถึง H และโครงสร้างตติยภูมิมีรูปทรงกลมขนาดกะทัดรัด) แต่แตกต่างจากไมโอโกลบินตรงที่ เฮโมโกลบินมีโครงสร้างโอลิโกเมอร์ ประกอบด้วยสายโซ่โพลีเปปไทด์สี่สายที่เชื่อมต่อกันด้วยพันธะที่ไม่ใช่โควาเลนต์ (รูปที่ 1.22)
โปรโตเมอร์ Hb แต่ละตัวมีความเกี่ยวข้องกับส่วนที่ไม่ใช่โปรตีน - ฮีมและโปรโตเมอร์ที่อยู่ใกล้เคียง การเชื่อมต่อของส่วนโปรตีนของ Hb กับ heme นั้นคล้ายกับของ myoglobin: ในศูนย์กลางของโปรตีนส่วนที่ไม่ชอบน้ำของ heme นั้นล้อมรอบด้วยอนุมูลของกรดอะมิโนที่ไม่ชอบน้ำ ยกเว้น His F 8 และ His E 7 ซึ่งตั้งอยู่ทั้งสองด้านของระนาบ heme และมีบทบาทคล้ายกันในการทำงานของโปรตีนและการจับกับออกซิเจน (ดูโครงสร้างของ myoglobin)
 ข้าว. 1.22. โครงสร้าง Oligomeric ของเฮโมโกลบิน
ข้าว. 1.22. โครงสร้าง Oligomeric ของเฮโมโกลบิน
นอกจากนี้, Gis E7ทำหน้าที่สำคัญ บทบาทเพิ่มเติมในการทำงานของเอ็นวี ฟรี heme มีความสัมพันธ์ใกล้ชิดกับ CO มากกว่า O 2 ถึง 25,000 เท่า CO ก่อตัวขึ้นในปริมาณเล็กน้อยในร่างกาย และเนื่องจากมีความเกี่ยวข้องกับ heme สูง จึงอาจขัดขวางการลำเลียง O 2 ที่จำเป็นสำหรับชีวิตของเซลล์ อย่างไรก็ตาม ในองค์ประกอบของเฮโมโกลบิน ความสัมพันธ์ของฮีมต่อคาร์บอนมอนอกไซด์นั้นสูงกว่าค่าสัมพรรคภาพของ O 2 เพียง 200 เท่าเนื่องจากการมีอยู่ของ E 7 ในศูนย์กลางที่แอคทีฟของเขา ส่วนที่เหลือของกรดอะมิโนนี้จะสร้าง เงื่อนไขที่เหมาะสมที่สุดสำหรับการผูก heme กับ O 2 และทำให้ปฏิกิริยาของ heme กับ CO อ่อนแอลง
5. หน้าที่หลักของ Hb คือการขนส่ง O 2 จากปอดไปยังเนื้อเยื่อโครงสร้าง oligomeric ของเฮโมโกลบินไม่เหมือนกับโมโนเมอร์ที่มีความสัมพันธ์กับ O 2 และทำหน้าที่เก็บออกซิเจนในกล้ามเนื้อสีแดง:
1) ความอิ่มตัวอย่างรวดเร็วของ Hb กับออกซิเจนในปอด
2) ความสามารถของ Hb ในการปลดปล่อยออกซิเจนในเนื้อเยื่อที่ความดันบางส่วนที่ค่อนข้างสูงของ O 2 (20-40 mm Hg)
3) ความเป็นไปได้ในการควบคุมความสัมพันธ์ของ Hb กับ O 2 .
6. การเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์ของเฮโมโกลบินจะเร่งการผูกมัดของ O 2 ในปอดและกลับสู่เนื้อเยื่อ ในปอด ความดันบางส่วนที่สูงของ O2 ส่งเสริมการผูกมัดกับ Hb ในบริเวณที่ทำงานของโปรโตเมอร์สี่ตัว (2αและ2β) จุดศูนย์กลางที่แอคทีฟของโปรโตเมอร์แต่ละตัว เช่นเดียวกับใน myoglobin นั้นตั้งอยู่ระหว่าง α-helices (F และ E) สองตัวในกระเป๋าที่ไม่ชอบน้ำ ประกอบด้วยส่วนที่ไม่ใช่โปรตีน - heme ติดกับส่วนโปรตีนโดยปฏิกิริยาที่ไม่ชอบน้ำที่อ่อนแอจำนวนมาก และพันธะที่แน่นหนาระหว่าง Fe 2 + heme กับ His F 8 (ดูรูปที่ 1.21)
ใน deoxyhemoglobin เนื่องจากการเชื่อมต่อกับ His F 8 อะตอม Fe 2 + จะยื่นออกมาจากระนาบ heme ไปทางฮิสทิดีน การผูกมัดของ O 2 กับ Fe 2 + เกิดขึ้นที่อีกด้านหนึ่งของ heme ในภูมิภาค His E 7 ด้วยความช่วยเหลือของพันธะประสานงานอิสระเดียว E 7 ของเขาให้สภาวะที่เหมาะสมที่สุดสำหรับการผูก O 2 ด้วยเหล็กเฮม
การเพิ่ม O 2 เข้ากับอะตอม Fe +2 ของโปรโตเมอร์หนึ่งตัวทำให้เคลื่อนเข้าสู่ระนาบ heme และด้านหลังมีฮิสทิดีนตกค้างที่เกี่ยวข้อง
 ข้าว. 1.23. การเปลี่ยนแปลงรูปร่างของโปรโตเมอร์ของเฮโมโกลบินเมื่อรวมกับ O 2
ข้าว. 1.23. การเปลี่ยนแปลงรูปร่างของโปรโตเมอร์ของเฮโมโกลบินเมื่อรวมกับ O 2
สิ่งนี้นำไปสู่การเปลี่ยนแปลงในโครงสร้างของสายโพลีเปปไทด์ทั้งหมดเนื่องจากความสามารถในการกำหนดรูปแบบได้ การเปลี่ยนโครงสร้างของสายโซ่อื่นๆ ช่วยให้เกิดปฏิสัมพันธ์กับโมเลกุล O 2 ถัดไปได้ง่ายขึ้น
โมเลกุล O 2 ที่สี่ยึดติดกับเฮโมโกลบินได้ง่ายกว่าโมเลกุลแรก 300 เท่า (รูปที่ 1.24)
 ข้าว. 1.24. การเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์เฮโมโกลบินในระหว่างการมีปฏิสัมพันธ์กับ O 2
ข้าว. 1.24. การเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์เฮโมโกลบินในระหว่างการมีปฏิสัมพันธ์กับ O 2
ในเนื้อเยื่อ แต่ละโมเลกุลของ O 2 ที่ตามมาจะถูกตัดออกได้ง่ายกว่าโมเลกุลก่อนหน้า นอกจากนี้ เนื่องจากการเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์
7. CO 2 และ H + เกิดขึ้นระหว่างกระบวนการ catabolism ของสารอินทรีย์ ลดความสัมพันธ์ของฮีโมโกลบินสำหรับ O 2 ตามสัดส่วนของความเข้มข้น พลังงานที่จำเป็นสำหรับการทำงานของเซลล์ส่วนใหญ่ผลิตขึ้นในไมโตคอนเดรียในระหว่างการออกซิเดชันของสารอินทรีย์โดยใช้ O 2 ที่ส่งมาจากปอดโดยเฮโมโกลบิน เป็นผลมาจากการเกิดออกซิเดชันของสารอินทรีย์ทำให้เกิดผลิตภัณฑ์ขั้นสุดท้ายของการสลายตัว: CO 2 และ K 2 O ปริมาณซึ่งเป็นสัดส่วนกับความเข้มของกระบวนการออกซิเดชันอย่างต่อเนื่อง
CO 2 แพร่กระจายจากเซลล์เข้าสู่กระแสเลือดและแทรกซึมเข้าสู่เม็ดเลือดแดง ซึ่งภายใต้การกระทำของเอนไซม์คาร์บันไฮเดรสจะเปลี่ยนเป็นกรดคาร์บอนิก กรดอ่อนนี้จะแยกตัวออกเป็นโปรตอนและไอออนไบคาร์บอเนต
H+ สามารถเข้าร่วมอนุมูล GIS ได้ 14 6 ใน α- และ β-chains ของเฮโมโกลบินเช่น ในพื้นที่ห่างไกลจากเฮม โปรตอนของเฮโมโกลบินลดความสัมพันธ์กับ O 2 ส่งเสริมการกำจัด O 2 ออกจาก oxyHb การก่อตัวของ deoxyHb และเพิ่มปริมาณออกซิเจนไปยังเนื้อเยื่อตามสัดส่วนของจำนวนโปรตอนที่เกิดขึ้น (รูปที่ 1.25)
การเพิ่มขึ้นของปริมาณออกซิเจนที่ปล่อยออกมาขึ้นอยู่กับการเพิ่มขึ้นของความเข้มข้นของ H + ในเม็ดเลือดแดงเรียกว่าเอฟเฟกต์ Bohr (หลังจากนักสรีรวิทยาชาวเดนมาร์ก Christian Bohr ผู้ค้นพบผลกระทบนี้เป็นครั้งแรก)
ในปอด ความดันบางส่วนของออกซิเจนสูงจะส่งเสริมการจับกับ deoxyHb ซึ่งจะช่วยลดความสัมพันธ์ของโปรตีนสำหรับ H+ โปรตอนที่ถูกปล่อยออกมาภายใต้การกระทำของ carbanhydrase ทำปฏิกิริยากับไบคาร์บอเนตเพื่อสร้าง CO 2 และ H 2 O

 ข้าว. 1.25. การพึ่งพาความสัมพันธ์ของ Hb กับ O 2 กับความเข้มข้นของ CO 2 และโปรตอน (ผลกระทบจากบอร์):
ข้าว. 1.25. การพึ่งพาความสัมพันธ์ของ Hb กับ O 2 กับความเข้มข้นของ CO 2 และโปรตอน (ผลกระทบจากบอร์):
แต่- อิทธิพลของความเข้มข้นของ CO 2 และ H+ ต่อการปล่อย O 2 จากคอมเพล็กซ์ด้วย Hb (เอฟเฟกต์บอร์) บี- การเติมออกซิเจนของดีออกซีเฮโมโกลบินในปอด การก่อตัวและการปล่อย CO 2
CO 2 ที่เป็นผลลัพธ์จะเข้าสู่ช่องว่างของถุงลมและถูกขับออกด้วยอากาศที่หายใจออก ดังนั้นปริมาณออกซิเจนที่ปล่อยออกมาจากเฮโมโกลบินในเนื้อเยื่อจึงถูกควบคุมโดยผลิตภัณฑ์ของแคแทบอลิซึมของสารอินทรีย์: ยิ่งการสลายตัวของสารรุนแรงขึ้นเช่นในระหว่างการออกแรงทางกายภาพความเข้มข้นของ CO 2 และ H + ยิ่งสูงขึ้น ออกซิเจนที่เนื้อเยื่อได้รับเนื่องจากความสัมพันธ์ระหว่าง H ถึง O 2 ลดลง
8. ระเบียบ Allosteric ของความสัมพันธ์ของ Hb สำหรับ O 2 โดยลิแกนด์ - 2,3-bisphosphoglycerateในเม็ดเลือดแดง ลิแกนด์ allosteric ของเฮโมโกลบิน 2,3-bisphosphoglycerate (2,3-BPG) ถูกสังเคราะห์จากผลิตภัณฑ์ของการเกิดออกซิเดชันของกลูโคส - 1,3-bisphosphoglycerate ภายใต้สภาวะปกติ ความเข้มข้นของ 2,3-BPG จะสูงและเทียบได้กับความเข้มข้นของ Hb 2,3-BPG มีประจุลบที่แข็งแกร่งที่ -5
 Bisphosphoglycerate ในเนื้อเยื่อเส้นเลือดฝอย โดยการจับกับ deoxyhemoglobin จะเพิ่มปริมาณออกซิเจนในเนื้อเยื่อ ลดความสัมพันธ์ของ Hb ต่อ O 2
Bisphosphoglycerate ในเนื้อเยื่อเส้นเลือดฝอย โดยการจับกับ deoxyhemoglobin จะเพิ่มปริมาณออกซิเจนในเนื้อเยื่อ ลดความสัมพันธ์ของ Hb ต่อ O 2
มีโพรงอยู่ตรงกลางของโมเลกุลเฮโมโกลบินเตตราเมอร์ มันถูกสร้างขึ้นโดยส่วนที่เหลือของกรดอะมิโนของโปรโตเมอร์ทั้งสี่ (ดูรูปที่ 1.22) ในเส้นเลือดฝอยของเนื้อเยื่อ โปรตอนของ Hb (ผลกระทบจากบอร์) จะทำลายพันธะระหว่างธาตุเหล็ก heme และ O 2 ในโมเลกุล
deoxyhemoglobin เมื่อเทียบกับ oxyhemoglobin พันธะไอออนิกเพิ่มเติมปรากฏขึ้นที่เชื่อมต่อโปรโตเมอร์อันเป็นผลมาจากขนาดของโพรงกลางเพิ่มขึ้นเมื่อเทียบกับ oxyhemoglobin ช่องกลางคือบริเวณที่ยึด 2,3-BPG กับเฮโมโกลบิน เนื่องจากความแตกต่างของขนาดของช่องกลาง 2,3-BPG สามารถยึดติดกับ deoxyhemoglobin เท่านั้น
2,3-BPG ทำปฏิกิริยากับเฮโมโกลบินในพื้นที่ห่างไกลจากไซต์แอคทีฟของโปรตีนและเป็นของ allosteric(ระเบียบข้อบังคับ) ลิแกนด์และช่องกลาง Hb is ศูนย์อัลลอสเตอร์ 2,3-BPG มีประจุลบที่รุนแรงและมีปฏิสัมพันธ์กับกลุ่มที่มีประจุบวกห้ากลุ่มของสาย Hb β สองสาย: กลุ่ม N-terminal α-amino กลุ่ม Val และ Lys 82 Gis 143 อนุมูล (รูปที่ 1.26)
 ข้าว. 1.26. BPG ในช่องกลางของ deoxyhemoglobin
ข้าว. 1.26. BPG ในช่องกลางของ deoxyhemoglobin
BPG จับกับกลุ่มที่มีประจุบวกสามกลุ่มในแต่ละ β-strand
ในเนื้อเยื่อเส้นเลือดฝอย ผลที่ได้คือดีออกซีเฮโมโกลบินมีปฏิสัมพันธ์กับ 2,3-BPG และพันธะไอออนิกเกิดขึ้นระหว่างอนุมูลที่มีประจุบวกของสาย β และลิแกนด์ที่มีประจุลบ ซึ่งเปลี่ยนรูปแบบโปรตีนและลดความสัมพันธ์ของ Hb สำหรับ O 2 ความสัมพันธ์ที่ลดลงของ Hb สำหรับ O 2 มีส่วนทำให้การปลดปล่อย O 2 เข้าสู่เนื้อเยื่อมีประสิทธิภาพมากขึ้น
ในปอด ที่ความดันบางส่วนสูง ออกซิเจนจะทำปฏิกิริยากับ Hb รวมเข้ากับเหล็กฮีม ในกรณีนี้ โครงสร้างของโปรตีนจะเปลี่ยนไป ช่องกลางลดลง และ 2,3-BPG ถูกแทนที่จากศูนย์กลางอัลโลสเตอริก
ดังนั้นโปรตีนโอลิโกเมอร์จึงมีคุณสมบัติใหม่เมื่อเปรียบเทียบกับโปรตีนโมโนเมอร์ สิ่งที่แนบมาของลิแกนด์ที่ไซต์
อยู่ห่างจากกันเชิงพื้นที่ (อัลลอสเตอริก) ซึ่งสามารถทำให้เกิดการเปลี่ยนแปลงเชิงโครงสร้างในโมเลกุลโปรตีนทั้งหมด เนื่องจากปฏิสัมพันธ์กับลิแกนด์ควบคุม การเปลี่ยนแปลงรูปแบบและการทำงานของโมเลกุลโปรตีนจึงปรับให้เข้ากับการเปลี่ยนแปลงของสิ่งแวดล้อม
หัวข้อ 1.5. การบำรุงรักษาโครงสร้างโปรตีนโดยกำเนิดภายใต้สภาวะของเซลล์
ในเซลล์ ในระหว่างการสังเคราะห์สายโซ่โพลีเปปไทด์ การขนส่งผ่านเยื่อหุ้มเซลล์ไปยังส่วนที่เกี่ยวข้องของเซลล์ ในกระบวนการพับ (การก่อตัวของโครงสร้างดั้งเดิม) และระหว่างการประกอบโปรตีนโอลิโกเมอร์ตลอดจนระหว่างการทำงาน ระดับกลาง , โครงสร้างที่มีแนวโน้มการรวมตัว, ที่ไม่เสถียรเกิดขึ้นในโครงสร้างโปรตีน อนุมูลที่ไม่ชอบน้ำ ซึ่งมักจะซ่อนอยู่ภายในโมเลกุลโปรตีนในรูปแบบดั้งเดิม ปรากฏบนพื้นผิวในรูปแบบที่ไม่เสถียรและมีแนวโน้มที่จะรวมกับกลุ่มของโปรตีนอื่นๆ ที่ละลายได้ไม่ดีในน้ำในทำนองเดียวกัน ในเซลล์ของสิ่งมีชีวิตที่รู้จักทั้งหมด มีการค้นพบโปรตีนพิเศษที่ให้การพับของโปรตีนในเซลล์อย่างเหมาะสม รักษาเสถียรภาพของโครงสร้างดั้งเดิมระหว่างการทำงาน และที่สำคัญที่สุดคือ รักษาโครงสร้างและหน้าที่ของโปรตีนภายในเซลล์ในกรณีที่เกิดภาวะธำรงดุลยภาพผิดปกติ โปรตีนเหล่านี้เรียกว่า "พี่เลี้ยง"ซึ่งหมายถึง "พี่เลี้ยง" ในภาษาฝรั่งเศส
1. พี่เลี้ยงระดับโมเลกุลและบทบาทในการป้องกันการเสื่อมสภาพของโปรตีน
พี่เลี้ยง (III) จำแนกตามมวลของหน่วยย่อย พี่เลี้ยงที่มีน้ำหนักโมเลกุลสูงมีมวล 60 ถึง 110 kD ในหมู่พวกเขามีสามชั้นเรียนที่ได้รับการศึกษามากที่สุด: Sh-60, Sh-70 และ Sh-90 แต่ละชั้นประกอบด้วยตระกูลของโปรตีนที่เกี่ยวข้อง ดังนั้น Sh-70 จึงมีโปรตีนที่มีน้ำหนักโมเลกุล 66 ถึง 78 kD พี่เลี้ยงที่มีน้ำหนักโมเลกุลต่ำมีน้ำหนักโมเลกุล 40 ถึง 15 kD
ในบรรดาพี่เลี้ยงมี รัฐธรรมนูญโปรตีนที่มีการสังเคราะห์พื้นฐานสูงไม่ขึ้นอยู่กับผลกระทบต่อเซลล์ของร่างกายและ เหนี่ยวนำให้เกิด,การสังเคราะห์ซึ่งภายใต้สภาวะปกตินั้นอ่อนแอ แต่เพิ่มขึ้นอย่างรวดเร็วภายใต้อิทธิพลที่ตึงเครียด พี่เลี้ยงที่เหนี่ยวนำได้เรียกอีกอย่างว่า "โปรตีนช็อตจากความร้อน" เนื่องจากถูกค้นพบครั้งแรกในเซลล์ที่สัมผัสกับ อุณหภูมิสูง. ในเซลล์ เนื่องจากโปรตีนมีความเข้มข้นสูง การงอกใหม่ตามธรรมชาติของโปรตีนที่เสียสภาพบางส่วนจึงเป็นเรื่องยาก Sh-70 สามารถป้องกันกระบวนการทำให้เสียสภาพที่เริ่มขึ้นและช่วยฟื้นฟูโครงสร้างโปรตีนตามธรรมชาติ โมเลกุลพี่เลี้ยง-70- คลาสโปรตีนที่มีการอนุรักษ์อย่างสูงที่พบในทุกส่วนของเซลล์: ไซโตพลาสซึม, นิวเคลียส, เอนโดพลาสมิกเรติคูลัม, ไมโทคอนเดรีย ที่ปลายคาร์บอกซิลของสายโซ่โพลีเปปไทด์เพียงสายเดียวของ Sh-70 มีบริเวณที่เป็นร่องที่สามารถโต้ตอบกับเปปไทด์ที่มีความยาวได้
จากสารตกค้างของกรดอะมิโน 7 ถึง 9 ตัวที่อุดมไปด้วยอนุมูลอิสระ ตำแหน่งดังกล่าวในโปรตีนทรงกลมเกิดขึ้นทุกๆ 16 กรดอะมิโนโดยประมาณ Sh-70 สามารถปกป้องโปรตีนจากการยับยั้งความร้อนและฟื้นฟูโครงสร้างและกิจกรรมของโปรตีนที่เสียสภาพบางส่วน
2. บทบาทของพี่เลี้ยงในการพับโปรตีนในระหว่างการสังเคราะห์โปรตีนบนไรโบโซม บริเวณปลาย N ของโพลีเปปไทด์จะถูกสังเคราะห์ก่อนบริเวณปลาย C ลำดับกรดอะมิโนที่สมบูรณ์ของโปรตีนจำเป็นต่อการก่อรูปโครงสร้างโดยกำเนิด ในกระบวนการสังเคราะห์โปรตีน พี่เลี้ยง-70 เนื่องจากโครงสร้างของจุดศูนย์กลางที่แอคทีฟของพวกมัน จึงสามารถปิดบริเวณที่มีแนวโน้มการรวมตัวของโพลีเปปไทด์ที่อุดมไปด้วยอนุมูลของกรดอะมิโนที่ไม่ชอบน้ำได้จนกว่าการสังเคราะห์จะเสร็จสิ้น (รูปที่ 1.27, A)
 ข้าว. 1.27. การมีส่วนร่วมของพี่เลี้ยงในการพับโปรตีน
ข้าว. 1.27. การมีส่วนร่วมของพี่เลี้ยงในการพับโปรตีน
เอ - การมีส่วนร่วมของพี่เลี้ยง-70 ในการป้องกันปฏิกิริยาที่ไม่ชอบน้ำระหว่างไซต์ของโพลีเปปไทด์สังเคราะห์ B - การก่อตัวของรูปแบบโปรตีนพื้นเมืองในคอมเพล็กซ์พี่เลี้ยง
โปรตีนที่มีน้ำหนักโมเลกุลสูงจำนวนมากที่มีโครงสร้างซับซ้อน เช่น โครงสร้างโดเมน พับในพื้นที่พิเศษที่เกิดจาก W-60 Sh-60ทำหน้าที่เป็นคอมเพล็กซ์ oligomeric ซึ่งประกอบด้วย 14 หน่วยย่อย พวกเขาสร้างวงแหวนกลวงสองวงซึ่งแต่ละอันประกอบด้วยเจ็ดหน่วยย่อยวงแหวนเหล่านี้เชื่อมต่อกัน แต่ละหน่วยย่อยของ III-60 ประกอบด้วยสามโดเมน: ปลาย (ปลาย), อุดมด้วยอนุมูลที่ไม่ชอบน้ำซึ่งหันหน้าไปทางโพรงของวงแหวน, ระดับกลางและเส้นศูนย์สูตร (รูปที่ 1.28)
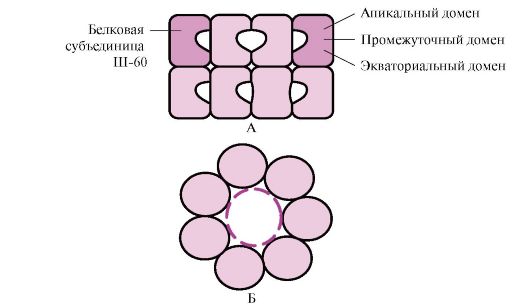 ข้าว. 1.28. โครงสร้างของ chaperonin complex ประกอบด้วย 14 Sh-60
ข้าว. 1.28. โครงสร้างของ chaperonin complex ประกอบด้วย 14 Sh-60
เอ - มุมมองด้านข้าง; B - มุมมองด้านบน
โปรตีนสังเคราะห์ที่มีองค์ประกอบพื้นผิวที่มีลักษณะเฉพาะของโมเลกุลที่คลี่ออกโดยเฉพาะอนุมูลที่ไม่ชอบน้ำจะเข้าสู่โพรงของวงแหวนพี่เลี้ยง ในสภาพแวดล้อมเฉพาะของโพรงเหล่านี้ การแจงนับของรูปแบบที่เป็นไปได้จะเกิดขึ้นจนกว่าจะพบเพียงรูปแบบเดียวที่เป็นประโยชน์มากที่สุดเท่านั้น (รูปที่ 1.27, B) การก่อตัวของโครงสร้างและการปลดปล่อยโปรตีนนั้นมาพร้อมกับการไฮโดรไลซิสของ ATP ในบริเวณเส้นศูนย์สูตร โดยทั่วไป การพับแบบขึ้นกับพี่เลี้ยงนั้นต้องการพลังงานจำนวนมาก
นอกเหนือจากการมีส่วนร่วมในการก่อตัวของโครงสร้างสามมิติของโปรตีนและการฟื้นฟูโปรตีนที่แปลงสภาพบางส่วนแล้ว พี่เลี้ยงยังจำเป็นสำหรับกระบวนการพื้นฐานเช่นการรวมตัวของโปรตีนโอลิโกเมอริก การรับรู้และการขนส่งโปรตีนที่แปลงสภาพเป็นไลโซโซม การขนส่งโปรตีน ข้ามเยื่อหุ้มและการมีส่วนร่วมในการควบคุมกิจกรรมของโปรตีนเชิงซ้อน
หัวข้อ 1.6. ความหลากหลายของโปรตีน กลุ่มโปรตีนในตัวอย่างของอิมมูโนโกลบูลิน
1. กระรอกเล่น บทบาทชี้ขาดในชีวิตของเซลล์แต่ละเซลล์และสิ่งมีชีวิตหลายเซลล์ทั้งหมด และหน้าที่ของพวกมันมีความหลากหลายอย่างน่าประหลาดใจ สิ่งนี้ถูกกำหนดโดยลักษณะเฉพาะของโครงสร้างหลักและโครงสร้างของโปรตีน โครงสร้างเฉพาะของศูนย์แอคทีฟ และความสามารถในการจับลิแกนด์จำเพาะ
มีเพียงส่วนเล็ก ๆ ของสายโซ่เปปไทด์ที่เป็นไปได้ทั้งหมดเท่านั้นที่สามารถนำมาใช้โครงสร้างเชิงพื้นที่ที่มั่นคงได้ ข้างมาก
ของพวกมันสามารถแปลงร่างได้หลายอย่างด้วยพลังงานกิ๊บส์ที่ใกล้เคียงกัน แต่ด้วย คุณสมบัติต่างๆ. โครงสร้างเบื้องต้นของโปรตีนที่รู้จักมากที่สุด เลือก วิวัฒนาการทางชีววิทยาให้ความเสถียรเป็นพิเศษของโครงสร้างที่กำหนดลักษณะเฉพาะของการทำงานของโปรตีนนี้
2. ตระกูลโปรตีนภายในสปีชีส์ทางชีววิทยาเดียวกัน การแทนที่ของเรซิดิวกรดอะมิโนสามารถนำไปสู่การเกิดขึ้นของโปรตีนที่แตกต่างกันซึ่งทำหน้าที่ที่เกี่ยวข้องกันและมีลำดับกรดอะมิโนที่คล้ายคลึงกัน โปรตีนที่เกี่ยวข้องดังกล่าวมีโครงสร้างที่คล้ายกันอย่างน่าทึ่ง: จำนวนและการจัดเรียงของ α-เฮลิซและ/หรือโครงสร้าง β และการหมุนและการพับส่วนใหญ่ของสายโพลีเปปไทด์มีความคล้ายคลึงหรือเหมือนกัน โปรตีนที่มีบริเวณคล้ายคลึงกันของสายโพลีเปปไทด์ โครงสร้างที่คล้ายกันและหน้าที่ที่เกี่ยวข้องจะถูกแยกออกเป็นตระกูลโปรตีน ตัวอย่างของตระกูลโปรตีน: โปรตีนซีรีน, ตระกูลอิมมูโนโกลบูลิน, ตระกูลไมโอโกลบิน
โปรตีนซีรีน- ตระกูลโปรตีนที่ทำหน้าที่ของเอนไซม์โปรตีโอไลติก เหล่านี้รวมถึงเอนไซม์ย่อยอาหาร - ไคโมทริปซิน, ทริปซิน, อีลาสเทสและปัจจัยการแข็งตัวของเลือด โปรตีนเหล่านี้มีกรดอะมิโนเหมือนกัน 40% และมีโครงสร้างคล้ายกันมาก (รูปที่ 1.29)

ข้าว. 1.29. โครงสร้างเชิงพื้นที่ของอีลาสเทส (A) และไคโมทริปซิน (B)
การแทนที่กรดอะมิโนบางตัวทำให้เกิดการเปลี่ยนแปลงในความจำเพาะของซับสเตรตของโปรตีนเหล่านี้และการเกิดขึ้นของความหลากหลายเชิงฟังก์ชันภายในแฟมิลี
3. ครอบครัวของอิมมูโนโกลบูลินในการทำงานของระบบภูมิคุ้มกัน บทบาทที่ยิ่งใหญ่เล่นโปรตีนของอิมมูโนโกลบูลิน superfamily ซึ่งรวมถึงสามตระกูลของโปรตีน:
แอนติบอดี (อิมมูโนโกลบูลิน);
ตัวรับ T-lymphocyte;
โปรตีนของคอมเพล็กซ์ histocompatibility ที่สำคัญ - คลาส MHC 1 และ 2 (คอมเพล็กซ์ Histocompatibility หลัก)
โปรตีนทั้งหมดเหล่านี้มีโครงสร้างโดเมน ประกอบด้วยโดเมนคล้ายภูมิคุ้มกันที่คล้ายคลึงกันและทำหน้าที่คล้ายคลึงกัน: พวกมันมีปฏิสัมพันธ์กับโครงสร้างแปลกปลอมไม่ว่าจะละลายในเลือด น้ำเหลืองหรือของเหลวระหว่างเซลล์ (แอนติบอดี) หรืออยู่บนพื้นผิวของเซลล์ (ของตัวเองหรือ ต่างชาติ).
4. แอนติบอดี- โปรตีนจำเพาะที่ผลิตโดย B-lymphocytes เพื่อตอบสนองต่อการบริโภคโครงสร้างแปลกปลอมที่เรียกว่า แอนติเจน
คุณสมบัติของโครงสร้างของแอนติบอดี
โมเลกุลแอนติบอดีที่ง่ายที่สุดประกอบด้วยสายโพลีเปปไทด์สี่สาย: สายเบาที่เหมือนกันสองสาย - L มีกรดอะมิโนประมาณ 220 ตัวและสายหนักเหมือนกันสองสาย - H ซึ่งประกอบด้วยกรดอะมิโน 440-700 ตัว สายโซ่ทั้งสี่สายในโมเลกุลแอนติบอดีเชื่อมต่อกันด้วยพันธะที่ไม่ใช่โควาเลนต์จำนวนมากและพันธะไดซัลไฟด์สี่พันธะ (รูปที่ 1.30)
สายเบาของแอนติบอดีประกอบด้วยสองโดเมน: ตัวแปร (VL) ที่อยู่ในบริเวณปลาย N ของสายโพลีเปปไทด์ และค่าคงที่ (CL) ซึ่งตั้งอยู่ที่ปลาย C โซ่หนักโดยทั่วไปมีสี่โดเมน: หนึ่งตัวแปร (VH) ที่ปลาย N และสามค่าคงที่ (CH1, CH2, CH3) (ดูรูปที่ 1.30) โดเมนอิมมูโนโกลบูลินแต่ละโดเมนมีโครงสร้างเสริม β-pleated โดยที่ซิสเตอีนตกค้างสองตัวเชื่อมโยงกันด้วยพันธะไดซัลไฟด์
ระหว่างโดเมนคงที่ CH1 และ CH2 สองโดเมนมีบริเวณที่มีโพรลีนเรซิดิวจำนวนมาก ซึ่งป้องกันการก่อตัวของโครงสร้างทุติยภูมิและอันตรกิริยาของสาย H ที่อยู่ใกล้เคียงในส่วนนี้ บริเวณบานพับนี้ให้ความยืดหยุ่นของโมเลกุลแอนติบอดี ระหว่างโดเมนที่แปรผันได้ของสายหนักและสายเบาเป็นตำแหน่งซึ่งจับแอนติเจนที่เหมือนกันสองแห่ง (ตำแหน่งที่ออกฤทธิ์สำหรับแอนติเจนในการจับ) ดังนั้นแอนติบอดีดังกล่าวจึงมักถูกเรียกว่า ไบวาเลนท์การจับของแอนติเจนกับแอนติบอดีไม่เกี่ยวข้องกับลำดับกรดอะมิโนทั้งหมดของบริเวณที่แปรผันได้ของทั้งสองสาย แต่มีกรดอะมิโนเพียง 20-30 ตัวเท่านั้นที่อยู่ในบริเวณที่แปรผันได้สูงของแต่ละสาย เป็นพื้นที่เหล่านี้ที่กำหนดความสามารถเฉพาะของแอนติบอดีแต่ละประเภทในการโต้ตอบกับแอนติเจนเสริมที่สอดคล้องกัน
แอนติบอดีเป็นหนึ่งในแนวป้องกันของร่างกายจากการบุกรุกสิ่งมีชีวิตต่างประเทศ การทำงานของพวกมันสามารถแบ่งออกเป็นสองขั้นตอน: ระยะแรกคือการรับรู้และการผูกมัดของแอนติเจนบนพื้นผิวของสิ่งมีชีวิตแปลกปลอม ซึ่งเป็นไปได้เนื่องจากการมีอยู่ของตำแหน่งที่จับกับแอนติเจนในโครงสร้างแอนติบอดี ขั้นตอนที่สองคือการเริ่มต้นกระบวนการปิดการใช้งานและการทำลายแอนติเจน ความจำเพาะของระยะที่สองขึ้นอยู่กับประเภทของแอนติบอดี โซ่หนักมีห้าคลาสที่แตกต่างกันในโครงสร้างของโดเมนคงที่: α, δ, ε, γ และ μ ตามประเภทของอิมมูโนโกลบูลินห้าคลาส: A, D, E, G และ M
ลักษณะโครงสร้างของสายหนักทำให้บริเวณบานพับและบริเวณปลาย C ของสายหนักมีลักษณะโครงสร้างของแต่ละชั้น เมื่อแอนติเจนจับกับแอนติบอดี การเปลี่ยนแปลงเชิงโครงสร้างในโดเมนคงที่จะกำหนดวิถีสำหรับการกำจัดแอนติเจน
 ข้าว. 1. 30. โครงสร้างโดเมนของ IgG
ข้าว. 1. 30. โครงสร้างโดเมนของ IgG
อิมมูโนโกลบูลิน M
อิมมูโนโกลบูลิน M มีสองรูปแบบ
แบบฟอร์มโมโนเมอร์- แอนติบอดีประเภทที่ 1 ที่ผลิตโดย B-lymphocyte ที่กำลังพัฒนา ต่อจากนั้น บีเซลล์จำนวนมากเปลี่ยนไปผลิตแอนติบอดีประเภทอื่น แต่มีตำแหน่งจับแอนติเจนเดียวกัน IgM ถูกรวมเข้าไปในเมมเบรนและทำหน้าที่เป็นตัวรับที่รับรู้แอนติเจน การรวมตัวของ IgM เข้าไปในเยื่อหุ้มเซลล์เป็นไปได้เนื่องจากการมีอยู่ของกรดอะมิโนที่ไม่ชอบน้ำ 25 ตัวในส่วนหางของบริเวณ
รูปแบบสารคัดหลั่งของ IgMประกอบด้วยหน่วยย่อยโมโนเมอร์ห้ายูนิตที่เชื่อมต่อซึ่งกันและกันโดยพันธะไดซัลไฟด์และสาย J โพลีเปปไทด์เพิ่มเติม (รูปที่ 1.31) โมโนเมอร์สายหนักในแบบฟอร์มนี้ไม่มีหางที่ไม่ชอบน้ำ เพนทาเมอร์มีจุดจับแอนติเจน 10 ตำแหน่ง ดังนั้นจึงมีประสิทธิภาพในการจดจำและกำจัดแอนติเจนที่เข้าสู่ร่างกายเป็นครั้งแรก รูปแบบสารคัดหลั่งของ IgM เป็นแอนติบอดีประเภทหลักที่หลั่งเข้าสู่กระแสเลือดระหว่างการตอบสนองทางภูมิคุ้มกันเบื้องต้น การจับ IgM กับแอนติเจนเปลี่ยนโครงสร้างของ IgM และชักนำให้เกิดการจับกับส่วนประกอบโปรตีนแรกของระบบคอมพลีเมนต์ (ระบบคอมพลีเมนต์คือชุดของโปรตีนที่เกี่ยวข้องกับการทำลายแอนติเจน) และการกระตุ้นระบบนี้ หากแอนติเจนอยู่บนพื้นผิวของจุลินทรีย์ ระบบเสริมจะทำให้เกิดการละเมิดความสมบูรณ์ของเยื่อหุ้มเซลล์และการตายของเซลล์แบคทีเรีย
อิมมูโนโกลบูลิน G
ในแง่เชิงปริมาณ อิมมูโนโกลบูลินประเภทนี้มีอิทธิพลเหนือในเลือด (75% ของ Ig ทั้งหมด) IgG - โมโนเมอร์ซึ่งเป็นแอนติบอดีระดับหลักที่หลั่งเข้าสู่กระแสเลือดระหว่างการตอบสนองของภูมิคุ้มกันทุติยภูมิ หลังจากการทำงานร่วมกันของ IgG กับแอนติเจนบนพื้นผิวของจุลินทรีย์ คอมเพล็กซ์แอนติเจน-แอนติบอดีสามารถจับและกระตุ้นโปรตีนของระบบเสริม หรือสามารถโต้ตอบกับตัวรับจำเพาะบนมาโครฟาจและนิวโทรฟิล ปฏิสัมพันธ์กับฟาโกไซต์
 ข้าว. 1.31. โครงสร้างของสารคัดหลั่งของ IgM
ข้าว. 1.31. โครงสร้างของสารคัดหลั่งของ IgM
ต่อการดูดซึมของสารเชิงซ้อนของแอนติเจนและแอนติบอดีและการทำลายของพวกมันในฟาโกโซมของเซลล์ IgG เป็นแอนติบอดีประเภทเดียวที่สามารถข้ามอุปสรรครกและป้องกันทารกในครรภ์จากการติดเชื้อในครรภ์ได้
อิมมูโนโกลบูลิน A
แอนติบอดีประเภทหลักมีอยู่ในสารคัดหลั่ง (นม น้ำลาย สิ่งคัดหลั่งจากทางเดินหายใจ และ ลำไส้). IgA ถูกคัดหลั่งออกมาในรูปแบบไดเมอร์เป็นหลัก โดยที่โมโนเมอร์เชื่อมโยงถึงกันผ่านสายโซ่ J เพิ่มเติม (รูปที่ 1.32)
IgA ไม่มีปฏิกิริยากับระบบเสริมและเซลล์ฟาโกไซติก แต่โดยการจับกับจุลินทรีย์ แอนติบอดีจะป้องกันไม่ให้พวกมันเกาะติดกับเซลล์เยื่อบุผิวและแทรกซึมเข้าสู่ร่างกาย
อิมมูโนโกลบูลิน E
อิมมูโนโกลบูลิน E แสดงโดยโมโนเมอร์ซึ่งมี ε-chains หนัก เช่นเดียวกับ μ-chains ของอิมมูโนโกลบูลิน M หนึ่งตัวแปรและโดเมนคงที่สี่โดเมน IgE หลังการหลั่งจะผูกมัดตัวเอง
 ข้าว. 1.32. โครงสร้างของ IgA
ข้าว. 1.32. โครงสร้างของ IgA
บริเวณปลาย C ที่มีตัวรับที่สอดคล้องกันบนพื้นผิวของแมสต์เซลล์และเบสโซฟิล เป็นผลให้พวกมันกลายเป็นตัวรับแอนติเจนบนพื้นผิวของเซลล์เหล่านี้ (รูปที่ 1.33)
 ข้าว. 1.33. ปฏิกิริยาของ IgE กับแอนติเจนบนพื้นผิวของเซลล์เสา
ข้าว. 1.33. ปฏิกิริยาของ IgE กับแอนติเจนบนพื้นผิวของเซลล์เสา
หลังจากที่แอนติเจนติดอยู่กับตำแหน่ง IgE ที่จับกับแอนติเจนแล้ว เซลล์จะได้รับสัญญาณเพื่อหลั่งสารออกฤทธิ์ทางชีวภาพ (ฮีสตามีน, เซโรโทนิน) ซึ่งส่วนใหญ่รับผิดชอบในการพัฒนาปฏิกิริยาการอักเสบและสำหรับการแสดงปฏิกิริยาการแพ้เช่น โรคหอบหืดลมพิษไข้ละอองฟาง
อิมมูโนโกลบูลิน D
อิมมูโนโกลบูลินดีพบได้ในซีรั่มมาก ในปริมาณที่น้อย, พวกมันเป็นโมโนเมอร์ โซ่ δ หนักมีหนึ่งตัวแปรและโดเมนคงที่สามโดเมน IgD ทำหน้าที่เป็นตัวรับ B-lymphocytes ส่วนหน้าที่อื่นๆ ยังไม่ทราบ อันตรกิริยาของแอนติเจนจำเพาะกับตัวรับบนพื้นผิวของ B-lymphocytes (IgD) นำไปสู่การส่งสัญญาณเหล่านี้ไปยังเซลล์และการกระตุ้นกลไกที่รับประกันการสืบพันธุ์ของโคลนของเซลล์เม็ดเลือดขาวนี้
หัวข้อ 1.7. คุณสมบัติทางกายภาพและเคมีของโปรตีนและวิธีการแยกออก
1. โปรตีนแต่ละตัวมีคุณสมบัติทางเคมีกายภาพแตกต่างกัน:
รูปร่างของโมเลกุล
น้ำหนักโมเลกุล
ประจุทั้งหมด ค่าที่ขึ้นอยู่กับอัตราส่วนของกลุ่มประจุลบและประจุบวกของกรดอะมิโน
อัตราส่วนของอนุมูลของกรดอะมิโนแบบมีขั้วและแบบไม่มีขั้วบนผิวของโมเลกุล
องศาของความต้านทานต่อสารเปลี่ยนสภาพต่างๆ
2. ความสามารถในการละลายของโปรตีนขึ้นอยู่กับเกี่ยวกับคุณสมบัติของโปรตีนที่ระบุไว้ข้างต้น เช่นเดียวกับองค์ประกอบของตัวกลางที่โปรตีนละลาย (ค่า pH องค์ประกอบของเกลือ อุณหภูมิ การปรากฏตัวของสารอินทรีย์อื่นๆ ที่สามารถโต้ตอบกับโปรตีนได้) ขนาดของประจุของโมเลกุลโปรตีนเป็นหนึ่งในปัจจัยที่ส่งผลต่อความสามารถในการละลายของพวกมัน เมื่อประจุหายไปที่จุดไอโซอิเล็กทริก โปรตีนจะรวมตัวกันและตกตะกอนได้ง่ายขึ้น โดยเฉพาะอย่างยิ่งสำหรับโปรตีนที่เสียสภาพซึ่งมีอนุมูลของกรดอะมิโนที่ไม่ชอบน้ำบนผิว
บนพื้นผิวของโมเลกุลโปรตีนนั้นมีทั้งอนุมูลของกรดอะมิโนที่มีประจุบวกและลบ จำนวนของกลุ่มเหล่านี้และด้วยเหตุนี้ประจุทั้งหมดของโปรตีนจึงขึ้นอยู่กับ pH ของตัวกลางนั่นคือ อัตราส่วนความเข้มข้นของกลุ่ม H + - และ OH ในสภาพแวดล้อมที่เป็นกรดการเพิ่มความเข้มข้นของ H+ นำไปสู่การปราบปรามการแยกตัวของกลุ่มคาร์บอกซิล -COO - + H+ > -COOH และการลดลงของประจุลบของโปรตีน ในสภาพแวดล้อมที่เป็นด่างการจับกันของ OH - โปรตอนส่วนเกินที่เกิดขึ้นในระหว่างการแยกตัวของหมู่อะมิโน -NH 3 + + OH - - NH 2 + H 2 O กับการก่อตัวของน้ำทำให้ประจุบวกของโปรตีนลดลง ค่า pH ที่โปรตีนมีประจุสุทธิเป็นศูนย์เรียกว่า จุดไอโซอิเล็กทริก (IEP)ใน IET จำนวนกลุ่มที่มีประจุบวกและลบจะเท่ากัน กล่าวคือ โปรตีนอยู่ในสถานะไอโซอิเล็กทริก
3. การแยกโปรตีนแต่ละตัวคุณสมบัติของโครงสร้างและการทำงานของร่างกายขึ้นอยู่กับชุดของโปรตีนที่สังเคราะห์ขึ้น การศึกษาโครงสร้างและคุณสมบัติของโปรตีนเป็นไปไม่ได้หากปราศจากการแยกตัวออกจากเซลล์และทำให้บริสุทธิ์จากโปรตีนอื่นๆ และโมเลกุลอินทรีย์ ขั้นตอนของการแยกและทำให้บริสุทธิ์ของโปรตีนแต่ละตัว:
การทำลายเซลล์ของเนื้อเยื่อที่ศึกษาและได้รับโฮโมจีเนต
การแยกโฮโมจีเนตออกเป็นเศษส่วนการหมุนเหวี่ยงเพื่อให้ได้นิวเคลียส ไมโทคอนเดรีย ไซโตซอลหรือส่วนอื่นๆ ที่มีโปรตีนที่ต้องการ
การเปลี่ยนสภาพความร้อนแบบเลือกได้- การให้ความร้อนในระยะสั้นของสารละลายโปรตีน ซึ่งสามารถขจัดสิ่งเจือปนโปรตีนบางส่วนออกได้ (ในกรณีที่โปรตีนค่อนข้างคงตัวทางความร้อน)
เกลือออกโปรตีนต่างๆ ตกตะกอนเมื่อ ความเข้มข้นต่างกันเกลือในสารละลาย โดยการค่อยๆ เพิ่มความเข้มข้นของเกลือ เป็นไปได้ที่จะได้เศษส่วนจำนวนหนึ่งซึ่งมีเนื้อหาเด่นของโปรตีนที่หลั่งออกมาในหนึ่งในนั้น การแยกส่วนโปรตีนที่ใช้บ่อยที่สุดคือแอมโมเนียมซัลเฟต โปรตีนที่มีความสามารถในการละลายต่ำที่สุดตกตะกอนที่ความเข้มข้นของเกลือต่ำ
กรองเจล- วิธีการกรองโมเลกุลผ่านเม็ด Sephadex ที่บวม (สายโซ่เดกซ์แทรนโพลีแซ็กคาไรด์สามมิติที่มีรูพรุน) อัตราการผ่านของโปรตีนผ่านคอลัมน์ที่เต็มไปด้วย Sephadex จะขึ้นอยู่กับน้ำหนักโมเลกุลของพวกมัน: ยิ่งโมเลกุลของโปรตีนมีมวลน้อยเท่าไร พวกมันก็ยิ่งเจาะเข้าไปในแกรนูลได้ง่ายขึ้นและอยู่ที่นั่นนานขึ้น ยิ่งมวลมากขึ้นเท่านั้น พวกมันก็จะหลุดออกจาก คอลัมน์.
Ultracentrifugation- วิธีการประกอบด้วยการใส่โปรตีนในหลอดหมุนเหวี่ยงในโรเตอร์ของเครื่องหมุนเหวี่ยงอัลตร้าโซนิค เมื่อโรเตอร์หมุน อัตราการตกตะกอนของโปรตีนจะแปรผันตามน้ำหนักโมเลกุล: เศษส่วนของโปรตีนที่หนักกว่าจะอยู่ใกล้ก้นหลอดมากขึ้น และส่วนที่เบากว่าจะอยู่ใกล้พื้นผิวมากขึ้น
อิเล็กโตรโฟรีซิส- วิธีการขึ้นอยู่กับความแตกต่างของความเร็วของการเคลื่อนที่ของโปรตีนในสนามไฟฟ้า ค่านี้เป็นสัดส่วนกับประจุของโปรตีน โปรตีนอิเล็กโตรโฟรีซิสดำเนินการบนกระดาษ (ในกรณีนี้ ความเร็วของโปรตีนเป็นสัดส่วนกับประจุเท่านั้น) หรือในเจลโพลีอะคริลาไมด์ที่มีขนาดรูพรุนที่แน่นอน (ความเร็วของโปรตีนเป็นสัดส่วนกับประจุและน้ำหนักโมเลกุล)
โครมาโตกราฟีแลกเปลี่ยนไอออน- วิธีการแยกส่วนตามการจับของกลุ่มโปรตีนที่แตกตัวเป็นไอออนกับเรซินแลกเปลี่ยนไอออนกลุ่มที่มีประจุตรงข้าม (ไม่ละลายน้ำ วัสดุพอลิเมอร์). ความแข็งแรงในการยึดเกาะของโปรตีนกับเรซินเป็นสัดส่วนกับประจุของโปรตีน โปรตีนที่ดูดซับบนพอลิเมอร์แลกเปลี่ยนไอออนสามารถชะล้างออกได้ด้วยความเข้มข้นของสารละลาย NaCl ที่เพิ่มขึ้น ยิ่งประจุโปรตีนต่ำเท่าไร ความเข้มข้นของ NaCl ก็ยิ่งลดลงเพื่อล้างโปรตีนที่เกี่ยวข้องกับกลุ่มไอออนิกของเรซินออกไป
Affinity โครมาโตกราฟี- วิธีเฉพาะเจาะจงที่สุดในการแยกโปรตีนแต่ละชนิด ลิแกนด์ของโปรตีนติดอยู่กับพอลิเมอร์เฉื่อยแบบโควาเลนต์ เมื่อสารละลายโปรตีนถูกส่งผ่านคอลัมน์ที่มีพอลิเมอร์ เนื่องจากการยึดเกาะของโปรตีนกับลิแกนด์ เฉพาะโปรตีนที่จำเพาะสำหรับลิแกนด์นี้เท่านั้นที่ถูกดูดซับบนคอลัมน์
ฟอกไต- วิธีการที่ใช้ในการกำจัดสารประกอบที่มีน้ำหนักโมเลกุลต่ำออกจากสารละลายของโปรตีนที่แยกได้ วิธีการนี้ขึ้นอยู่กับความสามารถของโปรตีนที่จะผ่านเมมเบรนแบบกึ่งซึมผ่านได้ ซึ่งแตกต่างจากสารที่มีน้ำหนักโมเลกุลต่ำ ใช้เพื่อทำให้โปรตีนบริสุทธิ์จากสิ่งเจือปนที่มีน้ำหนักโมเลกุลต่ำ เช่น จากเกลือหลังจากเกลือออก
การมอบหมายงานนอกหลักสูตร
1. กรอกตาราง. 1.4.
ตารางที่ 1.4. การวิเคราะห์เปรียบเทียบโครงสร้างและหน้าที่ของโปรตีนที่เกี่ยวข้อง - myoglobin และ hemoglobin
ก) จำโครงสร้างของศูนย์ที่ใช้งานอยู่ Mb และ Hb อนุมูลที่ไม่ชอบน้ำของกรดอะมิโนมีบทบาทอย่างไรในการก่อตัวของศูนย์กลางการทำงานของโปรตีนเหล่านี้? อธิบายโครงสร้างของศูนย์แอคทีฟ Mb และ Hb และกลไกการยึดเกาะของลิแกนด์ สารตกค้าง F 8 และ E 7 ของเขามีบทบาทอย่างไรในการทำงานของไซต์แอคทีฟ Mv และ Hv
ข) คุณสมบัติใหม่อะไรเมื่อเทียบกับโมโนเมอร์ myoglobin ที่มีโปรตีนโอลิโกเมอร์ที่เกี่ยวข้องอย่างใกล้ชิดคือเฮโมโกลบิน? อธิบายบทบาทของการเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์ในโมเลกุลของเฮโมโกลบิน ผลของ CO 2 และความเข้มข้นของโปรตอนต่อสัมพรรคภาพระหว่างฮีโมโกลบินกับออกซิเจน และบทบาทของ 2,3-BPG ในการควบคุมอัลโลสเตอริกของฟังก์ชัน Hb
2. อธิบายลักษณะของโมเลกุลพี่เลี้ยงโดยให้ความสนใจกับความสัมพันธ์ระหว่างโครงสร้างและหน้าที่ของพวกมัน
3. โปรตีนอะไรถูกจัดกลุ่มเป็นครอบครัว? โดยใช้ตัวอย่างของตระกูลอิมมูโนโกลบูลิน กำหนดลักษณะโครงสร้างที่คล้ายคลึงกันและหน้าที่ที่เกี่ยวข้องของโปรตีนในตระกูลนี้
4. บ่อยครั้ง โปรตีนแต่ละชนิดที่ผ่านการทำให้บริสุทธิ์เป็นสิ่งจำเป็นสำหรับการใช้งานทางชีวเคมีและทางการแพทย์ อธิบายคุณสมบัติทางเคมีกายภาพของโปรตีนที่ใช้สำหรับการแยกและการทำให้บริสุทธิ์
งานเพื่อการควบคุมตนเอง
1. เลือกคำตอบที่ถูกต้อง.
หน้าที่ของเฮโมโกลบิน:
ก. O 2 ลำเลียงจากปอดไปยังเนื้อเยื่อ B. H + ขนส่งจากเนื้อเยื่อไปยังปอด
ข. รักษาค่า pH ของเลือดให้คงที่ ง. ขนส่ง CO2 จากปอดไปยังเนื้อเยื่อ
ง. การขนส่ง CO 2 จากเนื้อเยื่อไปยังปอด
2. เลือกคำตอบที่ถูกต้อง. ลิแกนด์α -Hb protomer คือ:ก. ฮิเมะ
ข. ออกซิเจน
B. CO D. 2,3-BPG
D. β-โปรโตเมอร์
3. เลือกคำตอบที่ถูกต้อง.
เฮโมโกลบินแตกต่างจาก myoglobin:
ก. มีโครงสร้างเป็นสี่ส่วน
B. โครงสร้างทุติยภูมิแสดงโดย α-helices . เท่านั้น
B. หมายถึงโปรตีนที่ซับซ้อน
ง. โต้ตอบกับลิแกนด์อัลโลสเตอริก ง. ผูกพันกับฮีมอย่างโควาเลนต์
4. เลือกคำตอบที่ถูกต้อง.
ความสัมพันธ์ของ Hb สำหรับ O 2 ลดลง:
ก. เมื่อ O 2 โมเลกุลเกาะติดกัน B. เมื่อโมเลกุล O 2 ตัวหนึ่งถูกกำจัดออก
B. เมื่อโต้ตอบกับ 2,3-BPG
ง. เมื่อติดโปรโตเมอร์ H + D เมื่อความเข้มข้นของ 2,3-BPG ลดลง
5. ตั้งค่าการแข่งขัน
สำหรับประเภท Hb เป็นลักษณะเฉพาะ:
A. สร้างมวลรวมของไฟบริลลาร์ในรูปแบบดีออกซี B. ประกอบด้วยสายโซ่ α- สองตัวและสายโซ่ δ สองสาย
B. รูปแบบเด่นของ Hb ในเม็ดเลือดแดงของผู้ใหญ่ D. ประกอบด้วย heme ที่มี Fe + 3 ในศูนย์ที่ใช้งานอยู่
D. ประกอบด้วยสาย α- สองสายและสาย γ สองสาย 1. HvA 2
6. ตั้งค่าการแข่งขัน
แกนด์ Hb:
A. ผูกกับ Hb ที่ allosteric center
B. มีความสัมพันธ์ที่สูงมากสำหรับไซต์ที่ใช้งานอยู่ Hb
B. เข้าร่วมเพิ่มความสัมพันธ์ของ Hb กับ O 2 D. ออกซิไดซ์ Fe + 2 ถึง Fe + 3
ง. สร้างพันธะโควาเลนต์กับ hysF8
7. เลือกคำตอบที่ถูกต้อง.
พี่เลี้ยง:
ก. โปรตีนมีอยู่ในทุกส่วนของเซลล์
B. การสังเคราะห์ได้รับการปรับปรุงภายใต้อิทธิพลที่กดดัน
B. มีส่วนร่วมในการไฮโดรไลซิสของโปรตีนที่ทำให้เสียสภาพ
ง. มีส่วนร่วมในการรักษารูปแบบดั้งเดิมของโปรตีน
ง. สร้างออร์แกเนลล์ที่มีโปรตีนก่อตัวขึ้น
8. แมทช์ อิมมูโนโกลบูลิน:
ก. รูปแบบสารคัดหลั่งคือเพนทาเมริก
B. ชั้น Ig ที่ข้ามชั้นรก
B. Ig - ตัวรับเซลล์แมสต์
D. คลาสหลักของ Ig มีอยู่ในการหลั่งของเซลล์เยื่อบุผิว ดี. บี-ลิมโฟไซต์ รีเซพเตอร์ ซึ่งกระตุ้นการสืบพันธุ์ของเซลล์
9. เลือกคำตอบที่ถูกต้อง.
อิมมูโนโกลบูลินอี:
ก. ผลิตโดยแมคโครฟาจ ข. มีโซ่ ε หนัก
B. ฝังอยู่ในเยื่อหุ้มเซลล์ T-lymphocytes
ง. ทำหน้าที่เป็นตัวรับเมมเบรนสำหรับแอนติเจนบนแมสต์เซลล์และเบสโซฟิล
D. รับผิดชอบในการสำแดงอาการแพ้
10. เลือกคำตอบที่ถูกต้อง.
วิธีการแยกโปรตีนขึ้นอยู่กับความแตกต่างของน้ำหนักโมเลกุล:
ก. การกรองแบบเจล
B. การหมุนเหวี่ยงด้วยคลื่นอัลตร้าโซนิค
B. โพลีอะคริลาไมด์เจลอิเล็กโตรโฟรีซิส D. โครมาโตกราฟีแลกเปลี่ยนไอออน
ง. Affinity chromatography
11. เลือกคำตอบที่ถูกต้อง.
วิธีการแยกโปรตีนขึ้นอยู่กับความแตกต่างในการละลายในน้ำ:
ก. การกรองเจล ข. การทำเกลือออก
B. โครมาโตกราฟีแลกเปลี่ยนไอออน ง. โครมาโตกราฟีสัมพันธ์
E. โพลีอะคริลาไมด์เจลอิเล็กโทรโฟรีซิส
มาตรฐานของคำตอบ "ภารกิจเพื่อการควบคุมตนเอง"
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-D
6. 1-C, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-C
ข้อกำหนดและแนวคิดพื้นฐาน
1. โปรตีนโอลิโกเมอร์ โปรโตเมอร์ โครงสร้างควอเทอร์นารีของโปรตีน
2. การเปลี่ยนแปลงของสหกรณ์ในรูปแบบโปรโตเมอร์
3. เอฟเฟกต์บอร์
4. การควบคุม allosteric ของฟังก์ชันโปรตีน allosteric center และ allosteric effector
5. โมเลกุลพี่เลี้ยง โปรตีนช็อกความร้อน
6. กลุ่มโปรตีน (ซีรีนโปรตีเอส, อิมมูโนโกลบูลิน)
7. IgM-, G-, E-, A- การเชื่อมต่อของโครงสร้างพร้อมฟังก์ชัน
8. ประจุรวมของโปรตีน จุดไอโซอิเล็กทริกของโปรตีน
9. อิเล็กโทรโฟรีซิส
10. เกลือออก
11. การกรองเจล
12. โครมาโตกราฟีแลกเปลี่ยนไอออน
13. Ultracentrifugation
14. โครมาโตกราฟีสัมพันธ์
15. อิเล็กโตรโฟรีซิสโปรตีนในพลาสมา
งานสำหรับงานออดิชั่น
1. เปรียบเทียบการพึ่งพาระดับความอิ่มตัวของฮีโมโกลบิน (Hb) และไมโอโกลบิน (Mb) กับออกซิเจนกับความดันบางส่วนในเนื้อเยื่อ
 ข้าว. 1.34. การพึ่งพาความอิ่มตัวของ MV และHBออกซิเจนจากความดันบางส่วน
ข้าว. 1.34. การพึ่งพาความอิ่มตัวของ MV และHBออกซิเจนจากความดันบางส่วน
โปรดทราบว่ารูปร่างของเส้นโค้งความอิ่มตัวของออกซิเจนในโปรตีนนั้นแตกต่างกัน: สำหรับ myoglobin - อติพจน์ สำหรับเฮโมโกลบิน - รูปร่างซิกมอยด์
1. เปรียบเทียบค่าความดันบางส่วนของออกซิเจนที่ Mb และ Hb อิ่มตัวด้วย O 2 โดย 50% โปรตีนใดต่อไปนี้มีความสัมพันธ์ใกล้ชิดกับ O 2 มากกว่า
2. ลักษณะโครงสร้างของ MB ใดที่กำหนดความสัมพันธ์สูงสำหรับ O 2 ?
3. ลักษณะโครงสร้างใดของ Hb ที่อนุญาตให้ปล่อย O 2 ในเส้นเลือดฝอยของเนื้อเยื่อที่พัก (ที่ความดันบางส่วนที่ค่อนข้างสูงของ O 2) และเพิ่มผลตอบแทนของกล้ามเนื้อทำงานอย่างรวดเร็ว คุณสมบัติใดของโปรตีนโอลิโกเมอร์ที่ให้ผลนี้?
4. คำนวณปริมาณ O 2 (เป็น%) ที่ให้ออกซิเจนเฮโมโกลบินแก่กล้ามเนื้อพักและทำงานอย่างไร
5. สรุปความสัมพันธ์ระหว่างโครงสร้างโปรตีนและหน้าที่ของมัน
2. ปริมาณออกซิเจนที่ปล่อยออกมาจากเฮโมโกลบินในเส้นเลือดฝอยขึ้นอยู่กับความรุนแรงของกระบวนการแคแทบอลิซึมในเนื้อเยื่อ (ผลของบอร์) การเปลี่ยนแปลงในการเผาผลาญเนื้อเยื่อควบคุมความสัมพันธ์ของ Hb สำหรับ O 2 ได้อย่างไร? ผลของ CO 2 และ H+ ต่อสัมพรรคภาพของ Hb กับ O 2
 1. อธิบายเอฟเฟกต์ของบอร์
1. อธิบายเอฟเฟกต์ของบอร์
2. กระบวนการที่แสดงในแผนภาพโฟลว์ไปในทิศทางใด:
ก) ในเส้นเลือดฝอยของปอด;
b) ในเส้นเลือดฝอยเนื้อเยื่อ?
3. ความสำคัญทางสรีรวิทยาของผลกระทบจากบอร์คืออะไร?
4. ทำไมปฏิสัมพันธ์ของ Hb กับ H+ ที่ไซต์ที่ห่างไกลจาก heme จึงเปลี่ยนความสัมพันธ์ของโปรตีนสำหรับ O 2 ?
3. ความสัมพันธ์ของ Hb กับ O 2 ขึ้นอยู่กับความเข้มข้นของลิแกนด์ 2,3-biphosphoglycerate ซึ่งเป็นตัวควบคุม allosteric ของความสัมพันธ์ของ Hb กับ O 2 เหตุใดปฏิสัมพันธ์ของลิแกนด์ที่ไซต์ระยะไกลจากไซต์ที่ทำงานอยู่จึงส่งผลต่อการทำงานของโปรตีน 2,3-BPG ควบคุมความสัมพันธ์ของ Hb สำหรับ O 2 อย่างไร ในการแก้ปัญหา ให้ตอบคำถามต่อไปนี้:
1. สังเคราะห์ 2,3-biphosphoglycerate (2,3-BPG) ที่ไหนและจากอะไร? เขียนสูตรระบุประจุของโมเลกุลนี้
2. BPG โต้ตอบกับเฮโมโกลบินรูปแบบใด (ออกซีหรือดีออกซี) และเพราะเหตุใด ปฏิสัมพันธ์เกิดขึ้นที่บริเวณใดของโมเลกุล Hb
3. กระบวนการที่แสดงในแผนภาพดำเนินการไปในทิศทางใด
ก) ในเส้นเลือดฝอยเนื้อเยื่อ;
b) ในเส้นเลือดฝอยของปอด?
4. ที่ไหนควรจะมีความเข้มข้นสูงสุดของคอมเพล็กซ์
Nv-2,3-BFG:
ก) ในเส้นเลือดฝอยของกล้ามเนื้อที่เหลือ
b) ในเส้นเลือดฝอยของกล้ามเนื้อทำงาน (สมมติว่า BPG มีความเข้มข้นเท่ากันในเม็ดเลือดแดง)?
5. ความสัมพันธ์ของ Hb สำหรับออกซิเจนจะเปลี่ยนไปอย่างไรเมื่อบุคคลปรับตัวให้เข้ากับสภาวะระดับความสูงสูง หากความเข้มข้นของ BPG ในเม็ดเลือดแดงเพิ่มขึ้น? ความสำคัญทางสรีรวิทยาของปรากฏการณ์นี้คืออะไร?
4. การทำลาย 2,3-BPG ระหว่างการเก็บรักษาเลือดที่เก็บรักษาไว้จะขัดขวางการทำงานของ Hb ความสัมพันธ์ของ Hb กับ O 2 ในเลือดที่เก็บรักษาไว้จะเปลี่ยนไปอย่างไรหากความเข้มข้น 2,3-BPG ในเม็ดเลือดแดงลดลงจาก 8 เป็น 0.5 mmol/l เป็นไปได้ไหมที่จะถ่ายเลือดดังกล่าวให้กับผู้ป่วยที่ป่วยหนักถ้าความเข้มข้น 2,3-BPG กลับคืนมาไม่เร็วกว่าสามวัน? เป็นไปได้ไหมที่จะฟื้นฟูการทำงานของเม็ดเลือดแดงโดยการเพิ่ม 2,3-BPG ในเลือด?
5. จำโครงสร้างของโมเลกุลอิมมูโนโกลบูลินที่ง่ายที่สุด อิมมูโนโกลบูลินมีบทบาทอย่างไรในระบบภูมิคุ้มกัน? ทำไม Igs มักถูกเรียกว่า bivalents? โครงสร้างของ Igs สัมพันธ์กับหน้าที่อย่างไร? (อธิบายโดยใช้ตัวอย่างคลาสของอิมมูโนโกลบูลิน)
คุณสมบัติทางกายภาพและเคมีของโปรตีนและวิธีการแยกโปรตีน
6. ประจุสุทธิของโปรตีนส่งผลต่อความสามารถในการละลายของมันอย่างไร?
ก) กำหนดประจุทั้งหมดของเปปไทด์ที่ pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) ประจุของเปปไทด์นี้จะเปลี่ยนแปลงอย่างไรที่ pH >7, pH<7, рН <<7?
c) จุดไอโซอิเล็กทริกของโปรตีน (IEP) คืออะไรและอยู่ในสภาพแวดล้อมใด
IET ของเปปไทด์นี้?
d) ค่า pH ใดที่จะสามารถละลายได้น้อยที่สุดของเปปไทด์นี้
7. ทำไมนมเปรี้ยวจึง "จับตัวเป็นก้อน" เมื่อต้ม (เช่น โปรตีนจากนมเคซีนตกตะกอน) ไม่เหมือนกับนมสด โมเลกุลของเคซีนในนมสดมีประจุเป็นลบ
8. การกรองเจลใช้เพื่อแยกโปรตีนแต่ละตัว ของผสมที่ประกอบด้วยโปรตีน A, B, C ที่มีมวลโมเลกุลเท่ากับ 160,000, 80,000 และ 60,000 ตามลำดับ ถูกวิเคราะห์โดยการกรองแบบเจล (รูปที่ 1.35) เม็ดเจลบวมสามารถซึมเข้าไปในโปรตีนที่มีน้ำหนักโมเลกุลน้อยกว่า 70,000 ได้ หลักการใดที่สนับสนุนวิธีการแยกนี้ กราฟใดแสดงผลการแยกส่วนได้ถูกต้อง ระบุลำดับการปลดปล่อยโปรตีน A, B และ C จากคอลัมน์
 ข้าว. 1.35. ใช้วิธีกรองเจลเพื่อแยกโปรตีน
ข้าว. 1.35. ใช้วิธีกรองเจลเพื่อแยกโปรตีน
9. ในรูป 1.36, A แสดงไดอะแกรมของอิเล็กโตรโฟรีซิสบนกระดาษของโปรตีนในซีรัมในเลือดของบุคคลที่มีสุขภาพดี ปริมาณสัมพัทธ์ของเศษส่วนโปรตีนที่ได้จากวิธีนี้ ได้แก่ อัลบูมิน 54-58%, α 1 -โกลบูลิน 6-7%, α 2 -โกลบูลิน 8-9%, β-โกลบูลิน 13%, γ-โกลบูลิน 11-12% .
 ข้าว. 1.36 อิเล็กโตรโฟรีซิสบนกระดาษของโปรตีนในพลาสมาในเลือดของบุคคลที่มีสุขภาพดี (A) และผู้ป่วย (B)
ข้าว. 1.36 อิเล็กโตรโฟรีซิสบนกระดาษของโปรตีนในพลาสมาในเลือดของบุคคลที่มีสุขภาพดี (A) และผู้ป่วย (B)
ฉัน - γ-โกลบูลิน; II - β-โกลบูลิน; สาม -α 2 - โกลบูลิน; IV-α 2 - โกลบูลิน; วี - อัลบูมิน
หลายโรคมาพร้อมกับการเปลี่ยนแปลงเชิงปริมาณในองค์ประกอบของเวย์โปรตีน (dysproteinemia) ลักษณะของการเปลี่ยนแปลงเหล่านี้จะถูกนำมาพิจารณาเมื่อทำการวินิจฉัยและประเมินความรุนแรงและระยะของโรค
โดยใช้ข้อมูลที่ให้ไว้ในตาราง 1.5 ตั้งสมมติฐานเกี่ยวกับโรคซึ่งมีลักษณะโดยโปรไฟล์อิเล็กโตรโฟรีติกที่แสดงในรูปที่ 1.36.
ตารางที่ 1.5. การเปลี่ยนแปลงความเข้มข้นของโปรตีนในเลือดในเลือดในทางพยาธิวิทยา
หัวข้อ: TRANSMEMBRANE TRANSFER
ตัวรับภายในเซลล์: https://www.youtube.com/watch?v=Nm9u4lNCPyM
ตัวรับเมมเบรน Metabotropic ที่เกี่ยวข้องกับระบบร่อซู้ลที่สอง: https://www.youtube.com/watch?v=dQ4yVuLAbH0
ตัวรับเมมเบรน Metabotropic ที่เกี่ยวข้องกับกิจกรรมไคเนสไทโรซีน:
ประเภทของการถ่ายโอนเมมเบรน
ประเภทของช่องทางการขนส่งเมมเบรน
แนวคิดเรื่องสารมีขั้วและสารไม่มีขั้ว
ความสามารถในการซึมผ่านของเมมเบรนที่เลือกได้ช่วยรักษาสภาวะสมดุลของเซลล์ ซึ่งเป็นเนื้อหาที่เหมาะสมของไอออน น้ำ เอนไซม์และสารตั้งต้นในเซลล์ วิธีการใช้การซึมผ่านของเมมเบรนแบบเลือกได้: การขนส่งแบบพาสซีฟ, การขนส่งแบบเร่งปฏิกิริยา (การแพร่กระจายแบบอำนวยความสะดวก), การขนส่งแบบแอคทีฟ ลักษณะไม่ชอบน้ำของแกนกลางของ bilayer กำหนดความเป็นไปได้ (หรือเป็นไปไม่ได้) ของการเจาะโดยตรงผ่านเมมเบรนของสารต่างๆ จากมุมมองทางเคมีกายภาพ (ส่วนใหญ่มีขั้วและไม่มีขั้ว)
สารไม่มีขั้ว(เช่น โคเลสเตอรอลและอนุพันธ์ของโคเลสเตอรอล) ทะลุผ่านเยื่อหุ้มชีวภาพได้อย่างอิสระ ด้วยเหตุนี้ endocytosis และ exocytosis ของสารประกอบขั้ว (เช่นฮอร์โมนเปปไทด์) เกิดขึ้นได้ด้วยความช่วยเหลือของถุงน้ำพังผืดในขณะที่การหลั่งฮอร์โมนสเตียรอยด์เกิดขึ้นโดยไม่ต้องมีส่วนร่วมของถุงน้ำดังกล่าว ด้วยเหตุผลเดียวกัน ตัวรับสำหรับโมเลกุลที่ไม่มีขั้ว (เช่น ฮอร์โมนสเตียรอยด์) จะอยู่ภายในเซลล์
สารขั้วโลก(เช่น โปรตีนและไอออน) ไม่สามารถข้ามเยื่อหุ้มชีวภาพได้ นั่นคือเหตุผลที่ตัวรับโมเลกุลขั้ว (เช่น ฮอร์โมนเปปไทด์) ถูกสร้างขึ้นในเยื่อหุ้มพลาสมา และการส่งสัญญาณไปยังช่องเซลล์อื่นๆ จะดำเนินการโดยผู้ส่งสารคนที่สอง ด้วยเหตุผลเดียวกัน การถ่ายโอนเมมเบรนของสารประกอบเชิงขั้วจะดำเนินการโดยระบบพิเศษที่สร้างขึ้นในเยื่อหุ้มชีวภาพ
การซึมผ่านแบบเลือกได้มาจากเยื่อหุ้มเซลล์ ฟังก์ชั่นตัวรับดำเนินการโดยไกลโคโปรตีนซึ่งเป็นส่วนคาร์โบไฮเดรตที่อยู่ใน glycocalyx การรักษารูปร่างและความคล่องตัวนั้นมาจากโปรตีนไฟบริลลาร์และท่อในชั้นเมมเบรน ฯลฯ
แนวคิดของตัวรับและลิแกนด์
ตัวรับเซลล์- โมเลกุลบนผิวเซลล์ นิวเคลียส ออร์แกเนลล์ของเซลล์ หรือละลายในไซโตพลาสซึม ตัวรับเซลล์ทำปฏิกิริยาโดยเฉพาะโดยเปลี่ยนการกำหนดค่าเชิงพื้นที่ (รูปร่าง) ไปเป็นพันธะของโมเลกุลของสารเคมีบางชนิด - ลิแกนด์ส่งสัญญาณควบคุมภายนอก ซึ่งจะส่งสัญญาณนี้ไปยังภายในเซลล์หรือออร์แกเนลล์ของเซลล์ เว็บไซต์บนตัวรับที่มันแนบ ลิแกนด์เรียกว่าไซต์ตัวรับเดียวกันสามารถมีได้หลายตำแหน่ง ตัวรับเซลล์สามารถแบ่งออกเป็นสองประเภทหลัก - ตัวรับเมมเบรน (อยู่บนเมมเบรนที่แยกเซลล์ออกจากสภาพแวดล้อมภายนอก) และ ตัวรับภายในเซลล์
สารที่จับกับตัวรับโดยเฉพาะเรียกว่า ลิแกนด์ (ผู้สื่อสาร) ตัวรับนี้ ดังนั้น ลิแกนด์ (คำพ้องความหมาย: ผู้ส่งสาร) เป็นสารเคมีที่สามารถโต้ตอบกับตัวรับได้ ผลของปฏิสัมพันธ์นี้อาจแตกต่างออกไป ถ้าลิแกนด์ (เมสเซนเจอร์) ทำให้เกิดการเปลี่ยนแปลงรูปร่าง ตัวรับและการกระตุ้นเรียกว่า agonist . หากแกนด์ (ผู้ส่งสาร) เปลี่ยนรูปร่าง (โครงสร้าง) ของตัวรับและ ปิดกั้นตัวรับนี้ เรียกว่า antagonist
เมื่อพูดถึงอวัยวะรับความรู้สึก ลิแกนด์ (เมสเซนเจอร์) เป็นสารที่ทำหน้าที่รับกลิ่นหรือรับรส
นอกจากนี้ยังมีโปรตีนตัวรับอุณหภูมิและโปรตีนตัวรับที่ตอบสนองต่อการเปลี่ยนแปลงศักยภาพของเมมเบรน
ตัวรับสำหรับลิแกนด์ที่ละลายน้ำได้ (เมสเซนเจอร์) - ฮอร์โมนโปรตีน, อะดรีนาลีน, นอร์เอพิเนฟริน - ตั้งอยู่บนพื้นผิวของเมมเบรน (ตัวรับเมมเบรน) เนื่องจากลิแกนด์ที่ชอบน้ำไม่สามารถผ่านพื้นผิวที่ไม่เข้ากับน้ำของเมมเบรนได้ ลิแกนด์ที่ละลายในไขมัน (สารส่ง) ผ่านได้ง่ายผ่านฟอสโฟลิปิด bilayer ของเยื่อหุ้มเซลล์และนิวเคลียส ดังนั้นเซลล์จึงมีตัวรับ (ตัวรับภายในเซลล์) สำหรับพวกมันภายใน: บนออร์แกเนลล์ นิวเคลียส ตัวอย่างของลิแกนด์ที่ละลายในไขมันอาจเป็นฮอร์โมนสเตียรอยด์ของต่อมหมวกไต, อวัยวะสืบพันธุ์
นอกจากนี้ ลิแกนด์ยังแยกออกได้ สู่ภายนอก(มาจากข้างนอก) และ ภายนอก(ผลิตขึ้นภายในร่างกาย) ตามกฎแล้ว ถ้าสารภายนอกบางชนิดมีตัวรับในเซลล์ แสดงว่ามีลิแกนด์ภายในร่างกายสำหรับตัวรับนี้ ตัวอย่างเช่น ลิแกนด์ภายในตัวของตัวรับแคนนาบินอยด์ ซึ่งอัลคาลอยด์จากกัญชงจับกันคือสารอะนันดาไมด์ที่ร่างกายผลิตขึ้นจากกรดไขมันอาราคิโดนิก หรือตัวรับเอ็นดอร์ฟิน (มีบทบาทสำคัญในการก่อตัวของความเจ็บปวดและสภาวะทางอารมณ์): พวกเขาสามารถเชื่อมต่อกับลิแกนด์ภายในร่างกาย - เอ็นดอร์ฟินหรือพวกเขาสามารถผูกกับยาของกลุ่มมอร์ฟีน
ความจำเพาะสูงของการจับโปรตีนกับลิแกนด์นั้นมาจากการเติมเต็มของโครงสร้างของแอคทีฟไซต์ของโปรตีนที่มีโครงสร้างของลิแกนด์
การเติมเต็มเป็นที่เข้าใจกันว่าเป็นการสอดคล้องกันเชิงพื้นที่และทางเคมีของโมเลกุลที่มีปฏิสัมพันธ์ ลิแกนด์จะต้องสามารถเข้าได้และสอดคล้องกับโครงสร้างของแอคทีฟไซต์ ความบังเอิญนี้อาจไม่สมบูรณ์ แต่เนื่องจากความสามารถในการกำหนดโครงสร้างของโปรตีน ศูนย์ที่ทำงานอยู่สามารถเปลี่ยนแปลงเล็กน้อยและ "ปรับ" ให้กับแกนด์ได้ นอกจากนี้ ระหว่างกลุ่มหน้าที่ของลิแกนด์กับอนุมูลของกรดอะมิโนที่ก่อตัวเป็นศูนย์แอคทีฟ ควรมีพันธะที่ยึดลิแกนด์ไว้ที่ศูนย์กลางแอคทีฟ พันธะระหว่างลิแกนด์และศูนย์กลางแอคทีฟของโปรตีนอาจเป็นแบบไม่มีโควาเลนต์ (ไอออนิก ไฮโดรเจน ไม่ชอบน้ำ) หรือโควาเลนต์ก็ได้
1. ลักษณะของศูนย์ปฏิบัติการ
ศูนย์กลางที่ทำงานอยู่ของโปรตีนคือตำแหน่งที่ค่อนข้างแยกได้จากสภาพแวดล้อมรอบ ๆ โปรตีน ซึ่งก่อตัวขึ้นจากกากกรดอะมิโน ในบริเวณนี้ สารตกค้างแต่ละส่วน เนื่องมาจากขนาดและกลุ่มหน้าที่ของมัน ก่อให้เกิด "การบรรเทา" ของศูนย์ที่ใช้งานอยู่
การรวมกรดอะมิโนดังกล่าวไว้ในสารเชิงซ้อนเชิงฟังก์ชันเดียวจะเปลี่ยนปฏิกิริยาของอนุมูลของพวกมัน เช่นเดียวกับเสียงของเครื่องดนตรีที่เปลี่ยนไปเป็นชุด ดังนั้น เรซิดิวของกรดอะมิโนที่ประกอบเป็นแอกทีฟไซต์จึงมักถูกเรียกว่า "กลุ่ม" ของกรดอะมิโน
คุณสมบัติเฉพาะของศูนย์แอคทีฟไม่เพียงขึ้นอยู่กับคุณสมบัติทางเคมีของกรดอะมิโนที่ก่อตัวเท่านั้น แต่ยังขึ้นกับการวางแนวร่วมกันที่แน่นอนในอวกาศด้วย ดังนั้นแม้การรบกวนเล็กน้อยในโครงสร้างทั่วไปของโปรตีนอันเป็นผลมาจากการเปลี่ยนแปลงจุดในโครงสร้างหลักหรือสภาวะแวดล้อมสามารถนำไปสู่การเปลี่ยนแปลงในคุณสมบัติทางเคมีและการทำงานของอนุมูลที่ก่อตัวเป็นศูนย์ที่ใช้งานอยู่ ขัดขวางการผูกมัดของ โปรตีนต่อลิแกนด์และหน้าที่ของมัน ในระหว่างการทำให้เสียสภาพ ศูนย์กลางของโปรตีนจะถูกทำลาย และกิจกรรมทางชีวภาพของพวกมันจะหายไป
ศูนย์กลางแอคทีฟมักถูกสร้างขึ้นในลักษณะที่การเข้าถึงน้ำไปยังกลุ่มการทำงานของอนุมูลมีจำกัด เงื่อนไขถูกสร้างขึ้นสำหรับการผูกลิแกนด์กับอนุมูลของกรดอะมิโน
ในบางกรณี ลิแกนด์ติดอยู่กับอะตอมเพียงอะตอมเดียวที่มีปฏิกิริยาบางอย่าง เช่น การเพิ่ม O 2 เข้ากับเหล็กของไมโอโกลบินหรือเฮโมโกลบิน อย่างไรก็ตาม คุณสมบัติของอะตอมที่กำหนดในการเลือกโต้ตอบกับ O 2 นั้นพิจารณาจากคุณสมบัติของอนุมูลที่อยู่รอบอะตอมของเหล็กในองค์ประกอบของหัวข้อ Heme ยังพบได้ในโปรตีนอื่นๆ เช่น ไซโตโครม อย่างไรก็ตาม หน้าที่ของอะตอมของเหล็กในไซโตโครมนั้นแตกต่างกัน มันทำหน้าที่เป็นตัวกลางในการถ่ายโอนอิเล็กตรอนจากสารหนึ่งไปยังอีกสารหนึ่ง ในขณะที่ธาตุเหล็กจะกลายเป็นสารสองวาเลนต์หรือไตรวาเลนต์
คุณสมบัติหลักของโปรตีนที่อยู่ภายใต้หน้าที่ของพวกมันคือการคัดเลือกของการติดลิแกนด์จำเพาะกับบางส่วนของโมเลกุลโปรตีน
2. ลิแกนด์ที่หลากหลาย
ลิแกนด์อาจเป็นสารอนินทรีย์ (มักเป็นไอออนของโลหะ) และสารอินทรีย์ น้ำหนักโมเลกุลต่ำ และสารที่มีน้ำหนักโมเลกุลสูง
มีลิแกนด์ที่เปลี่ยนโครงสร้างทางเคมีเมื่อยึดติดกับศูนย์กลางของโปรตีน (การเปลี่ยนแปลงของสารตั้งต้นในศูนย์กลางการทำงานของเอนไซม์)
มีลิแกนด์ที่เกาะติดกับโปรตีนในขณะทำงานเท่านั้น (เช่น O 2 ขนส่งโดยเฮโมโกลบิน) และลิแกนด์ที่เกี่ยวข้องกับโปรตีนอย่างต่อเนื่องและมีบทบาทสำคัญในการทำงานของโปรตีน (เช่น เหล็ก ซึ่งเป็นส่วนหนึ่งของเฮโมโกลบิน)
ในกรณีเหล่านั้นเมื่อกรดอะมิโนที่ตกค้างซึ่งก่อตัวเป็นศูนย์ออกฤทธิ์ไม่สามารถรับประกันการทำงานของโปรตีนนี้ โมเลกุลที่ไม่ใช่โปรตีนสามารถเกาะติดกับบางส่วนของศูนย์ออกฤทธิ์ได้ ดังนั้นในศูนย์กลางของเอนไซม์จำนวนมากจึงมีไอออนของโลหะ (โคแฟคเตอร์) หรือโมเลกุลที่ไม่ใช่โปรตีนอินทรีย์ (โคเอ็นไซม์) ส่วนที่ไม่ใช่โปรตีนซึ่งมีความเกี่ยวข้องอย่างยิ่งกับตำแหน่งแอคทีฟของโปรตีนและจำเป็นต่อการทำงานของมัน เรียกว่า "กลุ่มต่อมลูกหมาก" Myoglobin, hemoglobin และ cytochromes มีกลุ่มเทียมในศูนย์ที่ใช้งานอยู่ - heme ที่มีธาตุเหล็ก
การเชื่อมต่อของโปรโตเมอร์ในโปรตีนโอลิโกเมอร์เป็นตัวอย่างของการทำงานร่วมกันของลิแกนด์ที่มีน้ำหนักโมเลกุลสูง protomer แต่ละตัวที่เชื่อมต่อกับ protomers อื่น ๆ ทำหน้าที่เป็นแกนด์สำหรับพวกเขาเช่นเดียวกับที่เป็นอยู่
บางครั้งการเติมลิแกนด์เข้าไปเปลี่ยนโครงสร้างของโปรตีน ส่งผลให้เกิดการเกาะจับกับลิแกนด์อื่นๆ ตัวอย่างเช่น โปรตีน Calodulin หลังจากจับกับไอออน Ca 2+ สี่ตัวในพื้นที่เฉพาะ ได้รับความสามารถในการโต้ตอบกับเอนไซม์บางชนิด ทำให้กิจกรรมของพวกมันเปลี่ยนไป
8. โครงสร้างควอเทอร์นารีของโปรตีน คุณสมบัติของโครงสร้างและการทำงานของโปรตีนโอลิโกเมอร์ในตัวอย่างของเฮโมโกลบิน การเปลี่ยนแปลงแบบมีส่วนร่วมในรูปแบบโปรโตเมอร์ ความเป็นไปได้ของการควบคุมการทำงานทางชีวภาพของโปรตีนโอลิโกเมอร์โดยลิแกนด์อัลโลสเตอริก
ภายใต้โครงสร้างควอเทอร์นารีหมายถึงวิธีการวางสายโซ่โพลีเปปไทด์แต่ละตัวในช่องว่างที่มีโครงสร้างหลัก รองหรือตติยรีเดียวกัน (หรือต่างกัน) และการก่อตัวของการก่อรูปโมเลกุลขนาดใหญ่ในลักษณะโครงสร้างและการทำงาน โปรตีนที่ใช้งานได้หลายอย่างประกอบด้วยสายพอลิเปปไทด์หลายสายที่เชื่อมต่อกันไม่ใช่ด้วยพันธะโควาเลนต์ แต่โดยพันธะที่ไม่ใช่โควาเลนต์ (คล้ายกับพันธะที่ให้ความเสถียรกับโครงสร้างตติยภูมิ) แต่ละสายโซ่โพลีเปปไทด์ที่เรียกว่าโปรโตเมอร์ โมโนเมอร์ หรือหน่วยย่อย ส่วนใหญ่มักไม่มีฤทธิ์ทางชีวภาพ โปรตีนได้รับความสามารถนี้ด้วยวิธีบางอย่างของการเชื่อมโยงเชิงพื้นที่ของโปรโตเมอร์ที่เป็นส่วนประกอบ นั่นคือ มีคุณสมบัติใหม่ที่ไม่มีลักษณะเฉพาะของโปรตีนโมโนเมอร์ โมเลกุลที่เป็นผลลัพธ์มักเรียกว่าโอลิโกเมอร์ (หรือมัลติเมอร์) โปรตีนโอลิโกเมอร์มักถูกสร้างขึ้นจากโปรโตเมอร์จำนวนเท่ากัน (ตั้งแต่ 2 ถึง 4 ไม่ค่อยมีตั้งแต่ 6 ถึง 8) โดยมีน้ำหนักโมเลกุลเท่ากันหรือต่างกัน - จากหลายพันถึงหลายแสน โดยเฉพาะอย่างยิ่ง โมเลกุลเฮโมโกลบินประกอบด้วยสาย α- ที่เหมือนกันสองสายและสาย β-โพลีเปปไทด์สองสาย กล่าวคือ เป็นเตตระเมอร์
การเปลี่ยนแปลงแบบมีส่วนร่วมในรูปแบบโปรโตเมอร์
การเปลี่ยนแปลงโครงสร้างและด้วยเหตุนี้ในคุณสมบัติเชิงหน้าที่ของโปรโตเมอร์ทั้งหมดของโปรตีนโอลิโกเมอริกเมื่อลิแกนด์ติดอยู่กับลิแกนด์เพียงตัวเดียวจึงเรียกว่าการเปลี่ยนแปลงร่วมกันในโครงสร้างของโปรโตเมอร์
ระเบียบ Allosteric . เอ็นไซม์เปลี่ยนแปลงกิจกรรมผ่านเอฟเฟกเตอร์ที่ไม่สัมพันธ์กับโควาเลนต์ การผูกมัดเกิดขึ้นในพื้นที่ ห่างไกลจากไซต์ที่ทำงานอยู่ (ตัวเร่งปฏิกิริยา) การจับนี้ทำให้เกิดการเปลี่ยนแปลงโครงสร้างในโมเลกุลโปรตีน นำไปสู่การเปลี่ยนแปลงในเรขาคณิตจำเพาะของไซต์ตัวเร่งปฏิกิริยา กิจกรรมสามารถเพิ่มขึ้น - นี่คือการเปิดใช้งานของเอนไซม์หรือลดลง - นี่คือการยับยั้ง "ข้อความ" เกี่ยวกับสิ่งที่แนบมาของตัวกระตุ้น allosteric จะถูกส่งผ่านการเปลี่ยนแปลงโครงสร้างไปยังหน่วยย่อยของตัวเร่งปฏิกิริยาซึ่งกลายเป็นส่วนประกอบเสริมของสารตั้งต้นและเอนไซม์จะถูก "เปลี่ยน" บน". เมื่อตัวกระตุ้นถูกกำจัดออกไป เอ็นไซม์จะกลับเข้าสู่สภาพที่ไม่ใช้งานอีกครั้งและ "ดับ" การควบคุม Allosteric เป็นโหมดหลักของการควบคุมเส้นทางการเผาผลาญ
เคมีชีวภาพ Leleevich Vladimir Valeryanovich
การทำงานของโปรตีน
การทำงานของโปรตีน
โปรตีนแต่ละชนิดซึ่งมีโครงสร้างและรูปแบบปฐมภูมิที่มีลักษณะเฉพาะ มีฟังก์ชันเฉพาะที่แยกความแตกต่างจากโปรตีนอื่นๆ ทั้งหมด ชุดของโปรตีนแต่ละตัวทำหน้าที่ที่หลากหลายและซับซ้อนมากมายในเซลล์
เงื่อนไขที่จำเป็นสำหรับการทำงานของโปรตีนคือการเติมสารอื่นเข้าไปซึ่งเรียกว่าแกนด์ ลิแกนด์สามารถเป็นได้ทั้งสารโมเลกุลต่ำและโมเลกุลขนาดใหญ่ อันตรกิริยาของโปรตีนกับลิแกนด์มีความเฉพาะเจาะจงสูง ซึ่งถูกกำหนดโดยโครงสร้างของบริเวณโปรตีนที่เรียกว่าตำแหน่งจับโปรตีน-ลิแกนด์หรือตำแหน่งออกฤทธิ์
ศูนย์กลางของโปรตีนที่แอคทีฟและความสามารถในการจับกับลิแกนด์
ศูนย์กลางของโปรตีนที่ใช้งานอยู่คือบริเวณเฉพาะของโมเลกุลโปรตีน ซึ่งมักจะอยู่ในช่องของมัน ซึ่งเกิดจากอนุมูลของกรดอะมิโนที่ประกอบกันในพื้นที่เชิงพื้นที่ระหว่างการก่อตัวของโครงสร้างระดับตติยภูมิและสามารถจับเสริมกับลิแกนด์ได้ ในลำดับเชิงเส้นของสายพอลิเปปไทด์ อนุมูลที่ก่อตัวศูนย์กลางที่แอคทีฟสามารถกำหนดตำแหน่งที่ระยะห่างจากกันพอสมควร
ความจำเพาะสูงของการจับโปรตีนกับลิแกนด์นั้นมาจากการเสริมกันของโครงสร้างของศูนย์กลางแอคทีฟของโปรตีนและโครงสร้างของลิแกนด์
การเติมเต็มเป็นที่เข้าใจกันว่าเป็นการสอดคล้องกันเชิงพื้นที่และทางเคมีของโมเลกุลที่มีปฏิสัมพันธ์ ลิแกนด์จะต้องสามารถเข้าได้และสอดคล้องกับโครงสร้างของแอคทีฟไซต์ การจับคู่นี้อาจไม่สมบูรณ์ แต่เนื่องจากความสามารถในการกำหนดโครงสร้างของโปรตีน ตำแหน่งแอคทีฟสามารถเปลี่ยนแปลงเล็กน้อยและ "พอดี" กับลิแกนด์ นอกจากนี้ ระหว่างกลุ่มหน้าที่ของลิแกนด์กับอนุมูลของกรดอะมิโนที่ก่อตัวเป็นศูนย์แอคทีฟ ควรมีพันธะที่ยึดลิแกนด์ไว้ที่ศูนย์กลางแอคทีฟ พันธะระหว่างลิแกนด์และศูนย์กลางแอคทีฟของโปรตีนอาจเป็นแบบไม่มีโควาเลนต์ (ไอออนิก ไฮโดรเจน ไม่ชอบน้ำ) หรือโควาเลนต์ก็ได้
ลักษณะของศูนย์ที่ใช้งาน
ศูนย์กลางที่ทำงานอยู่ของโปรตีนคือตำแหน่งที่ค่อนข้างแยกได้จากสภาพแวดล้อมรอบ ๆ โปรตีน ซึ่งก่อตัวขึ้นจากกากกรดอะมิโน ในบริเวณนี้ สารตกค้างแต่ละส่วน เนื่องมาจากขนาดและกลุ่มหน้าที่ของมัน ก่อให้เกิด "การบรรเทา" ของศูนย์ที่ใช้งานอยู่
คุณสมบัติเฉพาะของศูนย์แอคทีฟไม่เพียงขึ้นอยู่กับคุณสมบัติทางเคมีของกรดอะมิโนที่ก่อตัวเท่านั้น แต่ยังขึ้นกับการวางแนวร่วมกันที่แน่นอนในอวกาศด้วย ดังนั้นแม้การรบกวนเล็กน้อยในโครงสร้างทั่วไปของโปรตีนอันเป็นผลมาจากการเปลี่ยนแปลงจุดในโครงสร้างหลักหรือสภาวะแวดล้อมสามารถนำไปสู่การเปลี่ยนแปลงในคุณสมบัติทางเคมีและการทำงานของอนุมูลที่ก่อตัวเป็นศูนย์ที่ใช้งานอยู่ ขัดขวางการผูกมัดของ โปรตีนต่อลิแกนด์และหน้าที่ของมัน ในระหว่างการทำให้เสียสภาพ ศูนย์กลางของโปรตีนจะถูกทำลาย และกิจกรรมทางชีวภาพของพวกมันจะหายไป
ศูนย์กลางแอคทีฟมักถูกสร้างขึ้นในลักษณะที่การเข้าถึงน้ำไปยังกลุ่มการทำงานของอนุมูลมีจำกัด เงื่อนไขถูกสร้างขึ้นสำหรับการผูกลิแกนด์กับอนุมูลของกรดอะมิโน
ตำแหน่งการจับของโปรตีนกับลิแกนด์มักตั้งอยู่ระหว่างโดเมน ตัวอย่างเช่น เอนไซม์โพรทีโอไลติก ทริปซิน ซึ่งเกี่ยวข้องกับการไฮโดรไลซิสของพันธะเปปไทด์ของโปรตีนในอาหารในลำไส้ มี 2 โดเมนคั่นด้วยร่อง พื้นผิวด้านในของร่องเกิดขึ้นจากอนุมูลของกรดอะมิโนของโดเมนเหล่านี้ ซึ่งอยู่ไกลกันในสายโซ่โพลีเปปไทด์ (Ser177, His40, Asp85)
โดเมนที่ต่างกันในโปรตีนสามารถเคลื่อนที่สัมพันธ์กันเมื่อมีปฏิสัมพันธ์กับลิแกนด์ ซึ่งเอื้อต่อการทำงานเพิ่มเติมของโปรตีน คุณสมบัติหลักของโปรตีนที่อยู่ภายใต้หน้าที่ของพวกมันคือการคัดเลือกของการยึดติดของลิแกนด์จำเพาะกับบางส่วนของโมเลกุลโปรตีน
แกนด์ที่หลากหลาย:
1. ลิแกนด์สามารถเป็นสารอนินทรีย์ (มักเป็นไอออนของโลหะ) และสารอินทรีย์ที่มีน้ำหนักโมเลกุลต่ำและสารที่มีน้ำหนักโมเลกุลสูง
2. มีลิแกนด์ที่เปลี่ยนโครงสร้างทางเคมีเมื่อยึดติดกับศูนย์กลางของโปรตีน (การเปลี่ยนแปลงของสารตั้งต้นในศูนย์กลางการทำงานของเอนไซม์)
3. มีลิแกนด์ที่เกาะติดกับโปรตีนในขณะทำงานเท่านั้น (เช่น O 2 ขนส่งโดยเฮโมโกลบิน) และลิแกนด์ที่สัมพันธ์กับโปรตีนอย่างถาวรและมีบทบาทสำคัญในการทำงานของโปรตีน (เช่น ธาตุเหล็กซึ่งเป็นส่วนหนึ่งของเฮโมโกลบิน)
จากหนังสือ เพาะพันธุ์สุนัข ผู้เขียน Kovalenko Elena Evgenievnaการทำงานของระบบสืบพันธุ์ กิจกรรมของระบบสืบพันธุ์ถูกควบคุมโดยฮอร์โมน - สารที่มีลักษณะเป็นโปรตีนที่มีฤทธิ์ทางชีวภาพสูงและการเลือกปฏิบัติ เป็นคุณสมบัติของฮอร์โมนที่ให้การสื่อสารทางอารมณ์ระหว่างอวัยวะ
จากหนังสือ อายุ กายวิภาคศาสตร์และสรีรวิทยา ผู้เขียน Antonova Olga Alexandrovna4.5. โครงสร้างและการทำงานของไขสันหลัง ไขสันหลังเป็นสายยาว (ในผู้ใหญ่) ยาวประมาณ 45 ซม. ที่ด้านบนจะผ่านเข้าไปในไขกระดูกที่ด้านล่าง (ในบริเวณกระดูกสันหลังส่วนเอว I-II) ไขสันหลังจะแคบลงและมีรูปร่างเป็นกรวย
จากหนังสือชีววิทยา [คู่มือเตรียมสอบฉบับสมบูรณ์] ผู้เขียน Lerner Georgy Isaakovich4.6. โครงสร้างและการทำงานของสมอง
จากหนังสือ The Missing Link ผู้เขียน Edie Maitland จากหนังสือ Conversations about Life ผู้เขียน Galaktionov Stanislav Gennadievichต้นไม้ครอบครัว (หลักฐานโปรตีน) ต้นไม้ครอบครัว (หลักฐานโปรตีน) ความแตกต่างในโปรตีนของทั้งสองชนิดสะท้อนถึงการเปลี่ยนแปลงทางวิวัฒนาการในสายพันธุ์เหล่านี้หลังจากแยกออกจากบรรพบุรุษร่วมกัน จากการวิเคราะห์พบว่า ระหว่างอัลบูมินในเลือดของลิงชิมแปนซี
จากหนังสือ Evolution [แนวคิดคลาสสิกในแง่ของการค้นพบใหม่] ผู้เขียนบทที่ 2 โครงสร้างระดับโมเลกุลของโปรตีน อย่าปิดบัง: เมื่ออ่านบทแรกจบแล้ว ผู้เขียน (และผู้อ่านอาจเป็นผู้อ่าน) ก็รู้สึกโล่งใจ ท้ายที่สุดแล้วจุดประสงค์ของมันคือเพื่อให้ผู้อ่านได้รับข้อมูลที่จำเป็นในการทำความเข้าใจบทต่อไปนี้เท่านั้น
จากหนังสือวิวัฒนาการของมนุษย์ เล่ม 1 ลิง กระดูก และยีน ผู้เขียน Markov Alexander Vladimirovichจักรวาลของโปรตีนโบราณยังคงขยายตัวต่อไป ในปี 2010 Nature ได้ตีพิมพ์บทความที่น่าสนใจเกี่ยวกับการเคลื่อนไหวเชิงวิวัฒนาการของโปรตีนทั่วภูมิประเทศฟิตเนส (Povolotskaya และ Kondrashov, 2010) ผู้เขียนงานตัดสินใจเปรียบเทียบลำดับกรดอะมิโนของโปรตีนโบราณ 572 ชนิด
จากหนังสือ เคมีชีวภาพ ผู้เขียน เลเลวิช วลาดีมีร์ วาเลรียาโนวิชการเปลี่ยนแปลงของโปรตีน ส่วนต่างๆ ของจีโนมที่รหัสสำหรับโปรตีนมีการเปลี่ยนแปลงเล็กน้อยอย่างน่าประหลาดใจ ความแตกต่างในลำดับกรดอะมิโนของโปรตีนในมนุษย์และชิมแปนซีมีค่าน้อยกว่า 1% อย่างมีนัยสำคัญ และจากความแตกต่างเพียงเล็กน้อยเหล่านี้ ส่วนใหญ่ไม่มี
จากหนังสือของผู้เขียนบทที่ 2 โครงสร้างและหน้าที่ของโปรตีน โปรตีน เป็นสารประกอบอินทรีย์ที่มีไนโตรเจนโมเลกุลสูงประกอบด้วยกรดอะมิโนที่เชื่อมต่อเป็นสายพอลิเปปไทด์โดยใช้พันธะเปปไทด์และมีโครงสร้างที่ซับซ้อน ประวัติการศึกษาโปรตีน พ.ศ. 2271
จากหนังสือของผู้เขียนระดับของการจัดระเบียบโครงสร้างของโปรตีน โครงสร้างหลักคือ ลำดับเชิงเส้นของกรดอะมิโนที่กำหนดไว้อย่างเคร่งครัดในสายโซ่พอลิเปปไทด์ หลักการเชิงกลยุทธ์สำหรับการศึกษาโครงสร้างหลักของโปรตีนได้ผ่านการเปลี่ยนแปลงที่สำคัญเมื่อพัฒนาและ
จากหนังสือของผู้เขียนการเปลี่ยนแปลงหลังการแปลโปรตีน โปรตีนจำนวนมากถูกสังเคราะห์ในรูปแบบที่ไม่ใช้งาน (สารตั้งต้น) และหลังจากการรวมตัวกับไรโบโซม ได้รับการดัดแปลงโครงสร้างหลังการสังเคราะห์ การเปลี่ยนแปลงโครงสร้างและโครงสร้างเหล่านี้ในสายโซ่โพลีเปปไทด์
จากหนังสือของผู้เขียนบทที่ 23 สถานะไดนามิกของโปรตีนในร่างกาย ความสำคัญของกรดอะมิโนสำหรับร่างกายส่วนใหญ่อยู่ในความจริงที่ว่าพวกมันถูกใช้สำหรับการสังเคราะห์โปรตีนเมแทบอลิซึมซึ่งตรงบริเวณที่พิเศษในกระบวนการเมแทบอลิซึมระหว่างร่างกายและ
จากหนังสือของผู้เขียนการย่อยโปรตีนในทางเดินอาหาร การย่อยโปรตีนเริ่มต้นในกระเพาะอาหารภายใต้การกระทำของเอนไซม์ในน้ำย่อย ปล่อยมากถึง 2.5 ลิตรต่อวันและแตกต่างจากน้ำย่อยอื่น ๆ ในปฏิกิริยาที่เป็นกรดอย่างรุนแรงเนื่องจากการมีอยู่
จากหนังสือของผู้เขียนความแตกแยกของโปรตีนในเนื้อเยื่อ มันดำเนินการด้วยความช่วยเหลือของเอนไซม์ cathepsins proteolytic lysosomal ตามโครงสร้างของศูนย์ที่ใช้งาน cysteine, serine, carboxyl และ metalloprotein cathepsins มีความโดดเด่น บทบาทของ cathepsins: 1. การสร้างฤทธิ์ทางชีวภาพ
จากหนังสือของผู้เขียนบทบาทของตับในการเผาผลาญกรดอะมิโนและโปรตีน ตับมีบทบาทสำคัญในการเผาผลาญโปรตีนและสารประกอบที่มีไนโตรเจนอื่นๆ มันทำหน้าที่ดังต่อไปนี้: 1. การสังเคราะห์โปรตีนในพลาสมาจำเพาะ: - สังเคราะห์ในตับ: อัลบูมิน 100%, 75 - 90% ?-โกลบูลิน, 50%
จากหนังสือของผู้เขียนการกำหนดลักษณะของโปรตีนในเลือด โปรตีนของระบบเสริม - ระบบนี้ประกอบด้วยโปรตีน 20 ชนิดที่หมุนเวียนในเลือดในรูปแบบของสารตั้งต้นที่ไม่ใช้งาน การกระตุ้นเกิดขึ้นภายใต้การกระทำของสารเฉพาะที่มีฤทธิ์สลายโปรตีน
1 ในเคมีอนินทรีย์
o 1.1 การตั้งชื่อแกนด์
o 1.2 ลักษณะของลิแกนด์
§ 1.2.1 โครงสร้างอิเล็กทรอนิกส์
§ 1.2.2 ทันตกรรม
§ 1.2.3 วิธีการประสานงาน
2 หมายเหตุ
ในเคมีอนินทรีย์
ส่วนใหญ่แล้วการผูกมัดดังกล่าวเกิดขึ้นกับการก่อตัวของพันธะผู้บริจาคและผู้รับ "การประสานงาน" ที่เรียกว่า "การประสานงาน" โดยที่แกนด์ทำหน้าที่เป็นฐานของลูอิสนั่นคือพวกเขาเป็นผู้บริจาคคู่อิเล็กตรอน เมื่อลิแกนด์ติดอยู่กับอะตอมกลาง คุณสมบัติทางเคมีของสารก่อให้เกิดสารเชิงซ้อนและลิแกนด์เองมักจะมีการเปลี่ยนแปลงที่สำคัญ
ระบบการตั้งชื่อลิแกนด์[แก้ไข | แก้ไขข้อความวิกิ]
1. ตัวแรกในชื่อของสารประกอบในกรณีของประโยคคือประจุลบและในสัมพันธการก - ไอออนบวก
2. ในชื่อของไอออนเชิงซ้อน ลิแกนด์จะเรียงตามลำดับตัวอักษรก่อน ตามด้วยอะตอมกลาง
3. อะตอมกลางในคอมเพล็กซ์ประจุบวกเป็นกลางเรียกว่าชื่อรัสเซียและในแอนไอออนรากของชื่อละตินที่มีคำต่อท้าย "at" หลังจากชื่อของอะตอมกลาง สถานะออกซิเดชันจะถูกระบุ
4. จำนวนแกนด์ที่ติดอยู่กับอะตอมกลางจะแสดงด้วยคำนำหน้า "mono", "di", "three", "tetra", "penta" เป็นต้น
ลักษณะของลิแกนด์[แก้ไข | แก้ไขข้อความวิกิ]
โครงสร้างอิเล็กทรอนิกส์[แก้ไข | แก้ไขข้อความวิกิ]
อันที่จริงลักษณะที่สำคัญที่สุดของแกนด์ซึ่งทำให้สามารถประเมินและทำนายความสามารถในการก่อตัวที่ซับซ้อนและการทำลายตนเองของ D-orbital - การทำลายของสารประกอบโดยรวม ในการประมาณค่าแรก จะรวมจำนวนของคู่อิเล็กตรอนที่ลิแกนด์สามารถจัดสรรสำหรับการสร้างพันธะประสานงานและอิเล็กโตรเนกาติวีตี้ของอะตอมที่บริจาคหรือกลุ่มฟังก์ชัน
ทันตกรรม[แก้ไข | แก้ไขข้อความวิกิ]
จำนวนตำแหน่งประสานงานของอะตอมกลาง (หรืออะตอม) ที่ถูกครอบครองโดยลิแกนด์เรียกว่า denticity (otlat. บุ๋ม บุ๋ม- - ฟัน). แกนด์ที่ครอบครองหนึ่งไซต์ประสานงานเรียกว่า โมโนทันตกรรม (เช่น นู๋ H 3) สอง - สองเดนเทท (ไอออนออกซาเลต [ อู๋-C(=O)-C(=O) -O] 2−) แกนด์ที่สามารถครอบครองได้จำนวนมากมักจะแสดงเป็น โพลีฟัน ตัวอย่างเช่น กรดเอทิลีนไดเอมีนเตตระอะซิติก (EDTA) ซึ่งสามารถครอบครองได้หกตำแหน่ง
นอกจากเนื้อฟันแล้ว ยังมีลักษณะเฉพาะที่สะท้อนถึงจำนวนอะตอมของลิแกนด์ที่เกี่ยวข้องกับตำแหน่งประสานงานหนึ่งแห่งของอะตอมกลาง ในวรรณคดีอังกฤษเขียนแทนด้วยคำว่า ความสุขและมีการกำหนดศัพท์ η พร้อมตัวยกที่สอดคล้องกัน แม้ว่าเห็นได้ชัดว่าเธอไม่มีคำศัพท์ในภาษารัสเซีย แต่ในบางแหล่งสามารถพบ "ความสุข" ของกระดาษลอกลายได้ ตัวอย่างเช่น เราสามารถให้ไซโคลเพนทาเดียนีลลิแกนด์ในสารเชิงซ้อนที่เป็นโลหะตรงกลาง ซึ่งตรงบริเวณหนึ่งตำแหน่งประสานงาน (นั่นคือ มันคือโมโนเดนเทต) และถูกผูกมัดผ่านอะตอมของคาร์บอนทั้งห้า: η 5 - - .
วิธีการประสานงาน[แก้ไข | แก้ไขข้อความวิกิ]

คีเลตคอมเพล็กซ์EDTA 4−
ลิแกนด์ที่มีเนื้อฟันมากกว่าสองซี่สามารถเกิดขึ้นได้ คีเลตคอมเพล็กซ์(กรีกχηλή - กรงเล็บ) - คอมเพล็กซ์ที่อะตอมกลางรวมอยู่ในหนึ่งรอบหรือมากกว่านั้นด้วยโมเลกุลลิแกนด์ ลิแกนด์ดังกล่าวเรียกว่า คีเลต. ตัวอย่างเช่น เราสามารถอ้างถึงเชิงซ้อนเตตระเนียนของ EDTA เดียวกัน โดยสังเกตว่าพันธะ M-O หลายตัวในนั้นสามารถเป็น ไอออนิก.
ในการก่อตัวของสารเชิงซ้อนคีเลตนั้นมักจะสังเกตได้ คีเลตเอฟเฟค- มีความเสถียรมากกว่าเมื่อเปรียบเทียบกับสารเชิงซ้อนที่คล้ายคลึงกันของลิแกนด์ที่ไม่เป็นคีเลต ทำได้โดยการป้องกันอะตอมกลางจากอิทธิพลที่มาแทนที่และผลกระทบของเอนโทรปี ตัวอย่างเช่น ค่าคงที่การแยกตัวของสารเชิงซ้อนแอมโมเนียของแคดเมียม 2+ นั้นน้อยกว่าค่าของสารเชิงซ้อนที่มีเอทิลีนไดเอมีน 2+ เกือบ 1500 เท่า เหตุผลก็คือเมื่อไอออนของแคดเมียม (II) ที่มีความชุ่มชื้นทำปฏิกิริยากับเอทิลีนไดเอมีน โมเลกุลของลิแกนด์สองตัวจะแทนที่โมเลกุลของน้ำสี่ตัว ในกรณีนี้ จำนวนอนุภาคอิสระในระบบเพิ่มขึ้นอย่างมาก และเอนโทรปีของระบบเพิ่มขึ้น (และลำดับภายในของคอมเพล็กซ์เพิ่มขึ้นตามลำดับ) นั่นคือสาเหตุของผลคีเลตคือการเพิ่มขึ้นของเอนโทรปีของระบบเมื่อแกนด์ monodentate ถูกแทนที่ด้วย polydentate และส่งผลให้พลังงานกิ๊บส์ลดลง

วงจรพอร์ไฟริน
ในบรรดาลิแกนด์ที่เป็นคีเลต เราสามารถแยกคลาสของลิแกนด์แบบแมโครไซคลิก - โมเลกุลที่มีขนาดพื้นที่ภายในไซคลิกเพียงพอที่จะรองรับอะตอมที่ก่อให้เกิดสารเชิงซ้อน ตัวอย่างของสารประกอบดังกล่าว ได้แก่ เบสพอร์ไฟริน ซึ่งเป็นพื้นฐานของสารเชิงซ้อนทางชีวเคมีที่สำคัญที่สุด เช่น เฮโมโกลบิน คลอโรฟิลล์ และแบคทีเรียโอคลอโรฟิลล์ Crown ethers, calixarenes ฯลฯ สามารถทำหน้าที่เป็นแกนด์แมโครไซคลิก
ลิแกนด์ยังสามารถเชื่อมเข้าด้วยกัน ทำให้เกิดพันธะระหว่างอะตอมกลางที่ต่างกันในสารเชิงซ้อนที่มีสองหรือหลายนิวเคลียส ลิแกนด์บริดจ์เขียนแทนด้วยตัวอักษรกรีก μ ( มิว).
ลิแกนด์
ABCDEZHZYKLMNOPRSTUFHTSCHSHCHEYUYA
ลิแกนด์(จากภาษาละติน ligo - I ผูกมัด) โมเลกุลที่เป็นกลาง ไอออน หรืออนุมูลอิสระที่เกี่ยวข้องกับจุดศูนย์กลาง อะตอมของสารประกอบเชิงซ้อน พวกเขา ม. ข. ไอออน (H - , Hal - , NO 3 - , NCS - และอื่นๆ), inorg. โมเลกุล (H 2, C n, N 2, P n, O 2, S n, CO, CO 2, NH 3, NO, SO 2, NO 2, COS, เป็นต้น), org. comp. ซึ่งมีองค์ประกอบของกลุ่มย่อยหลัก V, VI, VII gr. เป็นระยะ ระบบหรือฟังก์ชัน p-donor ลิแกนด์กลุ่มใหญ่ที่มีความสำคัญทางชีววิทยา (กรดอะมิโน, เปปไทด์, โปรตีน, พิวรีน, พอร์ไฟริน, คอร์ริน, แมคโครไลด์) และสารสังเคราะห์ของพวกมัน แอนะล็อก (อีเทอร์มงกุฎ คริปแทนด์) เช่นเดียวกับพอลิเมอร์ที่มีอะตอมผู้บริจาคและกลุ่มคีเลต ลิแกนด์สามารถเชื่อมโยงกับอะตอมกลางได้โดยพันธะ s-, p- และ d-two-center หรือ multi-center ในกรณีของการก่อตัวของพันธะสองศูนย์ในลิแกนด์ ศูนย์ผู้บริจาค (โดยปกติคืออะตอม N, O, S, Cl หรือพันธะหลายตัว) สามารถแยกได้ การเข้าเล่มแบบหลายศูนย์ดำเนินการด้วยระบบ p-aromatic ลิแกนด์ (เบนซีน ไซโคลเพนทาไดอีไนด์แอนไอออน) หรือเฮเทอโรอะโรมาติก ลิแกนด์ (pyrrole, thiophene, methylpyridines) ปริมาณที่สำคัญที่สุด คุณสมบัติของลิแกนด์ผู้บริจาค - ตัวรับ - ความหนาแน่นที่กำหนดโดยจำนวนศูนย์ผู้บริจาคของลิแกนด์ที่เกี่ยวข้องในการประสานงาน บนพื้นฐานนี้ ลิแกนด์แบ่งออกเป็น mono-, di-, ... polydentate การประสานงาน จำนวนของสารก่อให้เกิดสารเชิงซ้อนสำหรับแกนด์ monodentate เกิดขึ้นพร้อมกับจำนวนของพวกมัน สำหรับตัวอื่นๆ จะเท่ากับผลคูณของจำนวนแกนด์และความหนาแน่นของพวกมัน ธรรมชาติของแกนด์กำหนดประเภทของการประสานงาน ต่อ (aquacomplexes, amminocomplexes, acidocomplexes, mol. adducts, คีเลต, p-complexes ฯลฯ ); Saint-va โครงสร้างและปฏิกิริยาขึ้นอยู่กับมัน ความสามารถของการสื่อสารที่ซับซ้อน และความเป็นไปได้ของการปฏิบัติ แอปพลิเคชัน
ลิแกนด์เป็นส่วนประกอบสำคัญของโปรตีนที่ซับซ้อน
โปรตีนที่ซับซ้อนนอกเหนือจากสายโซ่โปรตีนแล้วยังมีกลุ่มที่ไม่ใช่โปรตีนเพิ่มเติม - ลิแกนด์(ลาดพร้าว ลิโก- ผูกมัด) นั่นคือโมเลกุลที่เกี่ยวข้องกับโปรตีน ถ้าลิแกนด์รับภาระเชิงโครงสร้างและ/หรือเชิงฟังก์ชัน เรียกว่า กลุ่มเทียม.
เป็นลิแกนด์โมเลกุลใดก็ได้
โมเลกุลที่ทำหน้าที่ในโปรตีน โครงสร้างฟังก์ชั่น - ลิปิด, คาร์โบไฮเดรต, กรดนิวคลีอิก, แร่ธาตุ, สารประกอบอินทรีย์อื่น ๆ : heme ในเฮโมโกลบิน, คาร์โบไฮเดรตในไกลโคโปรตีน, DNA และ RNA ในนิวคลีโอโปรตีน, ทองแดงในเซรูโลพลาสมิน,
· แบบพกพาโปรตีน โมเลกุล: ธาตุเหล็กในทรานเฟอร์ริน, เฮโมโกลบินในแฮปโตโกลบิน, ฮีมในเฮโมเปกซิน,
· พื้นผิวสำหรับเอนไซม์ - โมเลกุลใด ๆ และแม้แต่โปรตีนอื่น ๆ
การรับรู้ลิแกนด์ที่ให้ไว้:
· การเติมเต็มโครงสร้างของศูนย์กลางการจับโปรตีนกับโครงสร้างของลิแกนด์ กล่าวคือ การโต้ตอบเชิงพื้นที่และทางเคมีของโปรตีนและลิแกนด์ เข้าคู่กันเหมือนกุญแจไข เช่น เอนไซม์จับคู่กับซับสเตรต
บางครั้งการรับรู้อาจขึ้นอยู่กับ ปฏิกิริยาอะตอมที่ลิแกนด์ติดอยู่ ตัวอย่างเช่น การผูกมัดของออกซิเจนด้วยธาตุเหล็กของฮีโมโกลบิน หรือกรดไขมันกับอัลบูมิน
ฟังก์ชันลิแกนด์ในองค์ประกอบของโปรตีนที่ซับซ้อนนั้นมีความหลากหลาย:
· เปลี่ยนคุณสมบัติโปรตีน (ประจุ ความสามารถในการละลาย ความสามารถในการเก็บความร้อน) เช่น กรดฟอสฟอริกในฟอสโฟโปรตีนหรือโมโนแซ็กคาไรด์ตกค้างในไกลโคโปรตีน
· ปกป้องโปรตีนจากกระบวนการสลายโปรตีนภายนอกและภายในเซลล์ เช่น ส่วนคาร์โบไฮเดรตในไกลโคโปรตีน
จัดให้เป็นลิแกนด์ ขนส่งสารประกอบที่ไม่ละลายน้ำ เช่น การขนส่งไขมันโดยไลโปโปรตีน
แนบ กิจกรรมทางชีวภาพและกำหนดหน้าที่ของโปรตีน เช่น กรดนิวคลีอิกในนิวคลีโอโปรตีน เฮมในเฮโมโกลบิน คาร์โบไฮเดรตในโปรตีนรีเซพเตอร์
·ส่งผลกระทบ การเจาะเมมเบรน, การโยกย้ายภายในเซลล์ การคัดแยกและการหลั่งโปรตีน ตามกฎแล้วจะทำโดยคาร์โบไฮเดรตตกค้าง
