Ligander. Det aktive sentrum av proteinet og dets interaksjon med liganden
Modulstruktur | Temaer |
Modulær enhet 1 | 1.1. Strukturell organisering av proteiner. Stadier av dannelse av naturlig konformasjon av proteiner 1.2. Grunnleggende om proteinfunksjon. Legemidler som ligander som påvirker proteinfunksjonen 1.3. Proteindenaturering og muligheten for deres spontane renaturering |
Modulær enhet 2 | 1.4. Funksjoner av strukturen og funksjonen til oligomere proteiner på eksemplet med hemoglobin 1.5. Opprettholde den opprinnelige konformasjonen av proteiner i en celle 1.6. En rekke proteiner. Proteinfamilier på eksemplet med immunglobuliner 1.7. Fysisk-kjemiske egenskaper til proteiner og metoder for deres separasjon |
Modulær enhet 1 STRUKTURELL ORGANISERING AV MONOMERE PROTEINER OG GRUNNLAGNET FOR DERES FUNKSJON
Læringsmål Å kunne:
1. Bruke kunnskap om strukturelle trekk ved proteiner og proteinfunksjoners avhengighet av deres struktur for å forstå mekanismene for utvikling av arvelige og ervervede proteinopatier.
2. Forklar mekanismene for den terapeutiske virkningen av visse legemidler som ligander som interagerer med proteiner og endrer deres aktivitet.
3. Bruke kunnskap om strukturen og konformasjonslabiliteten til proteiner for å forstå deres strukturelle og funksjonelle ustabilitet og tendens til denaturering under skiftende forhold.
4. Forklar bruken av denatureringsmidler som middel for sterilisering av medisinsk materiale og instrumenter, samt som antiseptika.
Vet:
1. Nivåer strukturell organisering proteiner.
2. Viktigheten av den primære strukturen til proteiner, som bestemmer deres strukturelle og funksjonelle mangfold.
3. Dannelsesmekanisme i proteiner aktivt senter og dens spesifikke interaksjon med liganden, som ligger til grunn for funksjonen til proteiner.
4. Eksempler på påvirkningen av eksogene ligander (medikamenter, toksiner, giftstoffer) på konformasjonen og funksjonelle aktiviteten til proteiner.
5. Årsaker og virkninger av proteindenaturering, faktorer som forårsaker denaturering.
6. Eksempler på bruk av denaturerende faktorer i medisin som antiseptika og midler for sterilisering av medisinske instrumenter.
TEMA 1.1. STRUKTURELL ORGANISERING AV PROTEINER. STADIER SOM DANNER EN NATIVE
PROTEINKONFORMASJONER
Proteiner er polymermolekyler, hvis monomerer bare består av 20 α-aminosyrer. Settet og rekkefølgen for tilkobling av aminosyrer i et protein bestemmes av strukturen til gener i DNA til individer. Hvert protein, i samsvar med sin spesifikke struktur, utfører sin egen funksjon. Settet med proteiner til en gitt organisme bestemmer dens fenotypiske egenskaper, så vel som tilstedeværelsen av arvelige sykdommer eller en disposisjon for deres utvikling.
1. Aminosyrer som utgjør proteiner. peptidbinding. Proteiner er polymerer bygget av monomerer - 20 α-aminosyrer, generell formel hvilken
Aminosyrer er forskjellige i struktur, størrelse, fysisk-kjemiske egenskaper til radikalene knyttet til α-karbonatomet. De funksjonelle gruppene av aminosyrer bestemmer egenskapene til forskjellige α-aminosyrer. Radikalene som finnes i α-aminosyrer kan deles inn i flere grupper:
prolin, i motsetning til de andre 19 proteinmonomerene, ikke en aminosyre, men en iminosyre, er radikalet i prolin assosiert med både α-karbonatomet og iminogruppen
 Aminosyrer er forskjellige i deres løselighet i vann. Dette skyldes radikalers evne til å samhandle med vann (for å bli hydrert).
Aminosyrer er forskjellige i deres løselighet i vann. Dette skyldes radikalers evne til å samhandle med vann (for å bli hydrert).
TIL hydrofil inkluderer radikaler som inneholder anioniske, kationiske og polare uladede funksjonelle grupper.
TIL hydrofobisk inkluderer radikaler som inneholder metylgrupper, alifatiske kjeder eller sykluser.
2. Peptidbindinger knytter aminosyrer til peptider. Under syntesen av et peptid interagerer α-karboksylgruppen til en aminosyre med α-aminogruppen til en annen aminosyre for å danne peptidbinding:
Proteiner er polypeptider, dvs. lineære polymerer av α-aminosyrer forbundet med en peptidbinding (fig. 1.1.)
 Ris. 1.1. Begreper som brukes for å beskrive strukturen til peptider
Ris. 1.1. Begreper som brukes for å beskrive strukturen til peptider
Aminosyremonomerene som utgjør polypeptider kalles aminosyrerester. Kjede av gjentatte grupper - NH-CH-CO- skjemaer peptid ryggraden. En aminosyrerest som har en fri a-aminogruppe kalles N-terminal, og en som har en fri a-karboksylgruppe kalles C-terminal. Peptider skrives og leses fra N-terminalen til C-terminalen.
Peptidbindingen dannet av iminogruppen til prolin skiller seg fra andre peptidbindinger: nitrogenatomet i peptidgruppen mangler hydrogen,
i stedet er det en binding med radikalet, som et resultat er den ene siden av syklusen inkludert i peptidryggraden:
 Peptider er forskjellige i aminosyresammensetning, antall aminosyrer og rekkefølgen av aminosyrer, for eksempel er Ser-Ala-Glu-Gis og His-Glu-Ala-Ser to forskjellige peptider.
Peptider er forskjellige i aminosyresammensetning, antall aminosyrer og rekkefølgen av aminosyrer, for eksempel er Ser-Ala-Glu-Gis og His-Glu-Ala-Ser to forskjellige peptider.
Peptidbindinger er veldig sterke, og deres kjemiske ikke-enzymatiske hydrolyse krever strenge forhold: proteinet som skal analyseres hydrolyseres i konsentrert saltsyre ved en temperatur på ca. 110°C i 24 timer. I en levende celle kan peptidbindinger brytes av proteolytiske enzymer, kalt proteaser eller peptidhydrolaser.
3. Primærstruktur av proteiner. Aminosyrerester i peptidkjedene til forskjellige proteiner veksler ikke tilfeldig, men er ordnet i en bestemt rekkefølge. Den lineære sekvensen eller sekvensen av aminosyrerester i en polypeptidkjede kalles den primære strukturen til et protein.
Den primære strukturen til hvert enkelt protein er kodet i et DNA-molekyl (i en region kalt et gen) og implementeres under transkripsjon (omskriving av informasjon om mRNA) og translasjon (syntese av proteinets primære struktur). Følgelig er den primære strukturen til proteinene til en individuell person informasjon arvet fra foreldre til barn som bestemmer de strukturelle egenskapene til proteinene til en gitt organisme, som funksjonen til eksisterende proteiner avhenger av (fig. 1.2.).
 Ris. 1.2. Forholdet mellom genotypen og konformasjonen av proteiner syntetisert i kroppen til et individ
Ris. 1.2. Forholdet mellom genotypen og konformasjonen av proteiner syntetisert i kroppen til et individ
Hvert av de rundt 100 000 individuelle proteinene i menneskekroppen har unik primær struktur. Molekyler av en type protein (for eksempel albumin) har den samme vekslingen av aminosyrerester, som skiller albumin fra ethvert annet individuelt protein.
Sekvensen av aminosyrerester i peptidkjeden kan betraktes som en form for informasjonsregistrering. Denne informasjonen bestemmer den romlige foldingen av en lineær peptidkjede til en mer kompakt tredimensjonal struktur kalt konfirmasjon ekorn. Prosessen med dannelse av en funksjonelt aktiv proteinkonformasjon kalles folding.
4. Konformasjon av proteiner. Fri rotasjon i peptidryggraden er mulig mellom nitrogenatomet i peptidgruppen og det nærliggende a-karbonatomet, samt mellom a-karbonatomet og karbonylgruppens karbon. På grunn av samspillet mellom funksjonelle grupper av aminosyrerester, kan den primære strukturen til proteiner tilegne seg mer komplekse romlige strukturer. I globulære proteiner skilles to hovednivåer av folding av konformasjonen av peptidkjeder: sekundær Og tertiær struktur.
sekundær struktur proteiner- dette er en romlig struktur dannet som et resultat av dannelsen av hydrogenbindinger mellom de funksjonelle gruppene -C=O og -NH- i peptidryggraden. I dette tilfellet kan peptidkjeden skaffe seg vanlige strukturer av to typer: α-helikser Og β strukturer.
I α-helikser hydrogenbindinger dannes mellom oksygenatomet til karbonylgruppen og hydrogenet til amidnitrogenet til den fjerde aminosyren fra den; sidekjeder av aminosyrerester
plassert langs periferien av helixen, som ikke deltar i dannelsen av sekundærstrukturen (fig. 1.3.).
Voluminøse radikaler eller radikaler som bærer de samme ladningene forhindrer dannelsen av en α-helix. Prolinresten, som har en ringstruktur, avbryter α-helixen, siden det på grunn av mangel på hydrogen ved nitrogenatomet i peptidkjeden er umulig å danne en hydrogenbinding. Bindingen mellom nitrogen og α-karbonatomet er en del av prolinsyklusen, så peptidryggraden får en bøy på dette stedet.
β-struktur dannes mellom de lineære områdene av peptidryggraden i én polypeptidkjede, og danner således foldede strukturer. Polypeptidkjeder eller deler derav kan dannes parallell eller antiparallelle β-strukturer. I det første tilfellet faller N- og C-terminalene til de interagerende peptidkjedene sammen, og i det andre tilfellet har de motsatt retning (fig. 1.4).
Ris. 1.3. Protein sekundær struktur - α-helix
 Ris. 1.4. Parallelle og antiparallelle β-plisserte strukturer
Ris. 1.4. Parallelle og antiparallelle β-plisserte strukturer
β-strukturer er indikert med brede piler: A - Antiparallell β-struktur. B - Parallelle β-foldede strukturer
I noen proteiner kan β-strukturer dannes på grunn av dannelsen av hydrogenbindinger mellom atomene i peptidryggraden til forskjellige polypeptidkjeder.
Finnes også i proteiner områder med uregelmessig sekundær struktur, som inkluderer bøyninger, løkker, vendinger av polypeptidryggraden. De er ofte lokalisert på steder hvor retningen til peptidkjeden endres, for eksempel under dannelsen av en parallell β-arkstruktur.
Ved tilstedeværelse av α-helikser og β-strukturer kan kuleproteiner deles inn i fire kategorier.
Ris. 1.5. Sekundær struktur av myoglobin (A) og hemoglobin β-kjede (B), som inneholder åtte α-helikser
 Ris. 1.6. Sekundær struktur av triosefosfatisomerase og pyruvatkinasedomene
Ris. 1.6. Sekundær struktur av triosefosfatisomerase og pyruvatkinasedomene
 Ris. 1.7. Sekundær struktur av immunoglobulin konstant domene (A) og superoksiddismutase enzym (B)
Ris. 1.7. Sekundær struktur av immunoglobulin konstant domene (A) og superoksiddismutase enzym (B)
I fjerde kategori inkludert proteiner som har en liten mengde vanlige sekundære strukturer i sammensetningen. Disse proteinene inkluderer små, cysteinrike proteiner eller metalloproteiner.
Tertiær struktur av et protein- en type konformasjon dannet på grunn av interaksjoner mellom aminosyreradikaler, som kan være lokalisert i betydelig avstand fra hverandre i peptidkjeden. I dette tilfellet danner de fleste proteiner en romlig struktur som ligner en kule (globulære proteiner).
Siden hydrofobe radikaler av aminosyrer har en tendens til å kombinere med hjelp av den såkalte hydrofobe interaksjoner og intermolekylære van der Waals-krefter, dannes en tett hydrofob kjerne inne i proteinkulen. Hydrofile ioniserte og ikke-ioniserte radikaler er hovedsakelig lokalisert på overflaten av proteinet og bestemmer dets løselighet i vann.
 Ris. 1.8. Typer bindinger som oppstår mellom aminosyreradikaler under dannelsen av den tertiære strukturen til et protein
Ris. 1.8. Typer bindinger som oppstår mellom aminosyreradikaler under dannelsen av den tertiære strukturen til et protein
1 - ionisk binding- forekommer mellom positivt og negativt ladede funksjonelle grupper;
2 - Hydrogenbinding- oppstår mellom den hydrofile uladede og enhver annen hydrofil gruppe;
3 - hydrofobe interaksjoner- oppstår mellom hydrofobe radikaler;
4 - disulfidbinding- dannes på grunn av oksidasjon av SH-grupper av cysteinrester og deres interaksjon med hverandre
Hydrofile aminosyrerester inne i den hydrofobe kjernen kan samhandle med hverandre ved hjelp av ionisk Og hydrogenbindinger(Fig. 1.8).
Ione- og hydrogenbindinger, så vel som hydrofobe interaksjoner, er blant de svake: deres energi overstiger litt energien til den termiske bevegelsen til molekyler ved romtemperatur. Proteinkonformasjon opprettholdes av forekomsten av mange slike svake bindinger. Siden atomene som utgjør proteinet er i konstant bevegelse, er det mulig å bryte noen svake bindinger og danne andre, noe som fører til små bevegelser av individuelle deler av polypeptidkjeden. Denne egenskapen til proteiner til å endre konformasjon som et resultat av å bryte noen og danne andre svake bindinger kalles konformasjonslabilitet.
Menneskekroppen har systemer som støtter homeostase- konstansen til det indre miljøet innenfor visse grenser som er akseptable for en sunn organisme. Under forhold med homeostase forstyrrer ikke små endringer i konformasjonen den generelle strukturen og funksjonen til proteiner. Den funksjonelt aktive konformasjonen til et protein kalles innfødt konformasjon. En endring i det indre miljøet (for eksempel konsentrasjonen av glukose, Ca-ioner, protoner, etc.) fører til en endring i konformasjonen og forstyrrelse av funksjonene til proteiner.
Den tertiære strukturen til noen proteiner er stabilisert disulfidbindinger, dannet ved interaksjon av -SH-grupper på to rester
 Ris. 1.9. Dannelsen av en disulfidbinding i et proteinmolekyl
Ris. 1.9. Dannelsen av en disulfidbinding i et proteinmolekyl
cystein (fig. 1.9). De fleste intracellulære proteiner har ikke kovalente disulfidbindinger i deres tertiære struktur. Deres tilstedeværelse er karakteristisk for proteiner som skilles ut av cellen, noe som sikrer deres større stabilitet under ekstracellulære forhold. Så disulfidbindinger er tilstede i molekylene til insulin og immunglobuliner.
Insulin- et proteinhormon som syntetiseres i β-cellene i bukspyttkjertelen og skilles ut i blodet som svar på en økning i konsentrasjonen av glukose i blodet. I strukturen til insulin er det to disulfidbindinger som forbinder polypeptid A- og B-kjedene, og en disulfidbinding inne i A-kjeden (fig. 1.10).
 Ris. 1.10. Disulfidbindinger i strukturen til insulin
Ris. 1.10. Disulfidbindinger i strukturen til insulin
5. Supersekundær struktur av proteiner. I proteiner forskjellige i primær struktur og funksjoner, noen ganger lignende kombinasjoner og interposisjon av sekundære strukturer, som kalles den supersekundære strukturen. Det inntar en mellomposisjon mellom sekundære og tertiære strukturer, siden det er en spesifikk kombinasjon av sekundære strukturelementer under dannelsen av den tertiære strukturen til et protein. Supersekundære strukturer har spesifikke navn som "α-helix-turn-a-helix", "leucinglidelås", "sinkfingre" osv. Slike supersekundære strukturer er karakteristiske for DNA-bindende proteiner.
"Leucin glidelås". Denne typen supersekundær struktur brukes til å koble sammen to proteiner. På overflaten av interagerende proteiner er det a-heliske områder som inneholder minst fire leucinrester. Leucinrester i α-helixen er plassert seks aminosyrer fra hverandre. Siden hver sving av α-helixen inneholder 3,6 aminosyrerester, finnes leucinradikaler på overflaten av annenhver omgang. Leucinrestene til α-helixen til ett protein kan interagere med leucinrestene til et annet protein (hydrofobe interaksjoner), og koble dem sammen (Fig. 1.11.). Mange DNA-bindende proteiner fungerer som en del av oligomere komplekser, hvor individuelle underenheter er koblet til hverandre med "leucinglidelåser".
 Ris. 1.11. "Leucin glidelås" mellom α-heliske områder av to proteiner
Ris. 1.11. "Leucin glidelås" mellom α-heliske områder av to proteiner
Histoner er et eksempel på slike proteiner. Histoner- kjernefysiske proteiner, som inkluderer et stort nummer av positivt ladede aminosyrer - arginin og lysin (opptil 80%). Histonmolekyler kombineres til oligomere komplekser som inneholder åtte monomerer ved hjelp av "leucinfester", til tross for den betydelige homonyme ladningen til disse molekylene.
"Sinkfinger"- en variant av den supersekundære strukturen, karakteristisk for DNA-bindende proteiner, har form av et forlenget fragment på overflaten av proteinet og inneholder ca. 20 aminosyrerester (fig. 1.12). Formen på den "strakte fingeren" støttes av et sinkatom assosiert med fire aminosyreradikaler - to cysteinrester og to histidinrester. I noen tilfeller, i stedet for histidinrester, er det cysteinrester. De to tettliggende cysteinrestene er atskilt fra de to andre Gisili-restene med en Cys-sekvens på omtrent 12 aminosyrerester. Denne regionen av proteinet danner en α-helix, hvis radikaler spesifikt kan binde seg til de regulatoriske områdene i DNA-hovedsporet. Spesifisiteten til bindingen til et individ
 Ris. 1.12. Den primære strukturen til en del av DNA-bindende proteiner som danner "sinkfinger"-strukturen (bokstaver indikerer aminosyrene som utgjør denne strukturen)
Ris. 1.12. Den primære strukturen til en del av DNA-bindende proteiner som danner "sinkfinger"-strukturen (bokstaver indikerer aminosyrene som utgjør denne strukturen)
regulatorisk DNA-bindende protein avhenger av sekvensen av aminosyrerester lokalisert i "sinkfingeren". Slike strukturer inneholder spesielt reseptorer for steroidhormoner involvert i reguleringen av transkripsjon (leser informasjon fra DNA til RNA).
TEMA 1.2. BASIS FOR PROTEINFUNKSJON. DRUGS SOM LIGANDER SOM PÅVIRKER PROTEINFUNKSJON
1. Proteinets aktive senter og dets interaksjon med liganden. Under dannelsen av den tertiære strukturen, på overflaten av et funksjonelt aktivt protein, vanligvis i en fordypning, dannes et sted dannet av aminosyreradikaler som er langt fra hverandre i primærstrukturen. Dette stedet, som har en unik struktur for et gitt protein og er i stand til å interagere spesifikt med et bestemt molekyl eller en gruppe av lignende molekyler, kalles proteinbindingsstedet med en ligand eller aktivt sete. Ligander er molekyler som interagerer med proteiner.
Høy spesifisitet Interaksjonen mellom proteinet og liganden er sikret ved komplementariteten til strukturen til det aktive senteret med strukturen til liganden.
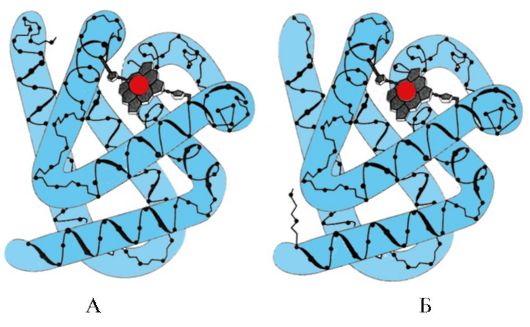
komplementaritet er den romlige og kjemiske korrespondansen til de samvirkende overflatene. Det aktive senteret må ikke bare romlig tilsvare liganden som er inkludert i det, men bindinger (ioniske, hydrogen- og hydrofobe interaksjoner) må også dannes mellom de funksjonelle gruppene til radikalene inkludert i det aktive senteret og liganden, som holder liganden inne i det aktive senteret (fig. 1.13).
 Ris. 1.13. Komplementær interaksjon av et protein med en ligand
Ris. 1.13. Komplementær interaksjon av et protein med en ligand
Noen ligander, når de er festet til det aktive sentrum av et protein, spiller en hjelperolle i funksjonen til proteiner. Slike ligander kalles kofaktorer, og proteiner som har en ikke-proteindel i sammensetningen kalles komplekse proteiner(i motsetning til enkle proteiner, bestående kun av proteindelen). Den ikke-proteindelen som er godt festet til proteinet kalles protesegruppe. For eksempel inneholder sammensetningen av myoglobin, hemoglobin og cytokromer en protesegruppe som er godt festet til det aktive senteret - en heme som inneholder et jernion. Komplekse proteiner som inneholder hem kalles hemoproteiner.
Når spesifikke ligander festes til proteiner, manifesteres funksjonen til disse proteinene. Albumin, det viktigste proteinet i blodplasma, viser altså sin transportfunksjon ved å feste hydrofobe ligander til det aktive senteret, som f.eks. fettsyre, bilirubin, noen medikamenter osv. (Fig. 1.14)
Ligander som interagerer med den tredimensjonale strukturen til peptidkjeden kan ikke bare være organiske og uorganiske molekyler med lav molekylvekt, men også makromolekyler:
DNA (eksempler diskutert ovenfor med DNA-bindende proteiner);
polysakkarider;
 Ris. 1.14. Forholdet mellom genotype og fenotype
Ris. 1.14. Forholdet mellom genotype og fenotype
Den unike primærstrukturen til humane proteiner, kodet i DNA-molekylet, realiseres i celler i form av en unik konformasjon, aktiv stedstruktur og proteinfunksjoner.
I disse tilfellene gjenkjenner proteinet en spesifikk region av liganden som er i samsvar med og komplementær til bindingsstedet. Så på overflaten av hepatocytter er det reseptorproteiner for hormonet insulin, som også har en proteinstruktur. Interaksjonen mellom insulin og reseptoren forårsaker en endring i dens konformasjon og aktivering av signalsystemer, noe som fører til akkumulering av næringsstoffer i hepatocytter etter å ha spist.
På denne måten, Funksjonen til proteiner er basert på den spesifikke interaksjonen mellom det aktive senteret av proteinet og liganden.
2. Domenestruktur og dens rolle i funksjonen til proteiner. Lange polypeptidkjeder av globulære proteiner folder seg ofte inn i flere kompakte, relativt uavhengige regioner. De har en uavhengig tertiær struktur, som ligner kuleproteiner, og kalles domener. På grunn av domenestrukturen til proteiner er deres tertiære struktur lettere å danne.
I domeneproteiner er ligandbindingsseter ofte lokalisert mellom domener. Så trypsin er et proteolytisk enzym som produseres av den eksokrine delen av bukspyttkjertelen og er nødvendig for fordøyelsen av matproteiner. Den har en to-domene struktur, og bindingsstedet til trypsin med sin ligand - matprotein - er lokalisert i sporet mellom de to domenene. I det aktive senteret skapes betingelsene som er nødvendige for effektiv binding av et spesifikt sted for matproteinet og hydrolyse av dets peptidbindinger.
Ulike domener i et protein kan bevege seg i forhold til hverandre når det aktive senteret samhandler med liganden (fig. 1.15).
Hexokinase- et enzym som katalyserer fosforyleringen av glukose ved hjelp av ATP. Det aktive stedet for enzymet er lokalisert i kløften mellom de to domenene. Når heksokinase binder seg til glukose, lukkes de omkringliggende domenene og substratet fanges opp, hvor fosforylering skjer (se fig. 1.15).
 Ris. 1.15. Binding av heksokinasedomener til glukose
Ris. 1.15. Binding av heksokinasedomener til glukose
I noen proteiner utfører domener uavhengige funksjoner ved å binde seg til forskjellige ligander. Slike proteiner kalles multifunksjonelle.
3. Legemidler - ligander som påvirker funksjonen til proteiner. Interaksjonen mellom proteiner og ligander er spesifikk. På grunn av konformasjonslabiliteten til proteinet og dets aktive sete, er det imidlertid mulig å velge et annet stoff som også kan interagere med proteinet på det aktive stedet eller en annen del av molekylet.
Et stoff som i struktur ligner en naturlig ligand kalles strukturell analog av liganden eller en unaturlig ligand. Det samhandler også med et protein på det aktive stedet. En strukturell analog av en ligand kan begge forbedre proteinfunksjonen (agonist) og redusere den (motstander). Liganden og dens strukturelle analoger konkurrerer med hverandre for proteinbinding på samme sted. Slike stoffer kalles konkurrerende modulatorer(regulatorer) av proteinfunksjoner. Mange medisiner fungere som proteinhemmere. Noen av dem oppnås ved kjemisk modifisering av naturlige ligander. Proteinfunksjonshemmere kan være medikamenter og giftstoffer.
Atropin er en konkurrerende hemmer av M-kolinerge reseptorer. Acetylkolin er en nevrotransmitter for overføring av nerveimpulser gjennom kolinerge synapser. For å utføre eksitasjon må acetylkolin frigjort til synaptisk spalte samhandle med proteinet - reseptoren til den postsynaptiske membranen. To typer funnet kolinerge reseptorer:
M-reseptor i tillegg til acetylkolin, interagerer det selektivt med muskarin (fluesopptoksin). M - kolinerge reseptorer er tilstede på glatte muskler og, når de samhandler med acetylkolin, forårsaker deres sammentrekning;
H-reseptor binder seg spesifikt til nikotin. N-kolinerge reseptorer finnes i synapsene til tverrstripete skjelettmuskulatur.
spesifikk inhibitor M-kolinerge reseptorer er atropin. Den finnes i belladonna- og henbaneplanter.
 Atropin har funksjonelle grupper og deres romlige arrangement ligner acetylkolin i sin struktur, derfor tilhører det konkurrerende hemmere av M-kolinerge reseptorer. Gitt at bindingen av acetylkolin til M-kolinerge reseptorer forårsaker sammentrekning av glatte muskler, brukes atropin som et medikament som lindrer spasmen deres. (spasmodisk). Derfor er det kjent bruk av atropin for å slappe av øyemusklene når man ser på fundus, samt for å lindre spasmer i gastrointestinal kolikk. M-kolinerge reseptorer er også tilstede i sentralen nervesystemet(CNS), derfor kan store doser av atropin forårsake en uønsket reaksjon fra sentralnervesystemet: motorisk og mental agitasjon, hallusinasjoner, kramper.
Atropin har funksjonelle grupper og deres romlige arrangement ligner acetylkolin i sin struktur, derfor tilhører det konkurrerende hemmere av M-kolinerge reseptorer. Gitt at bindingen av acetylkolin til M-kolinerge reseptorer forårsaker sammentrekning av glatte muskler, brukes atropin som et medikament som lindrer spasmen deres. (spasmodisk). Derfor er det kjent bruk av atropin for å slappe av øyemusklene når man ser på fundus, samt for å lindre spasmer i gastrointestinal kolikk. M-kolinerge reseptorer er også tilstede i sentralen nervesystemet(CNS), derfor kan store doser av atropin forårsake en uønsket reaksjon fra sentralnervesystemet: motorisk og mental agitasjon, hallusinasjoner, kramper.
Ditilin er en konkurrerende agonist av H-kolinerge reseptorer som hemmer funksjonen til nevromuskulære synapser.
 De nevromuskulære synapsene til skjelettmuskulaturen inneholder H-kolinerge reseptorer. Deres interaksjon med acetylkolin fører til muskelsammentrekninger. I noen kirurgiske operasjoner, samt i endoskopiske studier, brukes medisiner som forårsaker avspenning av skjelettmuskulaturen. (muskelavslappende midler). Disse inkluderer ditylin, som er en strukturell analog av acetylkolin. Den fester seg til H-kolinerge reseptorer, men i motsetning til acetylkolin blir den veldig sakte ødelagt av enzymet acetylkolinesterase. Som et resultat av den forlengede åpningen av ionekanaler og vedvarende depolarisering av membranen, blir ledningen av nerveimpulsen forstyrret og muskelavslapping oppstår. Opprinnelig ble disse egenskapene funnet i curare gift, derfor kalles slike stoffer kurariform.
De nevromuskulære synapsene til skjelettmuskulaturen inneholder H-kolinerge reseptorer. Deres interaksjon med acetylkolin fører til muskelsammentrekninger. I noen kirurgiske operasjoner, samt i endoskopiske studier, brukes medisiner som forårsaker avspenning av skjelettmuskulaturen. (muskelavslappende midler). Disse inkluderer ditylin, som er en strukturell analog av acetylkolin. Den fester seg til H-kolinerge reseptorer, men i motsetning til acetylkolin blir den veldig sakte ødelagt av enzymet acetylkolinesterase. Som et resultat av den forlengede åpningen av ionekanaler og vedvarende depolarisering av membranen, blir ledningen av nerveimpulsen forstyrret og muskelavslapping oppstår. Opprinnelig ble disse egenskapene funnet i curare gift, derfor kalles slike stoffer kurariform.
TEMA 1.3. PROTEINDENATUERING OG MULIGHETEN FOR SPONTAN RENATIVERING
1. Siden den opprinnelige konformasjonen av proteiner opprettholdes på grunn av svake interaksjoner, endringer i sammensetningen og egenskapene til miljøet rundt proteinet, vil påvirkningen kjemiske reagenser og fysiske faktorer forårsaker en endring i konformasjonen deres (egenskapen til konformasjonslabilitet). Brudd på et stort antall bindinger fører til ødeleggelse av den native konformasjonen og proteindenaturering.
Proteindenaturering- dette er ødeleggelsen av deres opprinnelige konformasjon under påvirkning av denaturerende midler, forårsaket av brudd av svake bindinger som stabiliserer den romlige strukturen til proteinet. Denaturering er ledsaget av ødeleggelse av den unike tredimensjonale strukturen og aktive sentrum av proteinet og tap av dets biologiske aktivitet (fig. 1.16).
Alle denaturerte molekyler av ett protein får en tilfeldig konformasjon som skiller seg fra andre molekyler av samme protein. Aminosyreradikalene som danner det aktive senteret viser seg å være romlig fjernt fra hverandre, dvs. det spesifikke bindingssetet til proteinet med liganden blir ødelagt. Under denaturering forblir den primære strukturen til proteiner uendret.
Bruk av denaturerende midler i biologisk forskning og medisin. I biokjemiske studier, før bestemmelsen av lavmolekylære forbindelser i et biologisk materiale, fjernes vanligvis proteiner fra løsningen først. Til dette formålet brukes oftest trikloreddiksyre (TCA). Etter tilsetning av TCA til løsningen, utfelles denaturerte proteiner og fjernes lett ved filtrering (tabell 1.1.)
I medisin brukes denatureringsmidler ofte til å sterilisere medisinske instrumenter og materiale i autoklaver (denatureringsmiddel - høy temperatur) og som antiseptika (alkohol, fenol, kloramin) for å behandle forurensede overflater som inneholder patogen mikroflora.
2. Spontan proteinregenerering- bevis på determinismen til den primære strukturen, konformasjonen og funksjonen til proteiner. Individuelle proteiner er produkter av ett gen som har en identisk aminosyresekvens og får samme konformasjon i cellen. Den grunnleggende konklusjonen om at den primære strukturen til et protein allerede inneholder informasjon om dets konformasjon og funksjon ble laget på grunnlag av evnen til enkelte proteiner (spesielt ribonuklease og myoglobin) til spontan renativering - gjenoppretting av deres opprinnelige konformasjon etter denaturering.
Dannelsen av de romlige strukturene til proteinet utføres ved metoden for selvmontering - en spontan prosess der polypeptidkjeden, som har en unik primærstruktur, har en tendens til å oppløse konformasjonen med den minste. gratis energi. Evnen til å regenerere proteiner som beholder sin primære struktur etter denaturering ble beskrevet i et eksperiment med enzymet ribonuklease.
Ribonuklease er et enzym som bryter bindinger mellom individuelle nukleotider i et RNA-molekyl. Dette kuleproteinet har én polypeptidkjede, hvis tertiære struktur er stabilisert av mange svake og fire disulfidbindinger.
Behandling av ribonuklease med urea, som bryter hydrogenbindinger i molekylet, og et reduksjonsmiddel, som bryter disulfidbindinger, fører til enzymdenaturering og tap av aktivitet.
Fjerning av denaturerende midler ved dialyse fører til gjenoppretting av proteinkonformasjon og funksjon, dvs. til reanimasjon. (Fig. 1.17).
 Ris. 1.17. Denaturering og renativering av ribonuklease
Ris. 1.17. Denaturering og renativering av ribonuklease
A - naturlig konformasjon av ribonuklease, i den tertiære strukturen som det er fire disulfidbindinger; B - denaturert ribonukleasemolekyl;
B - renativt ribonukleasemolekyl med gjenopprettet struktur og funksjon
1. Fullfør tabell 1.2.
Tabell 1.2. Klassifisering av aminosyrer i henhold til polariteten til radikaler
2. Skriv formelen til et tetrapeptid:
Asp - Pro - Fen - Liz
a) isolere de repeterende gruppene i peptidet som danner peptidryggraden og de variable gruppene representert av aminosyreradikaler;
b) utpeke N- og C-terminalene;
c) understreke peptidbindingene;
d) skrive et annet peptid som består av de samme aminosyrene;
e) tell tallet alternativer tetrapeptid med samme aminosyresammensetning.
3. Forklar rollen til den primære strukturen til proteiner ved å bruke eksemplet med en sammenlignende analyse av to strukturelt like og evolusjonært nære peptidhormoner til pattedyrets nevrohypofyse - oksytocin og vasopressin (tabell 1.3).
Tabell 1.3. Struktur og funksjon av oksytocin og vasopressin
 For dette:
For dette:
a) sammenligne sammensetningen og aminosyresekvensen til de to peptidene;
b) finne likheten til den primære strukturen til de to peptidene og likheten mellom deres biologiske virkning;
c) finne forskjellene i strukturen til de to peptidene og forskjellen i deres funksjoner;
d) trekke en konklusjon om påvirkningen av primærstrukturen til peptider på deres funksjoner.
4. Beskriv hovedstadiene i dannelsen av konformasjonen av globulære proteiner (sekundære, tertiære strukturer, konseptet med en supersekundær struktur). Spesifiser hvilke typer bindinger som er involvert i dannelsen av proteinstrukturer. Hvilke aminosyreradikaler kan delta i dannelsen av hydrofobe interaksjoner, ioniske, hydrogenbindinger.
Gi eksempler.
5. Definer konseptet "konformasjonslabilitet av proteiner", angi årsakene til dets eksistens og betydning.
6. Forklar betydningen av følgende setning: "Proteiner fungerer basert på deres spesifikke interaksjon med en ligand", ved å bruke begreper og forklare betydningen deres: proteinkonformasjon, aktivt sete, ligand, komplementaritet, proteinfunksjon.
7. Bruk et av eksemplene, forklar hva domener er og hva deres rolle er i funksjonen til proteiner.
OPPGAVER FOR SELVKONTROLL
1. Sett en kamp.
Funksjonell gruppe i aminosyreradikalet:
A. Karboksylgruppe B. Hydroksylgruppe C Guanidingruppe D. Tiolgruppe E. Aminogruppe
2. Velg de riktige svarene.
Aminosyrer med polare uladede radikaler er:
A. Tsis B. Asn
B. Glu G. Tre
3. Velg de riktige svarene.
Aminosyreradikaler:
A. Gi spesifisitet til primærstrukturen B. Delta i dannelsen av tertiærstrukturen
B. Ved å være lokalisert på overflaten av proteinet påvirker de dets løselighet D. Danner et aktivt senter
D. Delta i dannelsen av peptidbindinger
4. Velg de riktige svarene.
Hydrofobe interaksjoner kan dannes mellom aminosyreradikaler:
A. Tre Lay B. Pro Three
B. Met Ile G. Tir Ala D. Val Fen
5. Velg de riktige svarene.
Ionebindinger kan dannes mellom aminosyreradikaler:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Geese Asp D. Asn Apr
6. Velg de riktige svarene.
Hydrogenbindinger kan dannes mellom aminosyreradikaler:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Sett en kamp.
Typen binding som er involvert i dannelsen av proteinstrukturen:
A. Primærstruktur B. Sekundærstruktur
B. Tertiær struktur
D. Supersekundær struktur E. Konformasjon.
1. Hydrogenbindinger mellom atomene i peptidryggraden
2. Svake bindinger mellom funksjonelle grupper av aminosyreradikaler
3. Bindinger mellom α-amino- og α-karboksylgrupper av aminosyrer
8. Velg de riktige svarene. Trypsin:
A. Proteolytisk enzym B. Inneholder to domener
B. Hydrolyserer stivelse
D. Det aktive senteret er plassert mellom domener. D. Består av to polypeptidkjeder.
9. Velg de riktige svarene. Atropin:
A. Nevrotransmitter
B. Strukturell analog av acetylkolin
B. Interagerer med H-kolinerge reseptorer
G. Forbedrer ledningen av en nerveimpuls gjennom kolinerge synapser
D. Konkurrerende hemmer av M-kolinerge reseptorer
10. Velg de riktige utsagnene. I proteiner:
A. Den primære strukturen inneholder informasjon om strukturen til det aktive nettstedet
B. Det aktive senteret dannes på nivå med primærstrukturen
B. Konformasjonen er stivt fiksert av kovalente bindinger
D. Det aktive setet kan samhandle med en gruppe lignende ligander
på grunn av konformasjonslabiliteten til proteiner D. Endring miljø, kan påvirke affiniteten til den aktive
senter til ligand
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
GRUNNLEGGENDE VILKÅR OG KONSEPT
1. Protein, polypeptid, aminosyrer
2. Primære, sekundære, tertiære proteinstrukturer
3. Konformasjon, naturlig proteinkonformasjon
4. Kovalente og svake bindinger i et protein
5. Konformasjonslabilitet
6. Proteinaktivt sted
7. Ligander
8. Proteinfolding
9. Strukturelle analoger av ligander
10. Domeneproteiner
11. Enkle og komplekse proteiner
12. Proteindenaturering, denatureringsmidler
13. Proteinregenerering
Løse problemer
"Strukturell organisering av proteiner og grunnlaget for deres funksjon"
1. Hovedfunksjonen til proteinet - hemoglobin A (HbA) - er transport av oksygen til vevene. I den menneskelige befolkningen er flere former for dette proteinet med endrede egenskaper og funksjon kjent - de såkalte unormale hemoglobinene. For eksempel har hemoglobin S funnet i erytrocyttene til pasienter med sigdcelleanemi (HbS) blitt funnet å ha lav løselighet under forhold med lavt oksygenpartialtrykk (som forekommer i venøst blod). Dette fører til dannelsen av aggregater av dette proteinet. Proteinet mister sin funksjon, feller ut og erytrocytter får uregelmessig form(noen av dem danner en sigdform) og ødelegges raskere enn vanlig i milten. Som et resultat utvikler sigdcelleanemi.
Den eneste forskjellen i den primære strukturen til HvA ble funnet i den N-terminale regionen av β-kjeden til hemoglobin. Sammenlign de N-terminale områdene i β-kjeden og vis hvordan endringer i primærstrukturen til et protein påvirker dets egenskaper og funksjoner.
 For dette:
For dette:
a) skriv aminosyreformlene som HvA avviker med og sammenlign egenskapene til disse aminosyrene (polaritet, ladning).
b) trekke en konklusjon om årsaken til reduksjonen i løselighet og brudd på oksygentransport i vevet.
2. Figuren viser et diagram over strukturen til et protein som har et ligandbindende senter (aktivt senter). Forklar hvorfor et protein er selektivt i valg av ligand. For dette:
a) husk hva det aktive senteret til proteinet er, og vurder strukturen til det aktive senteret til proteinet vist i figuren;
b) skriv formlene til aminosyreradikalene som utgjør det aktive senteret;
c) tegne en ligand som spesifikt kan interagere med det aktive stedet til proteinet. Angi på den funksjonelle grupper som er i stand til å danne bindinger med aminosyreradikalene som utgjør det aktive senteret;
d) angi hvilke typer bindinger som oppstår mellom liganden og aminosyreradikalene til det aktive senteret;
e) Forklar grunnlaget for spesifisiteten til interaksjonen mellom et protein og en ligand.
 3.
Figuren viser det aktive stedet til proteinet og flere ligander.
3.
Figuren viser det aktive stedet til proteinet og flere ligander.
Bestem hvilken av liganden som er mest sannsynlig å samhandle med det aktive stedet til proteinet og hvorfor.
 Hvilke typer bindinger oppstår under dannelsen av protein-ligand-komplekset?
Hvilke typer bindinger oppstår under dannelsen av protein-ligand-komplekset?
4. Strukturelle analoger av naturlige proteinligander kan brukes som medikamenter for å endre aktiviteten til proteiner.
Acetylkolin er en mediator for eksitasjonsoverføring i nevromuskulære synapser. Når acetylkolin interagerer med proteiner - reseptorer av den postsynaptiske membranen til skjelettmuskulaturen, åpnes ionekanaler og muskelsammentrekning oppstår. Ditylin er et medikament som brukes i enkelte operasjoner for å slappe av musklene, da det forstyrrer overføringen av nerveimpulser gjennom nevromuskulære synapser. Forklar virkningsmekanismen til ditylin som et muskelavslappende legemiddel. For dette:
a) skrive formlene for acetylkolin og ditylin og sammenligne deres strukturer;
b) beskrive mekanismen for den avslappende virkningen av ditylin.
5. I noen sykdommer stiger pasientens kroppstemperatur, noe som anses som en beskyttende reaksjon av kroppen. Høye temperaturer er imidlertid skadelige for kroppens proteiner. Forklar hvorfor ved temperaturer over 40 °C blir funksjonen til proteiner forstyrret og det oppstår en trussel mot menneskeliv. For å gjøre dette, husk:
1) Strukturen til proteiner og bindingene som holder strukturen i den native konformasjonen;
2) Hvordan endres strukturen og funksjonen til proteiner med økende temperatur?;
3) Hva er homeostase og hvorfor er det viktig å opprettholde menneskers helse.
Modulær enhet 2 OLIGOMERE PROTEINER SOM MÅL FOR REGULERINGSMÅL. STRUKTURELL OG FUNKSJONELL VARIANT AV PROTEINER. PROTEINSEPARERING OG -RENSEMETODER
Læringsmål Å kunne:
1. Bruke kunnskap om egenskapene til strukturen og funksjonene til oligomere proteiner for å forstå de adaptive mekanismene for regulering av deres funksjoner.
2. Forklar rollen til chaperoner i syntese og vedlikehold av proteinkonformasjon i en celle.
3. Å forklare mangfoldet av livsmanifestasjoner ved mangfoldet av strukturer og funksjoner til proteiner syntetisert i kroppen.
4. Analyser forholdet mellom strukturen til proteiner og deres funksjon ved å sammenligne relaterte hemoproteiner - myoglobin og hemoglobin, samt representanter for fem klasser av proteiner av immunoglobulinfamilien.
5. Anvende kunnskap om egenskapene til de fysisk-kjemiske egenskapene til proteiner for å velge metoder for deres rensing fra andre proteiner og urenheter.
6. Tolk resultatene av den kvantitative og kvalitative sammensetningen av blodplasmaproteiner for å bekrefte eller klargjøre den kliniske diagnosen.
Vet:
1. Funksjoner av strukturen til oligomere proteiner og adaptive mekanismer for regulering av deres funksjoner på eksemplet med hemoglobin.
2. Strukturen og funksjonene til chaperones og deres betydning for å opprettholde den native konformasjonen av proteiner i en celle.
3. Prinsipper for å gruppere proteiner i familier i henhold til likheten mellom deres konformasjon og funksjoner på eksemplet med immunglobuliner.
4. Metoder for separasjon av proteiner basert på egenskapene til deres fysisk-kjemiske egenskaper.
5. Elektroforese av blodplasma som metode for vurdering av kvalitativ og kvantitativ sammensetning av proteiner.
TEMA 1.4. FUNKSJONER AV STRUKTUREN OG FUNKSJONEN TIL OLIGOMERE PROTEINER PÅ EKSEMPEL PÅ HEMOGLOBIN
1. Mange proteiner inneholder flere polypeptidkjeder. Slike proteiner kalles oligomer, og individuelle kretser protomere. Protomerer i oligomere proteiner er forbundet med mange svake ikke-kovalente bindinger (hydrofobe, ioniske, hydrogen). Interaksjon
protomers er utført takket være komplementaritet deres kontaktflater.
Antall protomerer i oligomere proteiner kan variere sterkt: hemoglobin inneholder 4 protomerer, enzymet aspartataminotransferase - 12 protomerer, og proteinet til tobakksmosaikkviruset inkluderer 2120 protomerer forbundet med ikke-kovalente bindinger. Derfor kan oligomere proteiner ha svært høye molekylvekter.
Interaksjonen av en protomer med andre kan betraktes som et spesielt tilfelle av interaksjonen av et protein med en ligand, siden hver protomer fungerer som en ligand for andre protomerer. Antallet og metoden for tilkobling av protomerer i et protein kalles kvartær proteinstruktur.
Proteiner kan inneholde protomerer med samme eller forskjellig struktur, for eksempel er homodimerer proteiner som inneholder to identiske protomerer, og heterodimerer er proteiner som inneholder to forskjellige protomerer.
Hvis proteiner inneholder forskjellige protomerer, kan det dannes bindingssentre med forskjellige ligander som er forskjellige i struktur. Når liganden binder seg til det aktive senteret, manifesteres funksjonen til dette proteinet. Et senter plassert på en annen protomer kalles allosterisk (annet enn aktiv). Kontakter allosterisk ligand eller effektor, den utfører en regulatorisk funksjon (fig. 1.18). Samspillet mellom det allosteriske senteret og effektoren forårsaker konformasjonsendringer i strukturen til hele det oligomere proteinet på grunn av dets konformasjonslabilitet. Dette påvirker affiniteten til det aktive stedet for en spesifikk ligand og regulerer funksjonen til det proteinet. En endring i konformasjonen og funksjonen til alle protomerer under interaksjonen av et oligomert protein med minst en ligand kalles kooperativ konformasjonsendring. Effektorer som forbedrer proteinfunksjonen kalles aktivatorer og effektorer som demper funksjonen - inhibitorer.
Således, i oligomere proteiner, så vel som proteiner med en domenestruktur, dukker det opp en ny egenskap sammenlignet med monomere proteiner - evnen til allosterisk å regulere funksjoner (regulering ved å feste forskjellige ligander til proteinet). Dette kan sees ved å sammenligne strukturene og funksjonene til de to nært beslektede komplekse proteinene myoglobin og hemoglobin.
 Ris. 1.18. Diagram over strukturen til et dimert protein
Ris. 1.18. Diagram over strukturen til et dimert protein
2. Dannelse av romlige strukturer og funksjon av myoglobin.
Myoglobin (Mb) er et protein som finnes i røde muskler, hvis hovedfunksjon er å skape O 2 -reserver som er nødvendige for intenst muskelarbeid. MB er et komplekst protein som inneholder en proteindel - apoMB og en ikke-proteindel - hem. Den primære strukturen til apoMB bestemmer dens kompakte kulekonformasjon og strukturen til det aktive senteret, som ikke-proteindelen av myoglobin, hem, er festet til. Oksygen fra blodet til musklene binder seg til Fe + 2 hem i sammensetningen av myoglobin. MB er et monomert protein med svært høy affinitet for O 2, derfor frigjøres oksygen av myoglobin kun under intenst muskelarbeid, når partialtrykket av O 2 avtar kraftig.
Dannelse av konformasjon MB. I røde muskler, på ribosomer under translasjon, foregår syntesen av den primære strukturen til MB, representert ved en spesifikk sekvens på 153 aminosyrerester. Den sekundære strukturen til Mv inneholder åtte α-helikser, kalt latinske bokstaver fra A til H, mellom hvilke det er ikke-spiraliserte seksjoner. Den tertiære strukturen til Mv har form av en kompakt kule, i hvis fordypning, mellom F- og E α-heliksene, er det et aktivt senter (fig. 1.19).
 Ris. 1.19. Struktur av myoglobin
Ris. 1.19. Struktur av myoglobin
3. Funksjoner ved strukturen og funksjonen til det aktive MV-senteret. Det aktive senteret til Mv dannes hovedsakelig av hydrofobe aminosyreradikaler som er langt fra hverandre i primærstrukturen (for eksempel Tri 3 9 og Phen 138) Ligandene som er dårlig løselig i vann, hem og O 2, er festet til det aktive senteret. Heme er en spesifikk apoMv-ligand (fig. 1.20), som er basert på fire pyrrolringer forbundet med metenylbroer; i sentrum er det et Fe+ 2-atom koblet til nitrogenatomene i pyrrolringene med fire koordinasjonsbindinger. I tillegg til de hydrofobe radikalene av aminosyrer, inneholder det aktive senteret av Mv også rester av to aminosyrer med hydrofile radikaler - Gis E 7(Gis 64) og Gis F 8(Hans 93) (Fig. 1.21).
 Ris. 1.20. Strukturen til hem - den ikke-proteindelen av myoglobin og hemoglobin
Ris. 1.20. Strukturen til hem - den ikke-proteindelen av myoglobin og hemoglobin
 Ris. 1.21. Plassering av hem og O 2 i det aktive stedet for apomyoglobin og hemoglobin protomerer
Ris. 1.21. Plassering av hem og O 2 i det aktive stedet for apomyoglobin og hemoglobin protomerer
Hem er kovalent bundet til His F 8 via et jernatom. O 2 festes til jern på den andre siden av hemeplanet. Hans E 7 er nødvendig for riktig orientering av O 2 og letter tilsetningen av oksygen til Fe + 2 hem
Gis F 8 danner en koordinasjonsbinding med Fe+ 2 og fester heme godt i det aktive senteret. Gis E 7 er nødvendig for riktig orientering i det aktive senteret til en annen ligand - O 2 under dens interaksjon med Fe + 2 hem. Hem-mikromiljøet skaper forhold for sterk, men reversibel binding av O 2 med Fe + 2 og hindrer vann i å trenge inn i det hydrofobe aktive senteret, noe som kan føre til oksidasjon til Fe + 3 .
Den monomere strukturen til MB og dets aktive senter bestemmer proteinets høye affinitet for O 2 .
4. Oligomer struktur av Hb og regulering av Hb-affinitet for O 2 med ligander. Menneskelige hemoglobiner- en familie av proteiner, samt myoglobin relatert til komplekse proteiner (hemoproteiner). De har en tetramer struktur og inneholder to α-kjeder, men skiller seg i strukturen til de to andre polypeptidkjedene (2α-, 2x-kjeder). Strukturen til den andre polypeptidkjeden bestemmer funksjonene til disse formene av Hb. Omtrent 98% av hemoglobinet i voksne erytrocytter er hemoglobin A(2a-, 2p-kjeder).
Under fosterutviklingen er det to hovedtyper av hemoglobiner: embryonal HB(2α, 2ε), som finnes i de tidlige stadiene av fosterutviklingen, og hemoglobin F (foster)- (2α, 2γ), som erstatter tidlig fosterhemoglobin i den sjette måneden av fosterutviklingen og erstattes av Hb A først etter fødselen.
Hv A er et protein relatert til myoglobin (Mv) som finnes i voksne erytrocytter. Strukturen til dens individuelle protomerer ligner på myoglobin. De sekundære og tertiære strukturene til myoglobin- og hemoglobin-protomerer er svært like, til tross for at bare 24 aminosyrerester er identiske i den primære strukturen til polypeptidkjedene deres (den sekundære strukturen til hemoglobin-protomerer, som myoglobin, inneholder åtte α-helixer, betegnet med latinske bokstaver fra A til H , og tertiærstrukturen har form av en kompakt kule). Men i motsetning til myoglobin, har hemoglobin en oligomer struktur, består av fire polypeptidkjeder forbundet med ikke-kovalente bindinger (Figur 1.22).
Hver Hb-protomer er assosiert med en ikke-proteindel - hem og naboprotomerer. Forbindelsen mellom proteindelen av Hb og hem er lik den for myoglobin: i det aktive sentrum av proteinet er de hydrofobe delene av hemen omgitt av hydrofobe aminosyreradikaler, med unntak av His F 8 og His E 7 , som er plassert på begge sider av hemeplanet og spiller en lignende rolle i funksjonen til proteinet og dets binding med oksygen (se strukturen til myoglobin).
 Ris. 1.22. Oligomer struktur av hemoglobin
Ris. 1.22. Oligomer struktur av hemoglobin
I tillegg, Gis E 7 utfører en viktig tilleggsrolle i driften til NV. Fritt hem har en 25 000 ganger høyere affinitet for CO enn for O 2 . CO dannes i små mengder i kroppen, og gitt sin høye affinitet for hem, kan det forstyrre transporten av O 2 som er nødvendig for cellelivet. Men i sammensetningen av hemoglobin overstiger affiniteten til hem for karbonmonoksid affiniteten for O 2 med bare 200 ganger på grunn av tilstedeværelsen av E 7 i det aktive senteret av His. Resten av denne aminosyren skaper optimale forhold for binding av hem med O 2 og svekker samspillet mellom hem og CO.
5. Hovedfunksjonen til Hb er transport av O 2 fra lungene til vevene. I motsetning til monomert myoglobin, som har en svært høy affinitet for O 2 og utfører funksjonen med å lagre oksygen i røde muskler, gir den oligomere strukturen til hemoglobin:
1) rask metning av Hb med oksygen i lungene;
2) evnen til Hb til å frigjøre oksygen i vevene ved et relativt høyt partialtrykk på O 2 (20-40 mm Hg);
3) muligheten for å regulere affiniteten til Hb til O 2 .
6. Kooperative endringer i konformasjonen av hemoglobinprotomerer akselererer bindingen av O 2 i lungene og dens retur til vevet. I lungene fremmer et høyt partialtrykk av O2 bindingen til Hb på det aktive stedet til fire protomerer (2α og 2β). Det aktive senteret til hver protomer, som i myoglobin, er plassert mellom to α-helikser (F og E) i en hydrofob lomme. Den inneholder en ikke-proteindel - hem, festet til proteindelen ved mange svake hydrofobe interaksjoner og en sterk binding mellom Fe 2 + hem og His F 8 (se fig. 1.21).
I deoksyhemoglobin, på grunn av denne forbindelsen med His F 8, stikker Fe 2 + atomet ut fra hemplanet mot histidin. Bindingen av O 2 til Fe 2 + skjer på den andre siden av hemen i His E 7-regionen ved hjelp av en enkelt fri koordinasjonsbinding. Hans E 7 gir optimale forhold for binding av O 2 med hemjern.
Tilsetningen av O 2 til Fe +2-atomet til en protomer får den til å bevege seg inn i hemeplanet, og bak det histidinresten knyttet til den
 Ris. 1.23. Endring i konformasjonen til hemoglobinprotomeren når den kombineres med O 2
Ris. 1.23. Endring i konformasjonen til hemoglobinprotomeren når den kombineres med O 2
Dette fører til en endring i konformasjonen av alle polypeptidkjeder på grunn av deres konformasjonslabilitet. Endring av konformasjonen til andre kjeder letter deres interaksjon med de neste O 2 -molekylene.
Det fjerde O 2 molekylet fester seg til hemoglobin 300 ganger lettere enn det første (fig. 1.24).
 Ris. 1.24. Kooperative endringer i konformasjonen av hemoglobinprotomerer under interaksjonen med O 2
Ris. 1.24. Kooperative endringer i konformasjonen av hemoglobinprotomerer under interaksjonen med O 2
I vev spaltes hvert påfølgende O 2-molekyl lettere av enn det forrige, også på grunn av samarbeidsendringer i protomerkonformasjon.
7. CO 2 og H +, dannet under katabolismen av organiske stoffer, reduserer affiniteten til hemoglobin for O 2 i forhold til deres konsentrasjon. Energien som er nødvendig for cellefunksjon, produseres hovedsakelig i mitokondrier under oksidasjon av organiske stoffer ved bruk av O 2 levert fra lungene med hemoglobin. Som et resultat av oksidasjon av organiske stoffer dannes sluttproduktene av deres forfall: CO 2 og K 2 O, hvorav mengden er proporsjonal med intensiteten av de pågående oksidasjonsprosessene.
CO 2 diffunderer fra cellene inn i blodet og trenger inn i erytrocytter, hvor det under påvirkning av enzymet karbonhydrase blir til karbonsyre. Denne svake syren dissosieres til et proton og et bikarbonation.
H+ kan slutte seg til GIS-radikalene 14 6 i α- og β-kjeder av hemoglobin, dvs. i områder langt fra hemen. Protonering av hemoglobin reduserer dets affinitet for O 2, fremmer eliminering av O 2 fra oxyHb, dannelse av deoxyHb, og øker tilførselen av oksygen til vev i forhold til antall dannede protoner (fig. 1.25).
Økningen i mengden frigjort oksygen avhengig av økningen i konsentrasjonen av H + i erytrocytter kalles Bohr-effekten (etter den danske fysiologen Christian Bohr, som først oppdaget denne effekten).
I lungene fremmer et høyt partialtrykk av oksygen dets binding til deoksyHb, noe som reduserer proteinets affinitet for H+. De frigjorte protonene under påvirkning av karbanhydrase interagerer med bikarbonater for å danne CO 2 og H 2 O

 Ris. 1,25. Avhengigheten av affiniteten til Hb til O 2 på konsentrasjonen av CO 2 og protoner (Bohr-effekten):
Ris. 1,25. Avhengigheten av affiniteten til Hb til O 2 på konsentrasjonen av CO 2 og protoner (Bohr-effekten):
MEN- påvirkning av CO 2 og H+ konsentrasjon på frigjøring av O 2 fra komplekset med Hb (Bohr effekt); B- oksygenering av deoksyhemoglobin i lungene, dannelse og frigjøring av CO 2 .
Den resulterende CO 2 kommer inn i alveolerommet og fjernes med utåndet luft. Dermed blir mengden oksygen som frigjøres av hemoglobin i vev regulert av produktene av katabolisme av organiske stoffer: jo mer intens nedbrytning av stoffer, for eksempel under fysisk anstrengelse, jo høyere er konsentrasjonen av CO 2 og H + og jo mer oksygen vevet mottar som et resultat av en reduksjon i affiniteten til H til O 2.
8. Allosterisk regulering av Hb-affinitet for O 2 med en ligand - 2,3-bisfosfoglyserat. I erytrocytter syntetiseres den allosteriske liganden av hemoglobin, 2,3-bisfosfoglyserat (2,3-BPG), fra produktet av glukoseoksidasjon - 1,3-bisfosfoglyserat. Under normale forhold er konsentrasjonen av 2,3-BPG høy og kan sammenlignes med Hb. 2,3-BPG har en sterk negativ ladning på -5.
 Bisfosfoglyserat i vevskapillærer, ved å binde seg til deoksyhemoglobin, øker oksygenproduksjonen i vev, og reduserer affiniteten til Hb til O 2 .
Bisfosfoglyserat i vevskapillærer, ved å binde seg til deoksyhemoglobin, øker oksygenproduksjonen i vev, og reduserer affiniteten til Hb til O 2 .
Det er et hulrom i midten av det tetramere hemoglobinmolekylet. Det dannes av aminosyrerestene til alle fire protomerene (se fig. 1.22). I vevskapillærer bryter protoneringen av Hb (Bohr-effekten) bindingen mellom hemjernet og O 2 . I et molekyl
deoksyhemoglobin, sammenlignet med oksyhemoglobin, vises ytterligere ioniske bindinger som forbinder protomerene, som et resultat av at størrelsen på det sentrale hulrommet øker sammenlignet med oksyhemoglobin. Det sentrale hulrommet er stedet for binding av 2,3-BPG til hemoglobin. På grunn av forskjellen i størrelsen på det sentrale hulrommet, kan 2,3-BPG bare feste seg til deoksyhemoglobin.
2,3-BPG interagerer med hemoglobin i et område fjernt fra aktive steder av proteinet og tilhører allosterisk(regulatoriske) ligander, og det sentrale hulrommet Hb er allosterisk senter. 2,3-BPG har en sterk negativ ladning og interagerer med fem positivt ladede grupper av to Hb β-kjeder: den N-terminale α-aminogruppen Val og Lys 82 Gis 143 radikalene (fig. 1.26).
 Ris. 1,26. BPG i det sentrale hulrommet til deoksyhemoglobin
Ris. 1,26. BPG i det sentrale hulrommet til deoksyhemoglobin
BPG binder seg til tre positivt ladede grupper i hver β-streng.
I vevskapillærer interagerer det resulterende deoksyhemoglobinet med 2,3-BPG, og ioniske bindinger dannes mellom de positivt ladede radikalene til β-kjeder og den negativt ladede liganden, som endrer proteinkonformasjonen og reduserer affiniteten til Hb for O 2 . En reduksjon i affiniteten til Hb for O 2 bidrar til en mer effektiv frigjøring av O 2 til vevet.
I lungene, ved høyt partialtrykk, samhandler oksygen med Hb, og forbinder hemejernet; i dette tilfellet endres konformasjonen av proteinet, det sentrale hulrommet reduseres, og 2,3-BPG fortrenges fra det allosteriske senteret
Dermed har oligomere proteiner nye egenskaper sammenlignet med monomere proteiner. Festing av ligander på steder,
romlig fjernt fra hverandre (allosterisk), i stand til å forårsake konformasjonsendringer i hele proteinmolekylet. På grunn av interaksjonen med regulatoriske ligander, endres konformasjonen og funksjonen til proteinmolekylet tilpasser seg miljøendringer.
TEMA 1.5. VEDLIKEHOLD AV PROTEINER UNDER CELLEFORHOLD
I celler, under syntesen av polypeptidkjeder, transporteres deres gjennom membraner til de tilsvarende seksjonene av cellen, i prosessen med folding (dannelse av en naturlig konformasjon) og under montering av oligomere proteiner, så vel som under deres funksjon, mellomliggende , aggregeringsutsatte, ustabile konformasjoner oppstår i proteinstrukturen. Hydrofobe radikaler, vanligvis skjult inne i proteinmolekylet i deres opprinnelige konformasjon, vises på overflaten i en ustabil konformasjon og har en tendens til å kombineres med grupper av andre proteiner som er like dårlig løselige i vann. I cellene til alle kjente organismer er det funnet spesielle proteiner som gir optimal folding av celleproteiner, stabiliserer deres opprinnelige konformasjon under funksjon, og, viktigst av alt, opprettholder strukturen og funksjonene til intracellulære proteiner i tilfelle homeostaseforstyrrelse. Disse proteinene kalles "ledelse" som betyr "barnepike" på fransk.
1. Molekylære chaperoner og deres rolle i å forhindre proteindenaturering.
Chaperones (III) er klassifisert i henhold til massen av underenheter. Chaperoner med høy molekylvekt har en masse på 60 til 110 kD. Blant dem har tre klasser blitt studert mest: Sh-60, Sh-70 og Sh-90. Hver klasse inkluderer en familie av relaterte proteiner. Således inneholder Sh-70 proteiner med en molekylvekt på 66 til 78 kD. Ledere med lav molekylvekt har en molekylvekt på 40 til 15 kD.
Blant ledsagerne det er konstitutiv proteiner hvis høye basalsyntese ikke er avhengig av stressende effekter på kroppens celler, og induserbar, syntesen som under normale forhold er svak, men øker kraftig under stressende påvirkninger. Induserbare chaperones kalles også "varmesjokkproteiner" fordi de først ble oppdaget i celler utsatt for høye temperaturer. I celler, på grunn av den høye konsentrasjonen av proteiner, er spontan regenerering av delvis denaturerte proteiner vanskelig. Sh-70 kan forhindre denatureringsprosessen som har startet og bidra til å gjenopprette den opprinnelige konformasjonen av proteiner. Molekylære chaperones-70- en svært konservert klasse av proteiner som finnes i alle deler av cellen: cytoplasma, kjerne, endoplasmatisk retikulum, mitokondrier. Ved karboksylenden av den eneste polypeptidkjeden til Sh-70, er det en region som er en rille som kan samhandle med peptider av lengde
fra 7 til 9 aminosyrerester anriket med hydrofobe radikaler. Slike steder i kuleproteiner forekommer omtrent hver 16. aminosyre. Sh-70 er i stand til å beskytte proteiner fra termisk inaktivering og gjenopprette konformasjonen og aktiviteten til delvis denaturerte proteiner.
2. Rollen til chaperones i proteinfolding. Under syntesen av proteiner på ribosomet syntetiseres den N-terminale regionen til polypeptidet før den C-terminale regionen. Den komplette aminosyresekvensen til proteinet er nødvendig for å danne den native konformasjonen. I prosessen med proteinsyntese er chaperones-70, på grunn av strukturen til deres aktive senter, i stand til å lukke aggregeringsutsatte områder av polypeptidet anriket på hydrofobe aminosyreradikaler inntil syntesen er fullført (Figur 1.27, A).
 Ris. 1,27. Involvering av chaperones i proteinfolding
Ris. 1,27. Involvering av chaperones i proteinfolding
A - deltakelse av chaperones-70 i forebygging av hydrofobe interaksjoner mellom stedene til det syntetiserte polypeptidet; B - dannelse av en naturlig proteinkonformasjon i chaperonkomplekset
Mange høymolekylære proteiner med en kompleks konformasjon, for eksempel en domenestruktur, folder seg i et spesielt rom dannet av W-60. Sh-60 fungerer som et oligomert kompleks bestående av 14 underenheter. De danner to hule ringer, som hver består av syv underenheter, disse ringene er koblet til hverandre. Hver underenhet av III-60 består av tre domener: apikale (apikale), anriket med hydrofobe radikaler som vender mot ringens hulrom, mellomliggende og ekvatoriale (fig. 1.28).
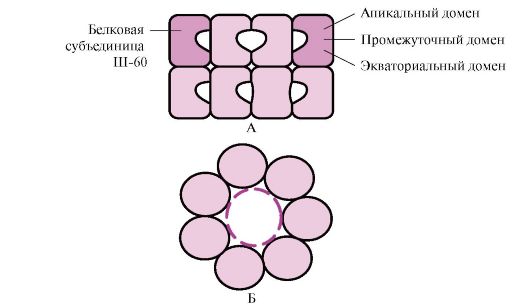 Ris. 1,28. Struktur av chaperoninkomplekset bestående av 14 Sh-60
Ris. 1,28. Struktur av chaperoninkomplekset bestående av 14 Sh-60
A - sett fra siden; B - sett ovenfra
Syntetiserte proteiner med overflateelementer som er karakteristiske for utfoldede molekyler, spesielt hydrofobe radikaler, kommer inn i hulrommet til chaperonringene. I det spesifikke miljøet til disse hulrommene skjer en oppregning av mulige konformasjoner inntil den eneste, energimessig mest gunstige er funnet (fig. 1.27, B). Dannelsen av konformasjoner og frigjøring av proteinet er ledsaget av ATP-hydrolyse i ekvatorialområdet. Vanligvis krever en slik chaperone-avhengig folding en betydelig mengde energi.
I tillegg til å delta i dannelsen av den tredimensjonale strukturen til proteiner og renativering av delvis denaturerte proteiner, kreves det også chaperoner for slike grunnleggende prosesser som sammenstilling av oligomere proteiner, gjenkjennelse og transport av denaturerte proteiner inn i lysosomer, transport av proteiner på tvers av membraner, og deltakelse i reguleringen av aktiviteten til proteinkomplekser.
TEMA 1.6. FORVALT AV PROTEINER. PROTEINFAMILIER PÅ EKSEMPEL PÅ IMMUNOGLOBULINER
1. Ekorn leker avgjørende rolle i livet til individuelle celler og hele den flercellede organismen, og deres funksjoner er overraskende forskjellige. Dette bestemmes av særegenhetene til den primære strukturen og konformasjonen til proteiner, den unike strukturen til det aktive senteret og evnen til å binde spesifikke ligander.
Bare en svært liten del av alle mulige varianter av peptidkjeder kan adoptere en stabil romlig struktur; flertall
av dem kan ta mange konformasjoner med omtrent samme Gibbs-energi, men med ulike egenskaper. Primærstruktur av de fleste kjente proteiner, valgt biologisk evolusjon, gir eksepsjonell stabilitet til en av konformasjonene, som bestemmer funksjonene til dette proteinets funksjon.
2. Proteinfamilier. Innenfor den samme biologiske arten kan substitusjoner av aminosyrerester føre til fremveksten av forskjellige proteiner som utfører beslektede funksjoner og har homologe aminosyresekvenser. Slike beslektede proteiner har slående like konformasjoner: antall og arrangement av α-helikser og/eller β-strukturer, og de fleste svingene og foldene til polypeptidkjedene er like eller identiske. Proteiner med homologe områder av polypeptidkjeden, lignende konformasjon og relaterte funksjoner er isolert i proteinfamilier. Eksempler på proteinfamilier: serinproteinaser, immunoglobulinfamilie, myoglobinfamilie.
Serinproteinaser- en familie av proteiner som utfører funksjonen til proteolytiske enzymer. Disse inkluderer fordøyelsesenzymer - chymotrypsin, trypsin, elastase og mange blodkoagulasjonsfaktorer. Disse proteinene har 40 % identiske aminosyrer og en svært lik konformasjon (fig. 1.29).

Ris. 1,29. Romlige strukturer av elastase (A) og chymotrypsin (B)
Noen aminosyresubstitusjoner har ført til en endring i substratspesifisiteten til disse proteinene og fremveksten av funksjonelt mangfold i familien.
3. Familie av immunglobuliner. I immunsystemets arbeid stor rolle lekeproteiner fra immunoglobulin-superfamilien, som inkluderer tre familier av proteiner:
Antistoffer (immunoglobuliner);
T-lymfocyttreseptorer;
Proteiner av det store histokompatibilitetskomplekset - MHC 1. og 2. klasse (Major Histocompatibility Complex).
Alle disse proteinene har en domenestruktur, består av homologe immunlignende domener og utfører lignende funksjoner: de samhandler med fremmede strukturer, enten oppløst i blod, lymfe eller intercellulær væske (antistoffer), eller lokalisert på overflaten av celler (egen eller fremmed).
4. Antistoffer- spesifikke proteiner produsert av B-lymfocytter som respons på inntak av en fremmed struktur kalt antigen.
Funksjoner av strukturen til antistoffer
De enkleste antistoffmolekylene består av fire polypeptidkjeder: to identiske lette kjeder - L, som inneholder omtrent 220 aminosyrer, og to identiske tunge kjeder - H, bestående av 440-700 aminosyrer. Alle fire kjedene i et antistoffmolekyl er forbundet med mange ikke-kovalente bindinger og fire disulfidbindinger (fig. 1.30).
Lette kjeder av antistoffer består av to domener: variabel (VL), lokalisert i den N-terminale regionen av polypeptidkjeden, og konstant (CL), lokalisert ved C-terminalen. Tunge kjeder har typisk fire domener: en variabel (VH) ved N-terminalen og tre konstanter (CH1, CH2, CH3) (se figur 1.30). Hvert immunglobulindomene har en β-plissert overbygning der to cysteinrester er koblet sammen med en disulfidbinding.
Mellom de to konstante domenene CH1 og CH2 er det en region som inneholder et stort antall prolinrester, som forhindrer dannelsen av den sekundære strukturen og interaksjonen av tilstøtende H-kjeder i dette segmentet. Denne hengselregionen gir antistoffmolekylet fleksibilitet. Mellom de variable domenene til de tunge og lette kjedene er to identiske antigenbindingsseter (aktive steder for binding av antigener), så slike antistoffer kalles ofte bivalente. Bindingen av et antigen til et antistoff involverer ikke hele aminosyresekvensen til de variable områdene i begge kjeder, men bare 20-30 aminosyrer lokalisert i de hypervariable områdene i hver kjede. Det er disse områdene som bestemmer den unike evnen til hver type antistoff til å samhandle med det tilsvarende komplementære antigenet.
Antistoffer er en av kroppens forsvarslinjer mot invaderende fremmede organismer. Deres funksjon kan deles inn i to stadier: det første stadiet er gjenkjennelsen og bindingen av et antigen på overflaten av fremmede organismer, noe som er mulig på grunn av tilstedeværelsen av antigenbindende steder i antistoffstrukturen; det andre trinnet er initieringen av prosessen med inaktivering og ødeleggelse av antigenet. Spesifisiteten til det andre stadiet avhenger av klassen av antistoffer. Det er fem klasser av tunge kjeder som skiller seg fra hverandre i strukturen til konstante domener: α, δ, ε, γ og μ, i henhold til hvilke fem klasser av immunglobuliner skilles ut: A, D, E, G og M.
Strukturelle trekk ved tunge kjeder gir hengselområdene og C-terminale områder av tunge kjeder en konformasjon som er karakteristisk for hver klasse. Når et antigen binder seg til et antistoff, bestemmer konformasjonsendringer i de konstante domenene veien for fjerning av antigenet.
 Ris. 1. 30. Domenestruktur til IgG
Ris. 1. 30. Domenestruktur til IgG
Immunoglobuliner M
Immunglobuliner M har to former.
Monomerisk form- 1. klasse antistoffer produsert av den utviklende B-lymfocytten. Deretter bytter mange B-celler til å produsere andre klasser av antistoffer, men med samme antigenbindingssted. IgM er inkorporert i membranen og fungerer som en antigengjenkjennende reseptor. Inkorporering av IgM i cellemembranen er mulig på grunn av tilstedeværelsen av 25 hydrofobe aminosyrerester i haledelen av regionen.
Sekretorisk form av IgM inneholder fem monomere underenheter koblet til hverandre med disulfidbindinger og en ekstra polypeptid J-kjede (fig. 1.31). Tungkjedemonomerer av denne formen inneholder ikke en hydrofob hale. Pentameren har 10 antigenbindingssteder og er derfor effektiv til å gjenkjenne og fjerne antigenet som har kommet inn i kroppen for første gang. Den sekretoriske formen av IgM er hovedklassen av antistoffer som skilles ut i blodet under den primære immunresponsen. Binding av IgM til et antigen endrer konformasjonen av IgM og induserer bindingen til den første proteinkomponenten i komplementsystemet (komplementsystemet er et sett med proteiner som er involvert i ødeleggelsen av antigenet) og aktivering av dette systemet. Hvis antigenet er lokalisert på overflaten av mikroorganismen, forårsaker komplementsystemet et brudd på integriteten til cellemembranen og døden til bakteriecellen.
Immunoglobuliner G
Kvantitativt dominerer denne klassen immunglobuliner i blodet (75 % av all Ig). IgG - monomerer, hovedklassen av antistoffer som skilles ut i blodet under den sekundære immunresponsen. Etter interaksjonen av IgG med overflateantigener til mikroorganismer, er antigen-antistoffkomplekset i stand til å binde og aktivere proteiner i komplementsystemet eller kan samhandle med spesifikke reseptorer på makrofager og nøytrofiler. interaksjon med fagocytter
 Ris. 1.31. Strukturen til den sekretoriske formen av IgM
Ris. 1.31. Strukturen til den sekretoriske formen av IgM
til absorpsjon av antigen-antistoffkomplekser og deres ødeleggelse i fagosomer av celler. IgG er den eneste klassen av antistoffer som kan krysse placentabarrieren og beskytte fosteret mot infeksjoner in utero.
Immunoglobuliner A
Hovedklassen av antistoffer som er tilstede i sekret (melk, spytt, respirasjonssekret og tarmkanalen). IgA utskilles hovedsakelig i dimer form, hvor monomerene er koblet til hverandre gjennom en ekstra J-kjede (fig. 1.32).
IgA samhandler ikke med komplementsystemet og fagocytiske celler, men ved å binde seg til mikroorganismer hindrer antistoffer dem i å feste seg til epitelceller og trenge inn i kroppen.
Immunglobuliner E
Immunoglobuliner E er representert av monomerer hvor tunge ε-kjeder inneholder, samt μ-kjeder av immunglobuliner M, ett variabelt og fire konstante domener. IgE etter sekresjon binder med sine egne
 Ris. 1,32. Struktur av IgA
Ris. 1,32. Struktur av IgA
C-terminale regioner med tilsvarende reseptorer på overflaten av mastceller og basofiler. Som et resultat blir de reseptorer for antigener på overflaten av disse cellene (fig. 1.33).
 Ris. 1,33. Interaksjon av IgE med antigen på overflaten av mastcellen
Ris. 1,33. Interaksjon av IgE med antigen på overflaten av mastcellen
Etter at antigenet er festet til de tilsvarende antigenbindende IgE-stedene, mottar cellene et signal om å skille ut biologisk aktive stoffer (histamin, serotonin), som i stor grad er ansvarlige for utviklingen av den inflammatoriske reaksjonen og for manifestasjonen av slike allergiske reaksjoner som f.eks. astma, urticaria, høysnue.
Immunoglobuliner D
Immunoglobuliner D finnes i serum i svært en liten mengde, de er monomerer. Tunge δ-kjeder har ett variabelt og tre konstante domener. IgD fungerer som reseptorer for B-lymfocytter, andre funksjoner er fortsatt ukjente. Samspillet mellom spesifikke antigener og reseptorer på overflaten av B-lymfocytter (IgD) fører til overføring av disse signalene inn i cellen og aktivering av mekanismer som sikrer reproduksjon av denne klonen av lymfocytter.
TEMA 1.7. FYSISK-KJEMISKE EGENSKAPER TIL PROTEINER OG METODER FOR DERES SEPARERING
1. Individuelle proteiner er forskjellige i deres fysisk-kjemiske egenskaper:
Formen på molekylene;
Molekylær vekt;
Den totale ladningen, hvis verdi avhenger av forholdet mellom anioniske og kationiske grupper av aminosyrer;
Forholdet mellom polare og ikke-polare aminosyreradikaler på overflaten av molekyler;
Grader av motstand mot ulike denatureringsmidler.
2. Løseligheten til proteiner avhenger på egenskapene til proteinene oppført ovenfor, samt på sammensetningen av mediet der proteinet løses opp (pH-verdier, saltsammensetning, temperatur, tilstedeværelsen av andre organiske stoffer som kan interagere med proteinet). Størrelsen på ladningen til proteinmolekyler er en av faktorene som påvirker deres løselighet. Når ladningen går tapt ved det isoelektriske punktet, samler proteiner seg lettere og utfelles. Dette gjelder spesielt for denaturerte proteiner, som har hydrofobe aminosyreradikaler på overflaten.
På overflaten av proteinmolekylet er det både positivt og negativt ladede aminosyreradikaler. Antallet av disse gruppene, og dermed den totale ladningen av proteiner, avhenger av pH i mediet, dvs. forholdet mellom konsentrasjonen av H + - og OH - grupper. I et surt miljø en økning i konsentrasjonen av H+ fører til undertrykkelse av dissosiasjonen av karboksylgrupper -COO - + H+ > -COOH og en reduksjon i den negative ladningen til proteiner. I et alkalisk miljø fører bindingen av overskytende OH - protoner dannet under dissosiasjonen av aminogrupper -NH 3 + + OH - - NH 2 + H 2 O med dannelsen av vann, til en reduksjon i den positive ladningen til proteiner. pH-verdien som et protein har en nettoladning på null kalles isoelektrisk punkt (IEP). I IET er antallet positivt og negativt ladede grupper det samme, dvs. proteinet er i en isoelektrisk tilstand.
3. Separasjon av individuelle proteiner. Funksjoner ved kroppens struktur og funksjon avhenger av settet med proteiner som syntetiseres i den. Studiet av strukturen og egenskapene til proteiner er umulig uten deres isolasjon fra cellen og rensing fra andre proteiner og organiske molekyler. Stadiene for isolering og rensing av individuelle proteiner:
celleødeleggelse av det studerte vevet og oppnå et homogenat.
Separering av homogenatet i fraksjoner sentrifugering, oppnå en kjernefysisk, mitokondriell, cytosolisk eller annen fraksjon som inneholder det ønskede proteinet.
Selektiv varmedenaturering- kortvarig oppvarming av proteinløsningen, hvor en del av de denaturerte proteinurenhetene kan fjernes (i tilfelle proteinet er relativt termisk stabilt).
Salter ut. Ulike proteiner utfelles når forskjellige konsentrasjoner salt i løsning. Ved gradvis å øke saltkonsentrasjonen er det mulig å få en rekke individuelle fraksjoner med et overveiende innhold av det utskilte proteinet i en av dem. Den mest brukte fraksjoneringen av proteiner er ammoniumsulfat. Proteiner med lavest løselighet utfelles ved lave saltkonsentrasjoner.
Gelfiltrering- en metode for å sikte molekyler gjennom hovne Sephadex-granulat (tredimensjonale dekstranpolysakkaridkjeder med porer). Passasjehastigheten for proteiner gjennom en kolonne fylt med Sephadex vil avhenge av molekylvekten deres: jo mindre massen av proteinmolekyler er, jo lettere trenger de inn i granulene og blir der lenger, jo større masse, jo raskere eluerer de fra kolonne.
Ultrasentrifugering- en metode som består i at proteiner i et sentrifugerør plasseres i rotoren til en ultrasentrifuge. Når rotoren roterer, er proporsjonal med deres molekylvekt: de tyngre proteinfraksjonene er plassert nærmere bunnen av røret, de lettere er nærmere overflaten.
elektroforese- en metode basert på forskjeller i bevegelseshastigheten til proteiner i et elektrisk felt. Denne verdien er proporsjonal med ladningen til proteiner. Proteinelektroforese utføres på papir (i dette tilfellet er hastigheten til proteiner bare proporsjonal med ladningen deres) eller i en polyakrylamidgel med en viss porestørrelse (proteinens hastighet er proporsjonal med ladningen og molekylvekten).
Ionebyttekromatografi- en fraksjoneringsmetode basert på binding av ioniserte grupper av proteiner med motsatt ladede grupper av ionebytterharpikser (uløselige polymermaterialer). Bindingsstyrken til et protein til en harpiks er proporsjonal med ladningen til proteinet. Proteiner adsorbert på ionebytterpolymeren kan vaskes av med økende konsentrasjoner av NaCl-løsninger; jo lavere proteinladning, jo lavere konsentrasjon av NaCl vil være nødvendig for å vaske bort proteinet assosiert med iongruppene i harpiksen.
Affinitetskromatografi- den mest spesifikke metoden for å isolere individuelle proteiner En ligand av et protein er kovalent festet til en inert polymer. Når en proteinløsning føres gjennom en kolonne med en polymer, på grunn av den komplementære bindingen av proteinet til liganden, adsorberes kun proteinet spesifikt for denne liganden på kolonnen.
Dialyse- en metode som brukes til å fjerne lavmolekylære forbindelser fra en løsning av et isolert protein. Metoden er basert på proteiners manglende evne til å passere gjennom en semipermeabel membran, i motsetning til lavmolekylære stoffer. Det brukes til å rense proteiner fra urenheter med lav molekylvekt, for eksempel fra salter etter utsalting.
OPPDRAG TIL EKSTRA KURSARBEID
1. Fyll ut tabellen. 1.4.
Tabell 1.4. Komparativ analyse av strukturen og funksjonene til relaterte proteiner - myoglobin og hemoglobin
a) husk strukturen til det aktive senteret Mb og Hb. Hvilken rolle spiller de hydrofobe radikalene til aminosyrer i dannelsen av de aktive sentrene til disse proteinene? Beskriv strukturen til Mb og Hb aktive senter og mekanismene for ligandbinding til det. Hvilken rolle spiller His F 8 og His E 7 rester i funksjonen til Mv og Hv aktive sete?
b) hvilke nye egenskaper sammenlignet med monomert myoglobin har et nært beslektet oligomert protein, hemoglobin? Forklar rollen til kooperative endringer i konformasjonen av protomerer i hemoglobinmolekylet, effekten av CO 2 og protonkonsentrasjoner på affiniteten til hemoglobin til oksygen, og rollen til 2,3-BPG i allosterisk regulering av Hb-funksjon.
2. Beskriv egenskapene til molekylære chaperoner, og vær oppmerksom på forholdet mellom deres struktur og funksjon.
3. Hvilke proteiner er gruppert i familier? Ved å bruke eksemplet med immunglobulinfamilien, bestemme de lignende strukturelle egenskapene og relaterte funksjonene til proteinene i denne familien.
4. Ofte kreves rensede individuelle proteiner for biokjemiske og medisinske formål. Forklar på hvilke fysisk-kjemiske egenskaper til proteiner metodene som brukes for deres separasjon og rensing er basert på.
OPPGAVER FOR SELVKONTROLL
1. Velg de riktige svarene.
Funksjoner av hemoglobin:
A. O 2 transport fra lunger til vev B. H + transport fra vev til lunger
B. Opprettholde en konstant pH i blodet D. Transport av CO2 fra lungene til vev
D. Transport av CO 2 fra vev til lungene
2. Velg de riktige svarene. ligandα -Hb protomer er: A. Heme
B. Oksygen
B. CO D. 2,3-BPG
D. β-Protomer
3. Velg de riktige svarene.
Hemoglobin er forskjellig fra myoglobin:
A. Har en kvartær struktur
B. Den sekundære strukturen er kun representert av α-helikser
B. Refererer til komplekse proteiner
D. Samvirker med en allosterisk ligand D. Kovalent bundet til hem
4. Velg de riktige svarene.
Affiniteten til Hb for O 2 avtar:
A. Når ett O 2 molekyl er festet B. Når ett O 2 molekyl er eliminert
B. Når du samhandler med 2,3-BPG
D. Når festet til protomerene H + D. Når konsentrasjonen av 2,3-BPG synker
5. Sett en kamp.
For typer Hb er det karakteristisk:
A. Danner fibrillære aggregater i deoksyform B. Inneholder to α- og to δ-kjeder
B. Den dominerende formen av Hb i voksne erytrocytter D. Den inneholder hem med Fe + 3 i det aktive senteret
D. Inneholder to α- og to γ-kjeder 1. HvA 2.
6. Sett en kamp.
Ligander Hb:
A. Bindes til Hb ved det allosteriske senteret
B. Har en veldig høy affinitet for det aktive nettstedet Hb
B. Sammenføyning, øker affiniteten til Hb til O 2 D. Oksiderer Fe + 2 til Fe + 3
D. Danner en kovalent binding med hysF8
7. Velg de riktige svarene.
Ledere:
A. Proteiner som finnes i alle deler av cellen
B. Syntese forsterkes under stressende påvirkninger
B. Delta i hydrolysen av denaturerte proteiner
D. Delta i å opprettholde den native konformasjonen av proteiner
D. Lag organeller der proteinkonformasjon dannes
8. Match. Immunoglobuliner:
A. Den sekretoriske formen er pentamerisk
B. Ig-klasse som krysser placentabarrieren
B. Ig - mastcellereseptor
D. Hovedklassen av Ig som er tilstede i utskillelsen av epitelceller. D. B-lymfocyttreseptor, hvis aktivering sikrer cellereproduksjon
9. Velg de riktige svarene.
Immunglobuliner E:
A. Produsert av makrofager B. Har tunge ε-kjeder.
B. Innebygd i membranen til T-lymfocytter
D. Fungerer som membranreseptorer for antigener på mastceller og basofiler
D. Ansvarlig for manifestasjon av allergiske reaksjoner
10. Velg de riktige svarene.
Metoden for å separere proteiner er basert på forskjeller i deres molekylvekt:
A. Gelfiltrering
B. Ultrasentrifugering
B. Polyakrylamidgelelektroforese D. Ionebytterkromatografi
D. Affinitetskromatografi
11. Velg det riktige svaret.
Metoden for å separere proteiner er basert på forskjeller i deres løselighet i vann:
A. Gelfiltrering B. Utsalting
B. Ionebytterkromatografi D. Affinitetskromatografi
E. Polyakrylamidgelelektroforese
STANDARDER FOR SVAR PÅ "OPPGAVER FOR SELVKONTROLL"
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-G
6. 1-C, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-C
GRUNNLEGGENDE VILKÅR OG KONSEPT
1. Oligomere proteiner, protomer, kvaternær struktur av proteiner
2. Kooperative endringer i protomer-konformasjon
3. Bohr-effekt
4. Allosterisk regulering av proteinfunksjoner, allosterisk senter og allosterisk effektor
5. Molecular chaperones, varmesjokkproteiner
6. Proteinfamilier (serinproteaser, immunoglobuliner)
7. IgM-, G-, E-, A-forbindelse av struktur med funksjon
8. Total ladning av proteiner, isoelektrisk punkt av proteiner
9. Elektroforese
10. Salting ut
11. Gelfiltrering
12. Ionebytterkromatografi
13. Ultrasentrifugering
14. Affinitetskromatografi
15. Plasmaproteinelektroforese
OPPGAVER TIL AUDITIONELL ARBEID
1. Sammenlign avhengighetene av metningsgradene for hemoglobin (Hb) og myoglobin (Mb) med oksygen på dets partialtrykk i vev
 Ris. 1,34. Metningsavhengighet av MV ogHboksygen fra partialtrykket
Ris. 1,34. Metningsavhengighet av MV ogHboksygen fra partialtrykket
Vær oppmerksom på at formen på proteinoksygenmetningskurvene er forskjellig: for myoglobin - hyperbole, for hemoglobin - sigmoidform.
1. Sammenlign verdiene for partialtrykket av oksygen der Mb og Hb er mettet med O 2 med 50 %. Hvilket av disse proteinene har en høyere affinitet for O 2 ?
2. Hvilke strukturelle trekk ved MB bestemmer dens høye affinitet for O 2 ?
3. Hvilke strukturelle trekk ved Hb gjør at den frigjør O 2 i kapillærene i hvilevev (ved et relativt høyt partialtrykk på O 2) og øker denne returen kraftig i arbeidende muskler? Hvilken egenskap ved oligomere proteiner gir denne effekten?
4. Regn ut hvor mye O 2 (i %) som gir oksygenert hemoglobin til hvilende og arbeidende muskel?
5. trekke konklusjoner om sammenhengen mellom proteinstruktur og dets funksjon.
2. Mengden oksygen som frigjøres av hemoglobin i kapillærene avhenger av intensiteten av katabolismeprosesser i vev (Bohr-effekten). Hvordan regulerer endringer i vevsmetabolismen affiniteten til Hb for O 2 ? Effekt av CO 2 og H+ på affiniteten til Hb til O 2
 1. Beskriv Bohr-effekten.
1. Beskriv Bohr-effekten.
2. i hvilken retning flyter prosessen vist i diagrammet:
a) i kapillærene i lungene;
b) i vevskapillærer?
3. Hva er den fysiologiske betydningen av Bohr-effekten?
4. Hvorfor endrer interaksjonen av Hb med H+ på steder fjernt fra hem affiniteten til proteinet for O 2 ?
3. Affiniteten til Hb til O 2 avhenger av konsentrasjonen av liganden, 2,3-bifosfoglyserat, som er en allosterisk regulator av affiniteten til Hb til O 2 . Hvorfor påvirker ligandinteraksjon på et sted fjernt fra det aktive stedet proteinfunksjonen? Hvordan regulerer 2,3-BPG affiniteten til Hb for O 2 ? For å løse problemet, svar på følgende spørsmål:
1. Hvor og fra hva syntetiseres 2,3-bifosfoglyserat (2,3-BPG)? Skriv formelen, angi ladningen til dette molekylet.
2. Hvilken form for hemoglobin (oksy eller deoksy) interagerer BPG med og hvorfor? I hvilken region av Hb-molekylet finner interaksjonen sted?
3. i hvilken retning går prosessen vist i diagrammet?
a) i vevskapillærer;
b) i kapillærene i lungene?
4. hvor skal være den høyeste konsentrasjonen av komplekset
Nv-2,3-BFG:
a) i kapillærene til musklene i hvile,
b) i kapillærene til arbeidende muskler (forutsatt samme konsentrasjon av BPG i erytrocytter)?
5. Hvordan vil affiniteten til Hb for oksygen endre seg når en person tilpasser seg høye høydeforhold, hvis konsentrasjonen av BPG i erytrocytter øker? Hva er den fysiologiske betydningen av dette fenomenet?
4. Ødeleggelsen av 2,3-BPG under lagring av konservert blod forstyrrer funksjonene til Hb. Hvordan vil affiniteten til Hb til O 2 i bevart blod endre seg dersom konsentrasjonen av 2,3-BPG i erytrocytter kan reduseres fra 8 til 0,5 mmol/l. Er det mulig å overføre slikt blod til alvorlig syke pasienter hvis konsentrasjonen av 2,3-BPG er gjenopprettet tidligst etter tre dager? Er det mulig å gjenopprette funksjonene til erytrocytter ved å tilsette 2,3-BPG til blodet?
5. Husk strukturen til de enkleste immunoglobulinmolekylene. Hvilken rolle spiller immunglobuliner i immunsystemet? Hvorfor blir Igs ofte referert til som bivalente? Hvordan er strukturen til Ig'er relatert til funksjonen deres? (Beskriv ved å bruke et eksempel på en klasse immunglobuliner.)
Fysisk-kjemiske egenskaper til proteiner og metoder for deres separasjon.
6. Hvordan påvirker nettoladningen til et protein dets løselighet?
a) Bestem den totale ladningen av peptidet ved pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) hvordan vil ladningen til dette peptidet endre seg ved pH >7, pH<7, рН <<7?
c) hva er det isoelektriske punktet til et protein (IEP) og i hvilket miljø ligger det
IET av dette peptidet?
d) ved hvilken pH-verdi vil den minste løseligheten av dette peptidet bli observert.
7. Hvorfor "koagulerer" surmelk, i motsetning til fersk melk, når den kokes (dvs. kaseinmelkprotein feller ut)? Kaseinmolekyler i fersk melk har en negativ ladning.
8. Gelfiltrering brukes til å skille individuelle proteiner. En blanding inneholdende proteinene A, B, C med molekylmasser lik henholdsvis 160 000, 80 000 og 60 000 ble analysert ved gelfiltrering (Fig. 1.35). Hovne gelgranulat er permeable for proteiner med en molekylvekt på mindre enn 70 000. Hvilket prinsipp ligger til grunn for denne separasjonsmetoden? Hvilken av grafene representerer riktig resultat av fraksjonering? Spesifiser rekkefølgen for frigjøring av proteinene A, B og C fra kolonnen.
 Ris. 1,35. Bruke gelfiltreringsmetoden for å skille proteiner
Ris. 1,35. Bruke gelfiltreringsmetoden for å skille proteiner
9. På fig. 1.36, A viser et diagram over elektroforese på papir av proteiner i blodserumet til en frisk person. De relative mengder av proteinfraksjoner oppnådd ved bruk av denne metoden er: albuminer 54-58%, α1-globuliner 6-7%, α2-globuliner 8-9%, β-globuliner 13%, y-globuliner 11-12%.
 Ris. 1.36 Elektroforese på papir av blodplasmaproteiner fra en frisk person (A) og en pasient (B)
Ris. 1.36 Elektroforese på papir av blodplasmaproteiner fra en frisk person (A) og en pasient (B)
I - y-globuliner; II - β-globuliner; III -α 2 - globulin; IV-α 2 - globulin; V - albuminer
Mange sykdommer er ledsaget av kvantitative endringer i sammensetningen av myseproteiner (dysproteinemi). Arten av disse endringene tas i betraktning når man stiller en diagnose og vurderer alvorlighetsgraden og stadiet av sykdommen.
Bruke dataene gitt i tabellen. 1.5, foreta en antagelse om sykdommen, som er preget av den elektroforetiske profilen presentert i fig. 1,36.
Tabell 1.5. Endringer i konsentrasjonen av blodserumproteiner i patologi
Emne: TRANSMEMBRANOVERFØRING
Intracellulære reseptorer: https://www.youtube.com/watch?v=Nm9u4lNCPyM
Metabotropiske membranreseptorer assosiert med det andre messenger-systemet: https://www.youtube.com/watch?v=dQ4yVuLAbH0
Metabotropiske membranreseptorer assosiert med tyrosinkinaseaktivitet:
Typer transmembranoverføring.
Typer transmembrane transportkanaler.
Konseptet med polare og ikke-polare stoffer.
Transmembran selektiv permeabilitet opprettholder cellulær homeostase, det optimale innholdet av ioner, vann, enzymer og substrater i cellen. Måter å implementere selektiv membranpermeabilitet på: passiv transport, katalysert transport (tilrettelagt diffusjon), aktiv transport. Den hydrofobe naturen til kjernen av dobbeltlaget bestemmer muligheten (eller umuligheten) for direkte penetrasjon gjennom membranen til forskjellige stoffer fra et fysisk-kjemisk synspunkt (primært polar og ikke-polar).
Ikke-polare stoffer(for eksempel kolesterol og dets derivater) trenger fritt inn i biologiske membraner. Av denne grunn oppstår endocytose og eksocytose av polare forbindelser (for eksempel peptidhormoner) ved hjelp av membranvesikler, mens utskillelsen av steroidhormoner skjer uten deltakelse av slike vesikler. Av samme grunn er reseptorer for ikke-polare molekyler (for eksempel steroidhormoner) plassert inne i cellen.
polare stoffer(f.eks. proteiner og ioner) kan ikke krysse biologiske membraner. Det er derfor reseptorer for polare molekyler (for eksempel peptidhormoner) er bygget inn i plasmamembranen, og signaloverføring til andre cellerom utføres av andre budbringere. Av samme grunn utføres transmembranoverføring av polare forbindelser av spesielle systemer innebygd i biologiske membraner.
Selektiv permeabilitet tilveiebringes av cellemembranen; reseptorfunksjonen implementeres av glykoproteiner, hvis karbohydratdeler er lokalisert i glykokalyxen; fibrillære og rørformede proteiner i submembranlaget gir formretensjon og mobilitet, etc.
Konsept av reseptor og ligand
Cellereseptor- et molekyl på overflaten av en celle, kjerne, celleorganeller eller oppløst i cytoplasma. Cellereseptoren reagerer spesifikt ved å endre sin romlige konfigurasjon (form) til festingen av et molekyl av et bestemt kjemisk stoff til det - ligand sender et eksternt kontrollsignal. Dette overfører igjen dette signalet til det indre av cellen eller celleorganellen. Stedet på reseptoren der den fester seg ligand kalles et sted. Den samme reseptoren kan ha flere steder. Cellulære reseptorer kan deles inn i to hovedklasser - membranreseptorer (plassert på membranen som skiller cellen fra det ytre miljøet) og intracellulære reseptorer.
Et stoff som binder seg spesifikt til en reseptor kalles ligand (budbringer) denne reseptoren. Dermed er en ligand (synonym: budbringer) et kjemisk stoff som er i stand til å samhandle med en reseptor. Resultatet av denne interaksjonen kan være annerledes. Hvis en ligand (budbringer) fører til en formendring reseptoren og dens aktivering kalles en agonist . Hvis liganden (budbringeren) endrer formen (konformasjonen) av reseptoren og blokkere denne reseptoren, den kalles en antagonist.
Når det gjelder sanseorganer, er ligander (budbringere) stoffer som virker på lukt- eller smaksreseptorer.
Det er også termosensitive reseptorproteiner og reseptorproteiner som reagerer på endringer i membranpotensial.
Reseptorer for vannløselige ligander (budbringere) - proteinhormoner, adrenalin, noradrenalin - er plassert på overflaten av membranen (membranreseptorer), dette skyldes det faktum at hydrofile ligander ikke kan passere gjennom den hydrofobe overflaten av membranen. Fettløselige ligander (budbringere) passerer lett gjennom fosfolipid-dobbeltlaget i cellemembranen og cellekjernen, og derfor har cellen reseptorer (intracellulære reseptorer) for dem inne: på organeller, kjernen. Eksempler på fettløselige ligander kan være steroidhormoner i binyrene, gonader.
I tillegg kan ligander separeres til eksogene(kommer utenfra) og endogene(produsert inne i kroppen). Som regel, hvis et eksogent stoff har reseptorer på celler, er det endogene ligander for denne reseptoren i kroppen. Så, for eksempel, er den endogene liganden av cannabinoidreseptorer, som hamp-alkaloider binder seg til, stoffet anandamid, produsert av kroppen fra arakidonfettsyre. Eller endorfinreseptorer (spiller en viktig rolle i dannelsen av smerte og følelsesmessig tilstand): de kan forbindes med endogene ligander - endorfiner, eller de kan binde seg til medisiner fra morfingruppen.
Den høye spesifisiteten til proteinbinding til liganden er gitt av komplementariteten til strukturen til det aktive setet til proteinet med strukturen til liganden
Komplementaritet forstås som romlig og kjemisk korrespondanse mellom interagerende molekyler. Liganden må kunne gå inn og romlig sammenfalle med konformasjonen til det aktive stedet. Denne tilfeldigheten er kanskje ikke fullstendig, men på grunn av proteinets konformasjonslabilitet er det aktive senteret i stand til små endringer og er "tilpasset" til liganden. I tillegg, mellom de funksjonelle gruppene til liganden og aminosyreradikalene som danner det aktive senteret, bør det være bindinger som holder liganden i det aktive senteret. Bindingene mellom liganden og det aktive senteret av proteinet kan enten være ikke-kovalente (ionisk, hydrogen, hydrofob) eller kovalent.
1. Kjennetegn ved det aktive senteret
Det aktive senteret til et protein er et sted, relativt isolert fra miljøet rundt proteinet, dannet av aminosyrerester. I dette området danner hver rest, på grunn av sin individuelle størrelse og funksjonelle grupper, "avlastningen" til det aktive senteret.
Å kombinere slike aminosyrer til et enkelt funksjonelt kompleks endrer reaktiviteten til radikalene deres, akkurat som lyden til et musikkinstrument endres i et ensemble. Derfor blir aminosyrerestene som utgjør det aktive stedet ofte referert til som et "ensemble" av aminosyrer.
De unike egenskapene til det aktive senteret avhenger ikke bare av de kjemiske egenskapene til aminosyrene som danner det, men også av deres nøyaktige gjensidige orientering i rommet. Derfor kan selv små forstyrrelser i den generelle konformasjonen til et protein som følge av punktendringer i dets primære struktur eller miljøforhold føre til en endring i de kjemiske og funksjonelle egenskapene til radikalene som danner det aktive senteret, forstyrre bindingen av protein til liganden og dens funksjon. Under denaturering blir det aktive senteret av proteiner ødelagt, og deres biologiske aktivitet går tapt.
Det aktive senteret er ofte dannet på en slik måte at tilgangen til vann til de funksjonelle gruppene til dets radikaler er begrenset; det skapes betingelser for å binde liganden til aminosyreradikaler.
I noen tilfeller er liganden festet til bare ett av atomene som har en viss reaktivitet, for eksempel tilsetning av O 2 til jernet av myoglobin eller hemoglobin. Imidlertid bestemmes egenskapene til et gitt atom for å selektivt samhandle med O 2 av egenskapene til radikalene som omgir jernatomet i sammensetningen av emnet. Hem finnes også i andre proteiner, for eksempel cytokromer. Imidlertid er funksjonen til jernatomet i cytokromer forskjellig, det fungerer som et mellomledd for overføring av elektroner fra ett stoff til et annet, mens jern blir toverdig eller treverdig.
Hovedegenskapen til proteiner som ligger til grunn for funksjonene deres er selektiviteten til å feste spesifikke ligander til visse deler av proteinmolekylet.
2. Variasjon av ligander
Ligander kan være uorganiske (ofte metallioner) og organiske stoffer, stoffer med lav molekylvekt og høy molekylvekt;
det er ligander som endrer sin kjemiske struktur når de er festet til det aktive senteret av proteinet (substratendringer i det aktive senteret av enzymet);
det er ligander som fester seg til proteinet bare når det fungerer (for eksempel O 2 transportert av hemoglobin), og ligander som hele tiden er assosiert med proteinet og spiller en hjelperolle i funksjonen til proteiner (for eksempel jern, som er en del av hemoglobin).
I de tilfellene når aminosyrerestene som danner det aktive senteret ikke kan sikre funksjonen til dette proteinet, kan ikke-proteinmolekyler feste seg til visse deler av det aktive senteret. Så i det aktive sentrum av mange enzymer er det et metallion (kofaktor) eller et organisk ikke-proteinmolekyl (koenzym). Ikke-proteindelen, sterkt assosiert med det aktive stedet til proteinet og nødvendig for dets funksjon, kalles "prostatagruppen". Myoglobin, hemoglobin og cytokromer har en protesegruppe i det aktive senteret - hem som inneholder jern.
Koblingen av protomerer i et oligomert protein er et eksempel på interaksjonen mellom høymolekylære ligander. Hver protomer koblet til andre protomerer fungerer som en ligand for dem, akkurat som de er for den.
Noen ganger endrer tilsetningen av en ligand konformasjonen av proteinet, noe som resulterer i dannelsen av et bindingssted med andre ligander. For eksempel får kalmodulinproteinet, etter binding til fire Ca 2+ -ioner i spesifikke områder, evnen til å interagere med visse enzymer og endre deres aktivitet.
8. Kvartær struktur av proteiner. Funksjoner av strukturen og funksjonen til oligomere proteiner på eksemplet med hemoglobin. Kooperative endringer i protomerkonformasjon. Mulighet for regulering av den biologiske funksjonen til oligomere proteiner ved allosteriske ligander.
Under den kvartære strukturen menes en måte å legge i rommet individuelle polypeptidkjeder med samme (eller forskjellige) primære, sekundære eller tertiære strukturer, og dannelsen av en enkelt makromolekylær formasjon i strukturelle og funksjonelle henseender. Mange funksjonelle proteiner består av flere polypeptidkjeder koblet ikke med kovalente bindinger, men av ikke-kovalente bindinger (ligner på de som gir stabilitet til den tertiære strukturen). Hver enkelt polypeptidkjede, kalt en protomer, monomer eller underenhet, har oftest ikke biologisk aktivitet. Et protein tilegner seg denne evnen med en viss måte for romlig assosiasjon av dets konstituerende protomerer, dvs. det er en ny kvalitet som ikke er karakteristisk for et monomert protein. Det resulterende molekylet kalles vanligvis en oligomer (eller multimer). Oligomere proteiner bygges ofte av et jevnt antall protomerer (fra 2 til 4, sjelden fra 6 til 8) med samme eller forskjellige molekylvekter - fra flere tusen til hundretusener. Spesielt består hemoglobinmolekylet av to identiske α- og to β-polypeptidkjeder, dvs. er en tetramer.
Kooperative endringer i protomerkonformasjon.
En endring i konformasjonen og følgelig i de funksjonelle egenskapene til alle protomerer av et oligomert protein når en ligand er festet til bare en av dem, kalles kooperative endringer i konformasjonen til protomerene.
Allosterisk regulering . Enzymet endrer aktivitet gjennom en ikke-kovalent assosiert effektor. Bindingen skjer i området, romlig fjernt fra det aktive (katalytiske) stedet. Denne bindingen forårsaker en konformasjonsendring i proteinmolekylet, noe som fører til en endring i den spesifikke geometrien til det katalytiske stedet. Aktiviteten kan øke - dette er enzymaktivering, eller avta - dette er hemming "Beskjeden" om tilknytningen til den allosteriske aktivatoren overføres gjennom konformasjonsendringer til den katalytiske underenheten, som blir komplementær til substratet, og enzymet "snus" på". Når aktivatoren fjernes, går enzymet igjen inn i en inaktiv form og "slår seg av". Allosterisk regulering er hovedmåten for regulering av metabolske veier.
Biologisk kjemi Lelevich Vladimir Valeryanovich
Funksjon av proteiner
Funksjon av proteiner
Hvert enkelt protein, som har en unik primær struktur og konformasjon, har også en unik funksjon som skiller det fra alle andre proteiner. Et sett med individuelle proteiner utfører mange forskjellige og komplekse funksjoner i cellen.
En nødvendig betingelse for funksjonen til proteiner er tilsetning av et annet stoff til det, som kalles en ligand. Ligander kan være både lavmolekylære stoffer og makromolekyler. Interaksjonen mellom et protein og en ligand er svært spesifikk, som bestemmes av strukturen til en proteinregion kalt protein-ligand-bindingssetet eller det aktive stedet.
Det aktive senteret av proteiner og selektiviteten til dets binding til liganden
Det aktive senteret av proteiner er en spesifikk region av et proteinmolekyl, vanligvis plassert i fordypningen, dannet av aminosyreradikaler satt sammen i en viss romlig region under dannelsen av en tertiær struktur og i stand til komplementær binding til en ligand. I den lineære sekvensen til polypeptidkjeden kan radikalene som danner det aktive senteret være lokalisert i betydelig avstand fra hverandre.
Den høye spesifisiteten til proteinbinding til liganden er gitt av komplementariteten til strukturen til det aktive sentrum av proteinet og strukturen til liganden.
Komplementaritet forstås som romlig og kjemisk korrespondanse mellom interagerende molekyler. Liganden må kunne gå inn og romlig sammenfalle med konformasjonen til det aktive stedet. Denne matchingen er kanskje ikke fullstendig, men på grunn av proteinets konformasjonslabilitet er det aktive stedet i stand til små endringer og "passer" til liganden. I tillegg, mellom de funksjonelle gruppene til liganden og aminosyreradikalene som danner det aktive senteret, bør det være bindinger som holder liganden i det aktive senteret. Bindingene mellom liganden og det aktive senteret av proteinet kan enten være ikke-kovalente (ionisk, hydrogen, hydrofob) eller kovalent.
Kjennetegn på det aktive senteret
Det aktive senteret til et protein er et sted, relativt isolert fra miljøet rundt proteinet, dannet av aminosyrerester. I dette området danner hver rest, på grunn av sin individuelle størrelse og funksjonelle grupper, "avlastningen" til det aktive senteret.
De unike egenskapene til det aktive senteret avhenger ikke bare av de kjemiske egenskapene til aminosyrene som danner det, men også av deres nøyaktige gjensidige orientering i rommet. Derfor kan selv små forstyrrelser i den generelle konformasjonen til et protein som følge av punktendringer i dets primære struktur eller miljøforhold føre til en endring i de kjemiske og funksjonelle egenskapene til radikalene som danner det aktive senteret, forstyrre bindingen av protein til liganden og dens funksjon. Under denaturering blir det aktive senteret av proteiner ødelagt, og deres biologiske aktivitet går tapt.
Det aktive senteret er ofte dannet på en slik måte at tilgangen til vann til de funksjonelle gruppene til dets radikaler er begrenset; det skapes betingelser for å binde liganden til aminosyreradikaler.
Bindingsstedet til et protein til en ligand er ofte lokalisert mellom domener. For eksempel har det proteolytiske enzymet trypsin, som er involvert i hydrolyse av peptidbindinger av matproteiner i tarmen, 2 domener atskilt med en rille. Den indre overflaten av sporet er dannet av aminosyreradikalene til disse domenene, som er langt fra hverandre i polypeptidkjeden (Ser177, His40, Asp85).
Ulike domener i et protein kan bevege seg i forhold til hverandre når de interagerer med en ligand, noe som letter proteinets videre funksjon. Hovedegenskapen til proteiner som ligger til grunn for deres funksjoner, er selektiviteten for binding av spesifikke ligander til visse deler av proteinmolekylet.
Variasjon av ligander:
1. Ligander kan være uorganiske (ofte metallioner) og organiske stoffer, stoffer med lav molekylvekt og høy molekylvekt;
2. det er ligander som endrer sin kjemiske struktur når de festes til proteinets aktive senter (substratendringer i enzymets aktive senter);
3. Det er ligander som fester seg til proteinet kun på funksjonstidspunktet (for eksempel O 2 transportert av hemoglobin), og ligander som er permanent assosiert med proteinet og spiller en hjelperolle i funksjonen til proteiner (f.eks. jern, som er en del av hemoglobin).
Fra boken Dog Breeding forfatter Kovalenko Elena EvgenievnaReproduksjonssystemets funksjon Aktiviteten til reproduksjonssystemet reguleres av hormoner - stoffer av proteinnatur med høy biologisk aktivitet og handlingselektivitet. Det er disse egenskapene til hormoner som gir humoral kommunikasjon mellom organer,
Fra boken Age Anatomy and Physiology forfatter Antonova Olga Alexandrovna4.5. Ryggmargens struktur og funksjon Ryggmargen er en lang ledning (hos en voksen) ca 45 cm lang. Øverst går den over i medulla oblongata, nederst (i området av I-II lumbale vertebrae) ryggmargen blir smalere og har form som en kjegle,
Fra boken Biology [En komplett veiledning til forberedelse til eksamen] forfatter Lerner Georgy Isaakovich4.6. Hjernens struktur og funksjon
Fra boken The Missing Link forfatter Edie Maitland Fra boken Samtaler om livet forfatter Galaksjonov Stanislav GennadievichFamily Tree (Protein Evidence) Family Tree (Protein Evidence) Forskjeller i proteinene til to arter gjenspeiler evolusjonære endringer i disse artene etter at de ble separert fra en felles stamfar. Analysen viser at mellom sjimpanse blod serum albuminer
Fra boken Evolution [Klassiske ideer i lys av nye oppdagelser] forfatterKapittel 2. Proteiners molekylære arkitektur La oss ikke skjule det: Etter å ha fullført det første kapittelet, opplevde forfatterne (og muligens leseren) en viss lettelse. Tross alt var formålet bare å gi leseren den informasjonen som er nødvendig for å forstå de følgende kapitlene,
Fra boken Human Evolution. Bok 1. Aper, bein og gener forfatter Markov Alexander VladimirovichUniverset av eldgamle proteiner fortsetter å utvides I 2010 publiserte Nature en interessant artikkel om den evolusjonære bevegelsen av proteiner på tvers av treningslandskap (Povolotskaya og Kondrashov, 2010). Forfatterne av arbeidet bestemte seg for å sammenligne aminosyresekvensene til 572 eldgamle proteiner,
Fra boken Biologisk kjemi forfatter Lelevich Vladimir ValeryanovichProteinendringer De delene av genomet som koder for proteiner har endret seg overraskende lite. Forskjeller i aminosyresekvensene til proteiner hos mennesker og sjimpanser er betydelig mindre enn 1 %, og av disse få forskjellene gjør de fleste av dem enten ikke
Fra forfatterens bokKapittel 2. Strukturen og funksjonene til proteiner Proteiner er høymolekylære nitrogenholdige organiske forbindelser, bestående av aminosyrer koblet til polypeptidkjeder ved hjelp av peptidbindinger, og som har en kompleks strukturell organisering Historie om studiet av proteiner I 1728
Fra forfatterens bokNivåer av strukturell organisering av proteiner Primærstrukturen er en strengt definert lineær sekvens av aminosyrer i en polypeptidkjede.De strategiske prinsippene for å studere primærstrukturen til et protein har gjennomgått betydelige endringer som utvikling og
Fra forfatterens bokPost-translasjonelle endringer i proteiner Mange proteiner syntetiseres i en inaktiv form (forløpere) og, etter sammenslåing med ribosomer, gjennomgår de postsyntetiske strukturelle modifikasjoner. Disse konformasjons- og strukturendringene i polypeptidkjeder
Fra forfatterens bokKapittel 23 Den dynamiske tilstanden til kroppsproteiner Betydningen av aminosyrer for kroppen ligger først og fremst i det faktum at de brukes til syntese av proteiner, hvis metabolisme inntar en spesiell plass i metabolismens prosesser mellom kroppen og
Fra forfatterens bokFordøyelse av proteiner i mage-tarmkanalen Fordøyelse av proteiner begynner i magen under påvirkning av enzymer i magesaften. Opptil 2,5 liter frigjøres per dag, og det skiller seg fra andre fordøyelsessafter i en sterkt sur reaksjon på grunn av tilstedeværelsen
Fra forfatterens bokSpaltning av proteiner i vev Det utføres ved hjelp av proteolytiske lysosomale enzymer katepsiner. I henhold til strukturen til det aktive senteret skilles katepsiner fra cystein, serin, karboksyl og metalloprotein. Katepsinenes rolle: 1. opprettelse av biologisk aktive
Fra forfatterens bokLeverens rolle i metabolismen av aminosyrer og proteiner Leveren spiller en sentral rolle i metabolismen av proteiner og andre nitrogenholdige forbindelser. Den utfører følgende funksjoner: 1. syntese av spesifikke plasmaproteiner: - i leveren syntetiseres: 100% albumin, 75 - 90% ?-globuliner, 50%
Fra forfatterens bokKarakterisering av blodserumproteiner Proteiner i komplementsystemet - dette systemet inkluderer 20 proteiner som sirkulerer i blodet i form av inaktive forløpere. Aktiveringen deres skjer under påvirkning av spesifikke stoffer med proteolytisk aktivitet.
1 I uorganisk kjemi
o 1.1 Nomenklatur av ligander
o 1.2 Kjennetegn ved ligander
§ 1.2.1 Elektronisk struktur
§ 1.2.2 Tannlege
§ 1.2.3 Metoder for koordinering
2 notater
I uorganisk kjemi
Oftest skjer slik binding med dannelsen av den såkalte "koordinasjons" donor-akseptorbindingen, hvor liganden fungerer som en Lewis-base, det vil si at de er donorer av et elektronpar. Når ligander festes til sentralatomet, gjennomgår de kjemiske egenskapene til kompleksdannende middel og liganden i seg selv ofte betydelige endringer.
Ligandnomenklatur[rediger | rediger wikitekst]
1. den første i navnet på forbindelsen i nominativ kasus er anion, og deretter i genitiv - kation
2. i navnet til det komplekse ionet er ligandene oppført først i alfabetisk rekkefølge, og deretter det sentrale atomet
3. Sentralatomet i nøytrale kationiske komplekser kalles det russiske navnet, og i anioner roten til det latinske navnet med suffikset "at". Etter navnet på sentralatomet er oksidasjonstilstanden indikert.
4. Antall ligander festet til sentralatomet er indikert med prefiksene "mono", "di", "tre", "tetra", "penta", etc.
Egenskaper til ligander[rediger | rediger wikitekst]
Elektronisk struktur[rediger | rediger wikitekst]
Faktisk, den viktigste egenskapen til liganden, som lar en evaluere og forutsi dens evne til kompleks dannelse og selvdestruksjon av D-orbital - ødeleggelsen av forbindelsen som helhet. I den første tilnærmingen inkluderer den antall elektronpar som liganden er i stand til å allokere for å lage koordinasjonsbindinger og elektronegativiteten til det donerende atomet eller den funksjonelle gruppen.
Tannlege[rediger | rediger wikitekst]
Antallet koordinasjonssteder for det sentrale atomet (eller atomene) okkupert av liganden kalles dentisitet (otlat. hi, bulk- - tann). Ligander som okkuperer ett koordinasjonssted kalles mono tannlege (for eksempel N H 3), to - bi dentat (oksalatanion [ O-C(=O)-C(=O) -O] 2−). Ligander som kan okkupere et større antall plasser er vanligvis betegnet som poly dentate. For eksempel etylendiamintetraeddiksyre (EDTA), som kan okkupere seks koordinasjonssteder.
I tillegg til dentisitet er det en karakteristikk som gjenspeiler antall ligandatomer assosiert med ett koordinasjonssted til sentralatomet. I engelsk litteratur er det betegnet med ordet lykke og har nomenklaturbetegnelsen η med tilsvarende hevet skrift. Selv om hun tilsynelatende ikke har et veletablert begrep på russisk, kan man i noen kilder finne sporingspapir "haptness". Som et eksempel kan vi gi en cyklopentadienylligand i metallsenterkomplekser, som okkuperer ett koordinasjonssted (det vil si at det er monodentat) og er bundet gjennom alle fem karbonatomer: η 5 - - .
Metoder for koordinering[rediger | rediger wikitekst]

Chelatkompleks EDTA 4−
Ligander med mer enn to dentisiteter er i stand til å dannes chelatkomplekser(gresk χηλή - klo) - komplekser hvor sentralatomet er inkludert i en eller flere sykluser med ligandmolekylet. Slike ligander kalles chelatering. Som et eksempel kan vi nevne tetraanionkomplekser av samme EDTA, og bemerker at flere av de fire M-O-bindingene i den formelt kan være ionisk.
Ved dannelse av chelatkomplekser observeres det ofte chelateffekt- deres større stabilitet sammenlignet med lignende komplekser av ikke-chelaterende ligander. Det oppnås på grunn av større skjerming av sentralatomet fra substituerende påvirkninger og entropieffekten. For eksempel er dissosiasjonskonstanten til ammoniakkkomplekset av kadmium 2+ nesten 1500 ganger mindre enn for komplekset med etylendiamin 2+. Grunnen til dette er at når et hydratisert kadmium(II)-ion interagerer med etylendiamin, fortrenger to ligandmolekyler fire vannmolekyler. I dette tilfellet øker antallet frie partikler i systemet betydelig, og entropien til systemet øker (og den interne rekkefølgen til komplekset øker tilsvarende). Det vil si at årsaken til chelateffekten er en økning i entropien til systemet når monodentate ligander erstattes av polydentate og, som et resultat, en reduksjon i Gibbs-energien.

Porfyrin syklus
Blant de chelaterende ligander kan man skille ut en klasse makrosykliske ligander, dvs. molekyler med et intrasyklisk rom som er tilstrekkelig til å romme et kompleksdannende atom. Et eksempel på slike forbindelser er porfyrinbaser - grunnlaget for de viktigste biokjemiske kompleksene, som hemoglobin, klorofyll og bakterioklorofyll. Kronetere, calixarener, etc. kan også fungere som makrosykliske ligander.
Ligander kan også være brodannende, og danner bindinger mellom forskjellige sentrale atomer i bi- eller polynukleære komplekser. Brokoblede ligander er betegnet med den greske bokstaven μ ( mu).
LIGANDS
ABCDEZHZYKLMNOPRSTUFHTSCHSHSHCHEYUYA
LIGANDS(fra latin ligo - jeg binder), nøytrale molekyler, ioner eller radikaler knyttet til senteret. atomet til en kompleks forbindelse. De m. b. ioner (H - , Hal - , NO 3 - , NCS - og andre), inorg. molekyler (H 2, C n, N 2, P n, O 2, S n, CO, CO 2, NH 3, NO, SO 2, NO 2, COS, etc.), org. komp., som inneholder elementer fra hovedundergruppene V, VI, VII gr. periodisk system eller p-donor funksjon. En stor gruppe ligander, biologisk viktig Comm. (aminosyrer, peptider, proteiner, puriner, porfyriner, corriner, makrolider) og deres syntetiske. analoger (kronetere, kryptander), samt polymerer med donoratomer og chelaterende grupper. Ligander kan kobles til det sentrale atomet med s-, p- og d-to-senter- eller multisenterbindinger. Ved dannelse av tosenterbindinger i ligander kan donorsentre (vanligvis N, O, S, Cl-atomer eller multiple bindinger) isoleres. Multisenterbinding utføres på grunn av det p-aromatiske systemet. ligander (benzen, cyklopentadienid anion) eller heteroaromatiske. ligander (pyrrol, tiofen, metylpyridiner). Den viktigste mengden. karakteristisk for donor-akseptorevnen til ligander - dentisitet, bestemt av antall donorsentre av ligander involvert i koordinering. På dette grunnlaget er ligander delt inn i mono-, di-, ... polydentate. Koordinasjon antall kompleksdannende midler for monodentate ligander sammenfaller med deres antall, for andre er det lik produktet av antall ligander og deres dentisitet. Ligandenes natur bestemmer typene koordinering. tilk. (akvakomplekser, aminokomplekser, acidokomplekser, moladdukter, chelater, p-komplekser, etc.); Saint-va, struktur og reaksjon avhenger av det. evnen til komplekse Comm. og muligheten for deres praktiske applikasjoner.
En ligand er en essensiell komponent i komplekse proteiner
Komplekse proteiner, i tillegg til proteinkjeden, har en ekstra ikke-proteingruppe - ligand(lat. ligo– Jeg binder), det vil si et molekyl assosiert med et protein. Hvis liganden bærer en strukturell og/eller funksjonell belastning, kalles den protesegruppe.
som en ligand Ethvert molekyl kan være
Molekyler som fungerer i et protein strukturell funksjon - lipider, karbohydrater, nukleinsyrer, mineralelementer, alle andre organiske forbindelser: hem i hemoglobin, karbohydrater i glykoproteiner, DNA og RNA i nukleoproteiner, kobber i ceruloplasmin,
· bærbar proteiner molekyler: jern i transferrin, hemoglobin i haptoglobin, hem i hemopexin,
· underlag for enzymer - alle molekyler og til og med andre proteiner.
Ligandgjenkjenning sørget for:
· komplementaritet strukturen til proteinbindingssenteret til strukturen til liganden, med andre ord den romlige og kjemiske korrespondansen mellom proteinet og liganden. De passer sammen som en nøkkel til en lås, for eksempel matchende enzym og substrat,
Noen ganger kan anerkjennelse avhenge av reaktivitet atomet som liganden er festet til. For eksempel bindingen av oksygen av jernet i hemoglobin, eller en fettsyre til albumin.
Ligandfunksjoner i sammensetningen av et komplekst protein er forskjellige:
· endrer egenskaper proteiner (ladning, løselighet, termisk labilitet), for eksempel fosforsyre i fosfoproteiner eller monosakkaridrester i glykoproteiner,
· beskytter proteinet fra proteolyse utenfor og inne i cellen, for eksempel karbohydratdelen i glykoproteiner,
Levert som en ligand transportere vannuløselige forbindelser, som transport av fett med lipoproteiner,
legger ved biologisk aktivitet og definerer funksjonen til et protein, for eksempel nukleinsyre i nukleoproteiner, hem i hemoglobin, karbohydrat i reseptorproteiner,
· påvirker membrangjennomtrengning, intracellulær migrasjon, sortering og sekresjon av proteiner. Dette gjøres som regel av en karbohydratrester.
