ค่าคงที่ Boltzmann คืออะไร ค่าคงที่ Boltzmann
โบลซ์มันน์ ลุดวิก (ค.ศ. 1844-1906)- นักฟิสิกส์ชาวออสเตรียผู้ยิ่งใหญ่ หนึ่งในผู้ก่อตั้งทฤษฎีจลนพลศาสตร์ระดับโมเลกุล ในงานของ Boltzmann ทฤษฎีโมเลกุล-จลนพลศาสตร์ปรากฏตัวครั้งแรกในฐานะทฤษฎีทางกายภาพที่สอดคล้องกันอย่างมีเหตุผลและสอดคล้องกัน Boltzmann ให้การตีความทางสถิติของกฎข้อที่สองของอุณหพลศาสตร์ เขาได้ทำอะไรมากมายเพื่อพัฒนาและเผยแพร่ทฤษฎีสนามแม่เหล็กไฟฟ้าของแมกซ์เวลล์ นักสู้โดยธรรมชาติ Boltzmann ปกป้องความต้องการการตีความระดับโมเลกุลของปรากฏการณ์ความร้อนอย่างกระตือรือร้นและต่อสู้กับนักวิทยาศาสตร์ที่ปฏิเสธการมีอยู่ของโมเลกุล
สมการ (4.5.3) รวมถึงอัตราส่วนของค่าคงที่แก๊สสากล R สู่ค่าคงที่อโวกาโดร นู๋ อา . อัตราส่วนนี้จะเท่ากันสำหรับสารทั้งหมด มันถูกเรียกว่าค่าคงที่ Boltzmann เพื่อเป็นเกียรติแก่ L. Boltzmann หนึ่งในผู้ก่อตั้งทฤษฎีจลนพลศาสตร์ระดับโมเลกุล
ค่าคงที่ของ Boltzmann คือ:
 (4.5.4)
(4.5.4)
สมการ (4.5.3) โดยคำนึงถึงค่าคงที่ Boltzmann เขียนดังนี้:
 (4.5.5)
(4.5.5)
ความหมายทางกายภาพของค่าคงที่ Boltzmann
ในอดีต อุณหภูมิถูกนำมาใช้เป็นปริมาณเชิงอุณหพลศาสตร์ และได้มีการกำหนดหน่วยการวัดสำหรับอุณหภูมินั้น - องศา (ดู § 3.2) หลังจากสร้างความสัมพันธ์ระหว่างอุณหภูมิและพลังงานจลน์เฉลี่ยของโมเลกุล จะเห็นได้อย่างชัดเจนว่าอุณหภูมิสามารถกำหนดเป็นพลังงานจลน์เฉลี่ยของโมเลกุลและแสดงเป็นจูลหรือเอิร์ก กล่าวคือ แทนที่จะเป็นปริมาณ ตู่ใส่ค่า ท*ดังนั้น 
อุณหภูมิที่กำหนดจึงสัมพันธ์กับอุณหภูมิที่แสดงเป็นองศาดังนี้

ดังนั้นค่าคงที่ Boltzmann จึงถือได้ว่าเป็นปริมาณที่เกี่ยวข้องกับอุณหภูมิซึ่งแสดงเป็นหน่วยพลังงานโดยมีอุณหภูมิแสดงเป็นองศา
การพึ่งพาแรงดันแก๊สต่อความเข้มข้นของโมเลกุลและอุณหภูมิ
การแสดงออก อีจากความสัมพันธ์ (4.5.5) และแทนที่เป็นสูตร (4.4.10) เราได้รับนิพจน์ที่แสดงการพึ่งพาแรงดันแก๊สต่อความเข้มข้นของโมเลกุลและอุณหภูมิ:
 (4.5.6)
(4.5.6)
จากสูตร (4.5.6) ที่ความดันและอุณหภูมิเท่ากัน ความเข้มข้นของโมเลกุลในก๊าซทั้งหมดจะเท่ากัน
นี่แสดงถึงกฎของอาโวกาโดร: ก๊าซที่มีปริมาตรเท่ากันที่อุณหภูมิและความดันเท่ากันมีจำนวนโมเลกุลเท่ากัน
พลังงานจลน์เฉลี่ยของการเคลื่อนที่เชิงแปลของโมเลกุลเป็นสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์ ปัจจัยสัดส่วน- ค่าคงที่ของ Boltzmannk \u003d 10 -23 เจ / เค - ต้องจำ
§ 4.6. การกระจายแมกซ์เวลล์
ในหลายกรณี การรู้ค่าเฉลี่ยของปริมาณทางกายภาพเพียงอย่างเดียวไม่เพียงพอ ตัวอย่างเช่น การรู้ส่วนสูงเฉลี่ยของคนไม่สามารถวางแผนการผลิตเสื้อผ้าขนาดต่างๆ ได้ คุณจำเป็นต้องทราบจำนวนโดยประมาณของคนที่มีความสูงในช่วงเวลาหนึ่ง ในทำนองเดียวกัน สิ่งสำคัญคือต้องทราบจำนวนโมเลกุลที่มีความเร็วอื่นที่ไม่ใช่ค่าเฉลี่ย แมกซ์เวลล์เป็นคนแรกที่ค้นพบวิธีการกำหนดตัวเลขเหล่านี้
ความน่าจะเป็นของเหตุการณ์สุ่ม
ใน §4.1 เราได้กล่าวไปแล้วว่า J. Maxwell ได้นำเสนอแนวคิดเรื่องความน่าจะเป็นเพื่ออธิบายพฤติกรรมของโมเลกุลชุดใหญ่
ตามหลักการแล้ว มันเป็นไปไม่ได้ที่จะติดตามการเปลี่ยนแปลงของความเร็ว (หรือโมเมนตัม) ของโมเลกุลหนึ่งในช่วงเวลาที่ยาวนาน นอกจากนี้ยังเป็นไปไม่ได้ที่จะกำหนดความเร็วของโมเลกุลก๊าซทั้งหมดอย่างแม่นยำในเวลาที่กำหนด จากสภาพมหภาคที่ก๊าซตั้งอยู่ (ปริมาตรและอุณหภูมิที่แน่นอน) ค่าบางอย่างของความเร็วของโมเลกุลไม่จำเป็นต้องปฏิบัติตาม ความเร็วของโมเลกุลถือได้ว่าเป็นตัวแปรสุ่ม ซึ่งภายใต้สภาวะมหภาคสามารถรับค่าต่างๆ ได้ เช่นเดียวกับการโยนลูกเต๋า จำนวนจุดใดก็ได้ตั้งแต่ 1 ถึง 6 (จำนวนใบหน้าของลูกเต๋าคือ 6) สามารถหลุดออกมาได้ เป็นไปไม่ได้ที่จะทำนายจำนวนแต้มที่จะหลุดออกจากการโยนลูกเต๋า แต่ความน่าจะเป็นที่จะกลิ้ง กล่าวคือ ห้าแต้มสามารถป้องกันได้
ความน่าจะเป็นของเหตุการณ์สุ่มเกิดขึ้นคืออะไร? ให้มีการผลิตจำนวนมาก นู๋การทดสอบ (นู๋ คือจำนวนม้วนของแม่พิมพ์) ในขณะเดียวกัน ใน นู๋" กรณีที่ผลการทดสอบออกมาเป็นที่น่าพอใจ (เช่น แพ้ 5 ครั้ง) ความน่าจะเป็นของเหตุการณ์นี้จะเท่ากับอัตราส่วนของจำนวนคดีที่มีผลดีต่อจำนวนการทดลองทั้งหมด โดยมีเงื่อนไขว่าจำนวนนี้จะมากตามอำเภอใจ:
 (4.6.1)
(4.6.1)
สำหรับการดายสมมาตร ความน่าจะเป็นของจำนวนแต้มที่เลือกตั้งแต่ 1 ถึง 6 คือ
เราเห็นว่าเมื่อเทียบกับพื้นหลังของเหตุการณ์สุ่มจำนวนมาก รูปแบบเชิงปริมาณบางอย่างถูกเปิดเผย ตัวเลขปรากฏขึ้น ตัวเลขนี้ - ความน่าจะเป็น - ให้คุณคำนวณค่าเฉลี่ย ดังนั้น หากคุณโยนลูกเต๋า 300 ครั้ง จำนวนเฉลี่ยของการโยนห้าครั้ง ตามสูตร (4.6.1) จะเท่ากับ: 300 = 50 และไม่แยแสเลยที่จะโยนลูกเต๋าเดียวกัน 300 ครั้งหรือพร้อมกัน 300 ลูกเต๋าเหมือนกัน
ไม่ต้องสงสัยเลยว่าพฤติกรรมของโมเลกุลของแก๊สในภาชนะนั้นซับซ้อนกว่าการเคลื่อนที่ของลูกเต๋า แต่ถึงแม้ที่นี่ เราอาจหวังว่าจะค้นพบความสม่ำเสมอเชิงปริมาณที่ทำให้สามารถคำนวณค่าเฉลี่ยทางสถิติได้ หากปัญหาเกิดขึ้นในลักษณะเดียวกับทฤษฎีเกม ไม่ใช่ในกลไกแบบคลาสสิก เราต้องละทิ้งปัญหาที่แก้ไม่ได้ของการหาค่าที่แน่นอนของความเร็วของโมเลกุลในช่วงเวลาที่กำหนด และพยายามหาความน่าจะเป็นที่ความเร็วมีค่าที่แน่นอน
ในฐานะที่เป็นวิทยาศาสตร์เชิงปริมาณที่แน่นอน ฟิสิกส์ไม่สามารถทำได้หากไม่มีค่าคงที่ที่สำคัญมากซึ่งป้อนเป็นสัมประสิทธิ์สากลลงในสมการที่สร้างการเชื่อมต่อระหว่างปริมาณที่แน่นอน สิ่งเหล่านี้คือค่าคงที่พื้นฐาน ซึ่งความสัมพันธ์ดังกล่าวได้รับค่าคงที่และสามารถอธิบายพฤติกรรมของระบบทางกายภาพในระดับต่างๆ ได้
ในบรรดาพารามิเตอร์ดังกล่าวที่แสดงถึงคุณสมบัติที่มีอยู่ในเรื่องจักรวาลของเราคือค่าคงที่ Boltzmann ซึ่งเป็นปริมาณที่รวมอยู่ในสมการที่สำคัญที่สุดจำนวนหนึ่ง อย่างไรก็ตาม ก่อนที่จะพิจารณาถึงลักษณะและความสำคัญของมัน เราไม่สามารถพลาดที่จะพูดสองสามคำเกี่ยวกับนักวิทยาศาสตร์ที่มีชื่อของมันได้
Ludwig Boltzmann: บุญทางวิทยาศาสตร์
หนึ่งในนักวิทยาศาสตร์ที่ยิ่งใหญ่ที่สุดแห่งศตวรรษที่ 19 ชาวออสเตรีย Ludwig Boltzmann (1844-1906) มีส่วนสำคัญในการพัฒนาทฤษฎีจลนพลศาสตร์ระดับโมเลกุล กลายเป็นหนึ่งในผู้สร้างกลศาสตร์ทางสถิติ เขาเป็นผู้เขียนสมมติฐานตามหลัก Ergodic ซึ่งเป็นวิธีทางสถิติในการอธิบายก๊าซในอุดมคติ สมการพื้นฐานของจลนพลศาสตร์ทางกายภาพ เขาทำงานมากในประเด็นทางอุณหพลศาสตร์ (ทฤษฎีบท H ของ Boltzmann หลักการทางสถิติสำหรับกฎข้อที่สองของอุณหพลศาสตร์) ทฤษฎีการแผ่รังสี (กฎ Stefan-Boltzmann) เขายังได้กล่าวถึงผลงานของเขาเกี่ยวกับไฟฟ้าไดนามิก ทัศนศาสตร์ และสาขาฟิสิกส์อื่นๆ ชื่อของเขาถูกทำให้เป็นอมตะในค่าคงที่ทางกายภาพสองค่า ซึ่งจะกล่าวถึงด้านล่าง
Ludwig Boltzmann เป็นผู้สนับสนุนทฤษฎีโครงสร้างอะตอมและโมเลกุลของสสารที่เชื่อมั่นและสม่ำเสมอ เป็นเวลาหลายปีที่เขาต้องต่อสู้กับความเข้าใจผิดและการปฏิเสธแนวคิดเหล่านี้ในชุมชนวิทยาศาสตร์ในสมัยนั้น เมื่อนักฟิสิกส์หลายคนถือว่าอะตอมและโมเลกุลเป็นนามธรรมมากเกินไป อย่างดีที่สุดคืออุปกรณ์ตามเงื่อนไขที่ทำหน้าที่อำนวยความสะดวกในการคำนวณ ความเจ็บป่วยที่เจ็บปวดและการโจมตีโดยเพื่อนร่วมงานที่มีความคิดอนุรักษ์นิยมทำให้เกิดภาวะซึมเศร้าอย่างรุนแรงใน Boltzmann ซึ่งไม่สามารถทนต่อมันได้ นักวิทยาศาสตร์ที่โดดเด่นได้ฆ่าตัวตาย บนอนุสาวรีย์หลุมศพ เหนือรูปปั้นครึ่งตัวของ Boltzmann เพื่อเป็นสัญลักษณ์แห่งการยอมรับในคุณธรรม สมการ S = k∙logW ถูกจารึกไว้ ซึ่งเป็นหนึ่งในผลลัพธ์ของกิจกรรมทางวิทยาศาสตร์ที่ได้ผลของเขา ค่าคงที่ k ในสมการนี้คือค่าคงที่ของ Boltzmann
พลังงานของโมเลกุลและอุณหภูมิของสสาร
แนวคิดเรื่องอุณหภูมิทำหน้าที่กำหนดระดับความร้อนของร่างกาย ในวิชาฟิสิกส์ ใช้มาตราส่วนอุณหภูมิสัมบูรณ์ ซึ่งอิงตามข้อสรุปของทฤษฎีจลนศาสตร์ระดับโมเลกุลเกี่ยวกับอุณหภูมิเป็นการวัดที่สะท้อนถึงขนาดพลังงานของการเคลื่อนที่เชิงความร้อนของอนุภาคของสสาร (แน่นอนว่า พลังงานจลน์เฉลี่ยของอนุภาคจำนวนมาก)
ทั้ง SI จูลและ CGS erg เป็นหน่วยที่ใหญ่เกินไปที่จะแสดงพลังงานของโมเลกุล และในทางปฏิบัติ การวัดอุณหภูมิด้วยวิธีนี้ทำได้ยากมาก หน่วยอุณหภูมิที่สะดวกคือองศา และการวัดจะดำเนินการทางอ้อมโดยการลงทะเบียนการเปลี่ยนแปลงลักษณะพิเศษมหภาคของสาร - ตัวอย่างเช่น ปริมาตร

พลังงานและอุณหภูมิสัมพันธ์กันอย่างไร?
ในการคำนวณสถานะของสารจริงที่อุณหภูมิและความดันใกล้เคียงกับปกติ แบบจำลองของก๊าซในอุดมคติได้ถูกนำมาใช้สำเร็จ นั่นคือ แบบจำลองที่มีขนาดโมเลกุลเล็กกว่าปริมาตรของก๊าซจำนวนหนึ่งและระยะทาง ระหว่างอนุภาคมีนัยสำคัญเกินกว่ารัศมีของการมีปฏิสัมพันธ์ จากสมการของทฤษฎีจลนศาสตร์ พลังงานเฉลี่ยของอนุภาคดังกล่าวถูกกำหนดเป็น E cf = 3/2∙kT โดยที่ E คือพลังงานจลน์ T คืออุณหภูมิ และ 3/2∙k คือปัจจัยสัดส่วนที่แนะนำ โดย Boltzmann หมายเลข 3 ในที่นี้แสดงลักษณะจำนวนองศาอิสระของการเคลื่อนที่เชิงแปลของโมเลกุลในสามมิติเชิงพื้นที่
ค่า k ซึ่งต่อมาถูกตั้งชื่อว่าค่าคงที่โบลต์ซมันน์เพื่อเป็นเกียรติแก่นักฟิสิกส์ชาวออสเตรีย แสดงให้เห็นว่าจูลหรือเอิร์กมีดีกรีเท่าใด กล่าวอีกนัยหนึ่ง ค่าของมันกำหนดว่าโดยเฉลี่ยแล้ว พลังงานของการเคลื่อนที่แบบโกลาหลจากความร้อนของอนุภาคหนึ่งของก๊าซในอุดมคติแบบโมโนโทมิกจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น 1 องศา

ดีกรีน้อยกว่าจูลกี่เท่า
ค่าตัวเลขของค่าคงที่นี้สามารถหาได้หลายวิธี เช่น ผ่านการวัดอุณหภูมิและความดันสัมบูรณ์ โดยใช้สมการก๊าซในอุดมคติ หรือใช้แบบจำลองการเคลื่อนที่แบบบราวเนียน การหาปริมาณนี้ในทางทฤษฎีในระดับความรู้ปัจจุบันเป็นไปไม่ได้
ค่าคงที่ของ Boltzmann คือ 1.38 × 10 -23 J/K (ในที่นี้ K คือเคลวิน ซึ่งเป็นระดับของอุณหภูมิสัมบูรณ์) สำหรับกลุ่มอนุภาคใน 1 โมลของก๊าซในอุดมคติ (22.4 ลิตร) ค่าสัมประสิทธิ์ที่เกี่ยวข้องกับพลังงานต่ออุณหภูมิ (ค่าคงที่ของก๊าซสากล) ได้มาจากการคูณค่าคงที่โบลต์ซมันน์ด้วยจำนวนอะโวกาโดร (จำนวนโมเลกุลในโมล): R = kN A และเท่ากับ 8.31 J / (โมล∙เคลวิน) อย่างไรก็ตาม ค่าคงที่โบลต์ซมันน์นั้นแตกต่างจากค่าหลังทั่วไปมากกว่า เพราะมันเข้าสู่ความสัมพันธ์ที่สำคัญอื่นๆ และยังทำหน้าที่กำหนดค่าคงที่ทางกายภาพอื่นด้วย
การกระจายพลังงานทางสถิติของโมเลกุล
เนื่องจากสถานะของสสารในระดับมหภาคเป็นผลมาจากพฤติกรรมของอนุภาคจำนวนมาก จึงอธิบายโดยใช้วิธีการทางสถิติ อย่างหลังยังรวมถึงการค้นหาว่าพารามิเตอร์พลังงานของโมเลกุลก๊าซมีการกระจายอย่างไร:
- การกระจายของพลังงานจลน์ (และความเร็ว) ของแมกซ์เวลเลียน มันแสดงให้เห็นว่าในก๊าซที่อยู่ในสภาวะสมดุล โมเลกุลส่วนใหญ่มีความเร็วใกล้เคียงกับความเร็วที่น่าจะเป็นไปได้มากที่สุด v = √(2kT/m 0) โดยที่ m 0 คือมวลของโมเลกุล
- Boltzmann กระจายพลังงานศักย์ของก๊าซในสนามของแรงใด ๆ เช่นแรงโน้มถ่วงของโลก ขึ้นอยู่กับอัตราส่วนของสองปัจจัย: แรงดึงดูดสู่โลกและการเคลื่อนที่ด้วยความร้อนที่วุ่นวายของอนุภาคก๊าซ เป็นผลให้พลังงานศักย์ของโมเลกุลต่ำลง (ใกล้กับพื้นผิวของดาวเคราะห์มากขึ้น) ความเข้มข้นของพวกมันก็จะสูงขึ้น

วิธีการทางสถิติทั้งสองวิธีรวมกันเป็นการกระจายแบบแมกซ์เวลล์-โบลต์ซมันน์ที่มีตัวประกอบการเอ็กซ์โพเนนเชียล e - E/ kT โดยที่ E คือผลรวมของพลังงานจลน์และพลังงานศักย์ และ kT คือพลังงานเฉลี่ยของการเคลื่อนที่ด้วยความร้อน ซึ่งเราทราบแล้ว ควบคุมโดย ค่าคงที่โบลต์ซมันน์
ค่าคงที่ k และเอนโทรปี
ในความหมายทั่วไป เอนโทรปีสามารถกำหนดลักษณะเป็นตัวชี้วัดความไม่ย้อนกลับของกระบวนการทางอุณหพลศาสตร์ การย้อนกลับไม่ได้นี้เกี่ยวข้องกับการกระเจิง - การกระจาย - ของพลังงาน ในแนวทางทางสถิติที่เสนอโดย Boltzmann เอนโทรปีเป็นฟังก์ชันของจำนวนวิธีที่ระบบทางกายภาพสามารถใช้งานได้โดยไม่ต้องเปลี่ยนสถานะ: S = k∙lnW
ในที่นี้ ค่าคงที่ k จะกำหนดขนาดของการเติบโตของเอนโทรปีด้วยการเพิ่มจำนวน (W) ของตัวเลือกการใช้งานระบบหรือไมโครสเตต Max Planck ผู้ซึ่งนำสูตรนี้ไปสู่รูปแบบที่ทันสมัย และเสนอให้ค่าคงที่ k เป็นชื่อของ Boltzmann

กฎการแผ่รังสีของสเตฟาน-โบลต์ซมันน์
กฎทางกายภาพที่กำหนดว่าความส่องสว่างของพลังงาน (กำลังการแผ่รังสีต่อหน่วยพื้นผิว) ของวัตถุสีดำนั้นขึ้นอยู่กับอุณหภูมิของวัตถุอย่างไร มีรูปแบบ j = σT 4 นั่นคือร่างกายแผ่รังสีตามสัดส่วนของพลังงานที่สี่ของอุณหภูมิ ยกตัวอย่างเช่น กฎข้อนี้ใช้ในทางฟิสิกส์ดาราศาสตร์ เนื่องจากการแผ่รังสีของดาวฤกษ์มีลักษณะใกล้เคียงกับการแผ่รังสีวัตถุสีดำ
ในอัตราส่วนนี้ มีค่าคงที่อื่นที่ควบคุมขนาดของปรากฏการณ์ด้วย นี่คือค่าคงที่ Stefan-Boltzmann σ ซึ่งมีค่าประมาณ 5.67 × 10 -8 W / (m 2 ∙K 4) มิติของมันรวมถึงเคลวิน ซึ่งหมายความว่าเป็นที่ชัดเจนว่าค่าคงที่ Boltzmann k มีส่วนเกี่ยวข้องที่นี่ด้วย อันที่จริง ค่าของ σ ถูกกำหนดเป็น (2π 2 ∙k 4)/(15c 2 h 3) โดยที่ c คือความเร็วของแสงและ h คือค่าคงที่ของพลังค์ ดังนั้น ค่าคงที่โบลต์ซมันน์ เมื่อรวมกับค่าคงที่ของโลกอื่นๆ จะสร้างปริมาณที่เชื่อมโยงพลังงาน (กำลัง) กับอุณหภูมิอีกครั้ง ในกรณีนี้ สัมพันธ์กับการแผ่รังสี

สาระสำคัญทางกายภาพของค่าคงที่ Boltzmann
มีการระบุไว้ข้างต้นแล้วว่าค่าคงที่ Boltzmann เป็นหนึ่งในค่าคงที่พื้นฐานที่เรียกว่า ประเด็นไม่ได้เป็นเพียงทำให้สามารถสร้างความสัมพันธ์ระหว่างลักษณะของปรากฏการณ์ด้วยกล้องจุลทรรศน์ในระดับโมเลกุลและพารามิเตอร์ของกระบวนการที่สังเกตได้ในมหภาค และไม่เพียงแต่ค่าคงที่นี้จะรวมอยู่ในสมการที่สำคัญจำนวนหนึ่งด้วย
ในปัจจุบันยังไม่เป็นที่ทราบแน่ชัดว่ามีหลักการทางกายภาพใดบ้างที่อาจได้มาในทางทฤษฎี กล่าวอีกนัยหนึ่ง มันไม่ได้เป็นไปตามค่าของค่าคงที่ที่กำหนดควรเป็นค่านั้นอย่างแน่นอน เราสามารถใช้ปริมาณอื่นและหน่วยอื่นแทนองศาเพื่อวัดความสอดคล้องกันของพลังงานจลน์ของอนุภาค จากนั้นค่าตัวเลขของค่าคงที่จะแตกต่างกัน แต่ค่าจะยังคงเป็นค่าคงที่ พร้อมกับปริมาณพื้นฐานอื่นๆ ประเภทนี้ - ความเร็วจำกัด c, ค่าคงที่ของพลังค์ h, ประจุพื้นฐาน e, ค่าคงตัวโน้มถ่วง G - วิทยาศาสตร์ใช้ค่าคงที่ Boltzmann ตามที่กำหนดในโลกของเราและใช้เพื่ออธิบายกระบวนการทางกายภาพที่เกิดขึ้นในทางทฤษฎี มัน.
ค่าคงที่ของ Boltzmann โยนสะพานจากมหภาคไปสู่พิภพเล็ก โดยเชื่อมโยงอุณหภูมิกับพลังงานจลน์ของโมเลกุล
Ludwig Boltzmann เป็นหนึ่งในผู้สร้างทฤษฎีโมเลกุล - จลนพลศาสตร์ของก๊าซซึ่งเป็นภาพที่ทันสมัยของความสัมพันธ์ระหว่างการเคลื่อนที่ของอะตอมและโมเลกุลในด้านหนึ่งและคุณสมบัติมหภาคของสสารเช่นอุณหภูมิและความดัน อื่น ๆ เป็นพื้นฐาน ภายในกรอบภาพนี้ ความดันก๊าซเกิดจากการกระแทกยืดหยุ่นของโมเลกุลก๊าซบนผนังของเรือ และอุณหภูมิเกิดจากความเร็วของโมเลกุล (หรือมากกว่านั้น พลังงานจลน์) ยิ่งโมเลกุลเร็ว ย้ายอุณหภูมิสูงขึ้น
ค่าคงที่ของ Boltzmann ทำให้สามารถเชื่อมโยงลักษณะของพิภพเล็ก ๆ กับลักษณะของมหภาคได้โดยตรง โดยเฉพาะกับการอ่านเทอร์โมมิเตอร์ นี่คือสูตรสำคัญที่กำหนดอัตราส่วนนี้:
1/2 mv 2 = kT
ที่ไหน มและ วี -ตามลำดับ มวลและความเร็วเฉลี่ยของโมเลกุลก๊าซ ตู่คืออุณหภูมิของแก๊ส (ในระดับเคลวินสัมบูรณ์) และ เค -ค่าคงที่ของโบลต์ซมันน์ สมการนี้เชื่อมโลกทั้งสองโดยเชื่อมโยงคุณลักษณะของระดับอะตอม (ทางด้านซ้าย) กับ คุณสมบัติจำนวนมาก(ทางด้านขวามือ) ที่สามารถวัดได้ด้วยเครื่องมือของมนุษย์ ในกรณีนี้คือ เทอร์โมมิเตอร์ การเชื่อมต่อนี้จัดทำโดยค่าคงที่ Boltzmann k, เท่ากับ 1.38 x 10 -23 J/K.
สาขาฟิสิกส์ที่ศึกษาความเชื่อมโยงระหว่างปรากฏการณ์ของพิภพเล็กและมหภาคเรียกว่า กลศาสตร์สถิติในส่วนนี้ แทบไม่มีสมการหรือสูตรใดที่ค่าคงที่ Boltzmann จะไม่ปรากฏ หนึ่งในอัตราส่วนเหล่านี้มาจากชาวออสเตรียเองและเรียกง่ายๆว่า สมการ Boltzmann:
ส = kบันทึก พี + ข
ที่ไหน ส-เอนโทรปีของระบบ ( ซม.กฎข้อที่สองของอุณหพลศาสตร์) พี- ที่เรียกว่า น้ำหนักสถิติ(องค์ประกอบที่สำคัญมากของวิธีการทางสถิติ) และ ขเป็นค่าคงที่อื่น
ตลอดชีวิตของเขา ลุดวิก โบลซ์มันน์อยู่เหนือเวลาของเขาอย่างแท้จริง โดยได้พัฒนารากฐานของทฤษฎีอะตอมสมัยใหม่ของโครงสร้างของสสาร เข้าสู่ข้อพิพาทที่รุนแรงกับชุมชนวิทยาศาสตร์ร่วมสมัยส่วนใหญ่ที่มีแนวคิดอนุรักษ์นิยมอย่างท่วมท้น ซึ่งถือว่าอะตอมเป็นเพียงอนุสัญญาที่สะดวกสำหรับ การคำนวณ แต่ไม่ใช่วัตถุของโลกแห่งความเป็นจริง เมื่อวิธีการทางสถิติของเขาไม่ตรงกับความเข้าใจแม้แต่น้อยหลังจากการถือกำเนิดของทฤษฎีสัมพัทธภาพพิเศษ Boltzmann ฆ่าตัวตายในช่วงเวลาของภาวะซึมเศร้าลึก สมการของ Boltzmann ถูกแกะสลักไว้บนหลุมฝังศพของเขา
Boltzmann, 1844-1906
นักฟิสิกส์ชาวออสเตรีย เกิดที่กรุงเวียนนาในตระกูลข้าราชการ เขาเรียนที่มหาวิทยาลัยเวียนนาในหลักสูตรเดียวกันกับ Josef Stefan ( ซม.กฎของสเตฟาน-โบลต์ซมันน์) หลังจากปกป้องการป้องกันของเขาในปี 2409 เขายังคงทำงานด้านวิทยาศาสตร์ต่อไปหลายครั้งโดยดำรงตำแหน่งศาสตราจารย์ในภาควิชาฟิสิกส์และคณิตศาสตร์ที่มหาวิทยาลัยกราซ, เวียนนา, มิวนิกและไลพ์ซิก ในฐานะหนึ่งในผู้สนับสนุนหลักของความเป็นจริงของการมีอยู่ของอะตอม เขาได้ค้นพบการค้นพบทางทฤษฎีที่โดดเด่นจำนวนหนึ่งซึ่งทำให้กระจ่างว่าปรากฏการณ์ในระดับอะตอมส่งผลต่อคุณสมบัติทางกายภาพและพฤติกรรมของสสารอย่างไร
ตามกฎของสเตฟาน-โบลต์ซมันน์ ความหนาแน่นของการแผ่รังสีครึ่งซีกอินทิกรัล E0ขึ้นอยู่กับอุณหภูมิเท่านั้นและแปรผันตามสัดส่วนกำลังสี่ของอุณหภูมิสัมบูรณ์ ตู่:
Stefan - ค่าคงที่ Boltzmann σ 0 คือค่าคงที่ทางกายภาพที่รวมอยู่ในกฎหมายที่กำหนดความหนาแน่นเชิงปริมาตรของการแผ่รังสีความร้อนที่สมดุลของวัตถุสีดำ:

ในอดีต กฎของสเตฟาน-โบลต์ซมันน์ถูกกำหนดขึ้นก่อนกฎการแผ่รังสีของพลังค์ ซึ่งตามมาเป็นผลพวง กฎของพลังค์สร้างการพึ่งพาความหนาแน่นสเปกตรัมของฟลักซ์การแผ่รังสี อี 0 เกี่ยวกับความยาวคลื่น λ และ อุณหภูมิ ตู่:

โดยที่ λ คือความยาวคลื่น m; จาก\u003d 2.998 10 8 m / s - ความเร็วของแสงในสุญญากาศ ตู่– อุณหภูมิของร่างกาย K;
ชม\u003d 6.625 × 10 -34 J × s - ค่าคงที่ของพลังค์
ค่าคงที่ทางกายภาพ kเท่ากับอัตราส่วนของค่าคงที่แก๊สสากล R\u003d 8314J / (kg × K) ถึงจำนวน Avogadro NA\u003d 6.022 × 10 26 1 / (กก. × โมล):

จำนวนการกำหนดค่าระบบต่างๆ จาก นู๋อนุภาคสำหรับชุดตัวเลขที่กำหนด ฉัน(จำนวนอนุภาคใน ฉัน-สถานะที่พลังงาน e ฉันสอดคล้อง) เป็นสัดส่วนกับค่า:

ค่า Wมีหลายวิธีในการแจกจ่าย นู๋อนุภาคตามระดับพลังงาน หากความสัมพันธ์ (6) ถูกต้อง จะถือว่าระบบเดิมเป็นไปตามสถิติของ Boltzmann ชุดตัวเลข ฉันซึ่งตัวเลข Wสูงสุด เกิดขึ้นบ่อยที่สุดและสอดคล้องกับการแจกแจงที่น่าจะเป็นไปได้มากที่สุด
จลนพลศาสตร์ทางกายภาพ– ทฤษฎีจุลภาคของกระบวนการในระบบที่ไม่สมดุลทางสถิติ
คำอธิบายของอนุภาคจำนวนมากสามารถทำได้สำเร็จโดยวิธีความน่าจะเป็น สำหรับก๊าซโมเลกุลเดี่ยว สถานะของชุดของโมเลกุลจะถูกกำหนดโดยพิกัดของพวกมันและโดยค่าของการคาดคะเนความเร็วบนแกนพิกัดที่สอดคล้องกัน ในทางคณิตศาสตร์ ฟังก์ชันการกระจายนี้อธิบายลักษณะความน่าจะเป็นของอนุภาคที่อยู่ในสถานะที่กำหนด:

คือจำนวนโมเลกุลที่คาดหวังในปริมาตร d d ซึ่งพิกัดอยู่ในช่วงตั้งแต่ ถึง +d และความเร็วของพวกมันอยู่ในช่วงตั้งแต่ ถึง +d
หากพลังงานศักย์เฉลี่ยตามเวลาของปฏิกิริยาของโมเลกุลสามารถละเลยได้เมื่อเทียบกับพลังงานจลน์ของพวกมัน แก๊สจะเรียกว่าอุดมคติ ก๊าซในอุดมคติเรียกว่า ก๊าซโบลต์ซมันน์ ถ้าอัตราส่วนของความยาวเส้นทางของโมเลกุลในก๊าซนี้กับขนาดลักษณะเฉพาะของการไหล หลี่แน่นอน กล่าวคือ

เพราะ ความยาววิ่งเป็นสัดส่วนผกผัน ครั้งที่ 2(n คือความหนาแน่นของตัวเลข 1/m3, d คือเส้นผ่านศูนย์กลางของโมเลกุล, m)
มูลค่า

เรียกว่า ชม- ฟังก์ชัน Boltzmann สำหรับหน่วยปริมาตร ซึ่งสัมพันธ์กับความน่าจะเป็นในการตรวจจับระบบโมเลกุลของแก๊สในสถานะที่กำหนด แต่ละรัฐสอดคล้องกับจำนวนอาชีพบางอย่างของเซลล์ความเร็วอวกาศหกมิติซึ่งพื้นที่เฟสของโมเลกุลที่พิจารณาสามารถแบ่งออกได้ หมายถึง Wความน่าจะเป็นที่ในเซลล์แรกของช่องว่างที่กำลังพิจารณาจะมีโมเลกุล N 1 ในเซลล์ที่สอง N 2 เป็นต้น
ขึ้นอยู่กับค่าคงที่ที่กำหนดที่มาของความน่าจะเป็น ความสัมพันธ์ต่อไปนี้ถูกต้อง:
 ,
,
ที่ไหน 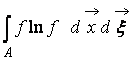 – ฟังก์ชั่น H ของพื้นที่อวกาศ แต่ถูกครอบครองโดยก๊าซ จาก (9) จะเห็นว่า Wและ ชมสัมพันธ์กัน กล่าวคือ การเปลี่ยนแปลงความน่าจะเป็นของรัฐนำไปสู่วิวัฒนาการที่สอดคล้องกันของฟังก์ชัน H
– ฟังก์ชั่น H ของพื้นที่อวกาศ แต่ถูกครอบครองโดยก๊าซ จาก (9) จะเห็นว่า Wและ ชมสัมพันธ์กัน กล่าวคือ การเปลี่ยนแปลงความน่าจะเป็นของรัฐนำไปสู่วิวัฒนาการที่สอดคล้องกันของฟังก์ชัน H

หลักการ Boltzmann สร้างความสัมพันธ์ระหว่างเอนโทรปี สระบบทางกายภาพและความน่าจะเป็นทางอุณหพลศาสตร์ Wสถานะของเธอ:

(พิมพ์ตามสิ่งพิมพ์: Kogan M.N. Dynamics of rarefied gas. - M.: Nauka, 1967.)
มุมมองทั่วไปของ CUBE:

แรงกายอยู่ที่ไหนเนื่องจากการมีอยู่ของสนามต่างๆ (แรงโน้มถ่วง, ไฟฟ้า, แม่เหล็ก) ที่กระทำต่อโมเลกุล เจเป็นอินทิกรัลการชน เป็นเทอมของสมการ Boltzmann ที่คำนึงถึงการชนกันของโมเลกุลซึ่งกันและกันและการเปลี่ยนแปลงที่สอดคล้องกันในความเร็วของอนุภาคที่มีปฏิสัมพันธ์ อินทิกรัลการชนเป็นอินทิกรัลห้ามิติและมีโครงสร้างดังต่อไปนี้:

ได้สมการ (12) ที่มีอินทิกรัล (13) สำหรับการชนกันของโมเลกุลซึ่งไม่มีแรงสัมผัสคือ อนุภาคที่ชนกันจะถือว่าเรียบอย่างสมบูรณ์
ในกระบวนการปฏิสัมพันธ์ พลังงานภายในของโมเลกุลจะไม่เปลี่ยนแปลง กล่าวคือ สันนิษฐานว่าโมเลกุลเหล่านี้มีความยืดหยุ่นในอุดมคติ โมเลกุลสองกลุ่มถือว่ามีความเร็ว และ ตามลำดับ ก่อนการชนกัน (การชนกัน) ระหว่างกัน (รูปที่ 1) และหลังการชน ตามลำดับ ความเร็ว และ . ความแตกต่างของความเร็วเรียกว่าความเร็วสัมพัทธ์นั่นคือ . เป็นที่ชัดเจนว่าเพื่อการชนกันของยางยืดเรียบ ฟังก์ชันการกระจาย f 1 ", f", f 1 ,fอธิบายโมเลกุลของกลุ่มที่เกี่ยวข้องกันหลังและก่อนการชนกัน กล่าวคือ ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

ข้าว. 1. การชนกันของสองโมเลกุล
สมการ (13) ประกอบด้วยพารามิเตอร์สองตัวที่กำหนดตำแหน่งของโมเลกุลที่ชนกันซึ่งสัมพันธ์กัน: ขและ ε; ข- ระยะเล็ง เช่น ระยะทางที่เล็กที่สุดที่โมเลกุลจะเข้าใกล้ในกรณีที่ไม่มีปฏิสัมพันธ์ (รูปที่ 2) ε เรียกว่าพารามิเตอร์การชนเชิงมุม (รูปที่ 3) บูรณาการมากกว่า ขจาก 0 ถึง ¥ และจาก 0 ถึง 2p (อินทิกรัลภายนอกสองตัวใน (12)) ครอบคลุมระนาบทั้งหมดของแรงปฏิสัมพันธ์ในแนวตั้งฉากกับเวกเตอร์

ข้าว. 2. วิถีการเคลื่อนที่ของโมเลกุล

ข้าว. 3. การพิจารณาปฏิสัมพันธ์ของโมเลกุลในระบบพิกัดทรงกระบอก: z, ข, ε
สมการจลนศาสตร์ของ Boltzmann ได้มาจากสมมติฐานและสมมติฐานดังต่อไปนี้
1. เชื่อกันว่าเกิดการชนกันของสองโมเลกุลเป็นหลัก กล่าวคือ บทบาทของการชนกันของโมเลกุลสามตัวขึ้นไปพร้อมกันนั้นไม่มีนัยสำคัญ สมมติฐานนี้ทำให้สามารถใช้ฟังก์ชันการแจกแจงแบบหนึ่งอนุภาคสำหรับการวิเคราะห์ ซึ่งเรียกง่ายๆ ว่าฟังก์ชันการกระจายด้านบน โดยคำนึงถึงการชนกันของโมเลกุลสามตัวทำให้จำเป็นต้องใช้ฟังก์ชันการกระจายแบบสองอนุภาคในการศึกษา ดังนั้น การวิเคราะห์จึงซับซ้อนมากขึ้น
2. สมมติฐานความโกลาหลของโมเลกุล มันแสดงให้เห็นในความจริงที่ว่าความน่าจะเป็นของการตรวจจับอนุภาค 1 ที่จุดเฟสและอนุภาค 2 ที่จุดเฟสนั้นไม่ขึ้นอยู่กับกันและกัน
3. การชนกันของโมเลกุลที่น่าจะเท่ากันกับระยะการกระแทกใดๆ ก็ตาม กล่าวคือ ฟังก์ชันการกระจายไม่เปลี่ยนแปลงบนเส้นผ่านศูนย์กลางการโต้ตอบ ควรสังเกตว่าองค์ประกอบที่วิเคราะห์ต้องมีขนาดเล็กเพื่อที่จะ ฉภายในองค์ประกอบนี้ไม่เปลี่ยนแปลง แต่ในเวลาเดียวกันเพื่อให้ความผันผวนสัมพัทธ์ ~ ไม่ใหญ่ ศักย์ปฏิสัมพันธ์ที่ใช้ในการคำนวณอินทิกรัลการชนนั้นมีความสมมาตรทรงกลม กล่าวคือ ![]() .
.
การกระจายของ Maxwell-Boltzmann
สภาวะสมดุลของก๊าซอธิบายโดยการกระจายแบบสัมบูรณ์ของแมกซ์เวลเลียน ซึ่งเป็นคำตอบที่แน่นอนของสมการจลนศาสตร์โบลต์ซมันน์:

โดยที่ m คือมวลของโมเลกุล kg
การแจกแจงแบบโลคัล-แมกซ์เวลเลียนทั่วไปเรียกอีกอย่างว่าการแจกแจงของแมกซ์เวลล์-โบลต์ซมันน์:

ในกรณีที่ก๊าซเคลื่อนที่โดยรวมด้วยความเร็วและตัวแปร n , T ขึ้นอยู่กับพิกัด
และเวลาที
ในสนามโน้มถ่วงของโลก คำตอบที่แน่นอนของสมการ Boltzmann แสดง:

ที่ไหน น 0 = ความหนาแน่นใกล้พื้นผิวโลก 1/m 3 ; g- ความเร่งของแรงโน้มถ่วง m / s 2; ชมคือความสูง m สูตร (16) เป็นคำตอบที่แน่นอนของสมการจลนศาสตร์โบลต์ซมันน์ไม่ว่าจะอยู่ในปริภูมิอนันต์หรือในขอบเขตที่ไม่ละเมิดการกระจายนี้ ในขณะที่อุณหภูมิจะต้องคงที่ด้วย
หน้านี้ออกแบบโดย Puzina Yu.Yu ด้วยการสนับสนุนของมูลนิธิรัสเซียเพื่อการวิจัยขั้นพื้นฐาน - โครงการหมายเลข 08-08-00638
