Sifat kimia. Kereaktifan homolog benzena Sifat kimia benzena
Kumpulan tindak balas pertama ialah tindak balas penggantian. Kami mengatakan bahawa arene tidak mempunyai berbilang ikatan dalam struktur molekul, tetapi mengandungi sistem konjugasi enam elektron, yang sangat stabil dan memberikan kekuatan tambahan kepada cincin benzena. Oleh itu, dalam tindak balas kimia, pertama sekali, penggantian atom hidrogen berlaku, dan bukan pemusnahan cincin benzena.
Kita telah pun menemui tindak balas penggantian apabila bercakap tentang alkana, tetapi bagi mereka tindak balas ini berjalan mengikut mekanisme radikal, dan bagi arena mekanisme ionik tindak balas penggantian adalah ciri.
Pertama sifat kimia - halogenasi. Penggantian atom hidrogen kepada atom halogen - klorin atau bromin.
Tindak balas berlaku apabila dipanaskan dan sentiasa dengan penyertaan mangkin. Dalam kes klorin, ia boleh menjadi aluminium klorida atau besi klorida tiga. Mangkin mempolarisasi molekul halogen, mengakibatkan pemecahan ikatan heterolitik dan ion diperoleh.
Ion klorida bercas positif bertindak balas dengan benzena.
Jika tindak balas berlaku dengan bromin, maka besi tribromida atau aluminium bromida bertindak sebagai pemangkin.

Adalah penting untuk ambil perhatian bahawa tindak balas berlaku dengan bromin molekul dan bukan dengan air bromin. Benzena tidak bertindak balas dengan air bromin.
Halogenasi homolog benzena mempunyai ciri tersendiri. Dalam molekul toluena, kumpulan metil memudahkan penggantian dalam cincin, kereaktifan meningkat, dan tindak balas berlangsung dalam keadaan yang lebih ringan, iaitu, sudah pada suhu bilik.

Adalah penting untuk diperhatikan bahawa penggantian sentiasa berlaku dalam kedudukan orto dan para, jadi campuran isomer diperoleh.
Kedua harta - penitratan benzena, pengenalan kumpulan nitro ke dalam cincin benzena.

Cecair kekuningan berat dengan bau badam pahit terbentuk - nitrobenzene, jadi tindak balas boleh menjadi kualitatif untuk benzena. Untuk penitratan, campuran penitratan asid nitrik dan sulfurik pekat digunakan. Tindak balas dijalankan dengan pemanasan.
Biar saya ingatkan anda bahawa untuk penitratan alkana dalam tindak balas Konovalov, asid nitrik cair digunakan tanpa penambahan asid sulfurik.
Dalam penitratan toluena, serta dalam halogenasi, campuran isomer orto dan para-terbentuk.

Ketiga sifat - pengalkilasi benzena dengan haloalkana.

Tindak balas ini membenarkan kemasukan radikal hidrokarbon ke dalam cincin benzena dan boleh dianggap sebagai kaedah untuk mendapatkan homolog benzena. Aluminium klorida digunakan sebagai pemangkin, yang menggalakkan penguraian molekul haloalkana menjadi ion. Ia juga memerlukan pemanasan.
Keempat sifat - pengalkilasi benzena dengan alkena.

Dengan cara ini, sebagai contoh, kumen atau etilbenzena boleh diperolehi. Mangkinnya ialah aluminium klorida.
2. Tindak balas penambahan kepada benzena
Kumpulan tindak balas kedua ialah tindak balas penambahan. Kami mengatakan bahawa tindak balas ini bukan ciri, tetapi ia mungkin dalam keadaan yang agak keras dengan pemusnahan awan pi-elektron dan pembentukan enam ikatan sigma.
Kelima harta dalam senarai umum - penghidrogenan, penambahan hidrogen.
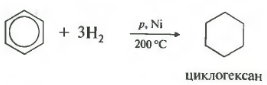
Suhu, tekanan, nikel pemangkin atau platinum. Toluene mampu bertindak balas dengan cara yang sama.
keenam harta - pengklorinan. Sila ambil perhatian bahawa kita bercakap secara khusus mengenai interaksi dengan klorin, kerana bromin tidak memasuki tindak balas ini.

Tindak balas berlaku di bawah penyinaran ultraungu yang keras. Hexachlorocyclohexane, nama lain untuk hexachlorane, terbentuk, pepejal.
Adalah penting untuk diingat bahawa untuk benzena tidak mungkin tindak balas penambahan hidrogen halida (hidrohalogenasi) dan penambahan air (penghidratan).
3. Penggantian dalam rantai sisi homolog benzena
Kumpulan tindak balas ketiga hanya melibatkan homolog benzena - ini adalah penggantian dalam rantai sampingan.
ketujuh sifat dalam senarai umum ialah halogenasi pada atom karbon alfa dalam rantai sisi.

Tindak balas berlaku apabila dipanaskan atau disinari, dan sentiasa hanya pada karbon alfa. Apabila halogenasi berterusan, atom halogen kedua akan kembali ke kedudukan alfa.
4. Pengoksidaan homolog benzena
Kumpulan tindak balas keempat ialah pengoksidaan.
Cincin benzena terlalu kuat, jadi benzena tidak teroksida kalium permanganat - tidak mengubah warna larutannya. Ini sangat penting untuk diingati.
Sebaliknya, homolog benzena dioksidakan dengan larutan kalium permanganat berasid apabila dipanaskan. Dan ini adalah sifat kimia kelapan.

Ternyata asid benzoik. Perubahan warna larutan diperhatikan. Dalam kes ini, tidak kira berapa lama rantai karbon substituen itu, ia sentiasa putus selepas atom karbon pertama dan atom alfa dioksidakan kepada kumpulan karboksil dengan pembentukan asid benzoik. Selebihnya molekul dioksidakan kepada asid yang sepadan atau, jika ia hanya satu atom karbon, kepada karbon dioksida.
Jika homolog benzena mempunyai lebih daripada satu substituen hidrokarbon pada cincin aromatik, maka pengoksidaan berlaku mengikut peraturan yang sama - karbon dalam kedudukan alfa teroksida.

Dalam contoh ini, asid aromatik dibasic diperolehi, yang dipanggil asid phthalic.
Dengan cara yang istimewa, saya perhatikan pengoksidaan kumin, isopropilbenzena, dengan oksigen atmosfera dengan kehadiran asid sulfurik.

Ini adalah kaedah yang dipanggil cumene untuk menghasilkan fenol. Sebagai peraturan, seseorang perlu berurusan dengan tindak balas ini dalam perkara yang berkaitan dengan pengeluaran fenol. Ini adalah cara industri.
kesembilan harta - pembakaran, pengoksidaan lengkap dengan oksigen. Benzena dan homolognya terbakar menjadi karbon dioksida dan air.
Mari kita tulis persamaan untuk pembakaran benzena dalam bentuk am.
Mengikut undang-undang pemuliharaan jisim, sepatutnya terdapat banyak atom di sebelah kiri seperti mana terdapat atom di sebelah kanan. Kerana, selepas semua, dalam tindak balas kimia, atom tidak pergi ke mana-mana, tetapi susunan ikatan di antara mereka hanya berubah. Jadi akan ada molekul karbon dioksida sebanyak mana terdapat atom karbon dalam molekul arene, kerana molekul itu mengandungi satu atom karbon. Iaitu n molekul CO 2. Akan ada separuh daripada molekul air daripada atom hidrogen, iaitu, (2n-6) / 2, yang bermaksud n-3.
Terdapat bilangan atom oksigen yang sama di sebelah kiri dan di sebelah kanan. Di sebelah kanan, terdapat 2n daripada karbon dioksida, kerana terdapat dua atom oksigen dalam setiap molekul, ditambah n-3 daripada air, untuk jumlah 3n-3. Di sebelah kiri, terdapat bilangan atom oksigen yang sama - 3n-3, yang bermaksud terdapat separuh daripada banyak molekul, kerana molekul itu mengandungi dua atom. Iaitu (3n-3)/2 molekul oksigen.
Oleh itu, kami telah menyusun persamaan untuk pembakaran homolog benzena dalam bentuk umum.
DEFINISI
Benzena(cyclohexatriene - 1,3,5) - bahan organik, wakil paling mudah bagi beberapa hidrokarbon aromatik.
Formula - C 6 H 6 (formula struktur - Rajah 1). Berat molekul - 78, 11.
nasi. 1. Formula struktur dan ruang benzena.
Kesemua enam atom karbon dalam molekul benzena berada dalam keadaan hibrid sp 2. Setiap atom karbon membentuk ikatan 3σ dengan dua atom karbon lain dan satu atom hidrogen terletak pada satah yang sama. Enam atom karbon membentuk heksagon sekata (rangka-σ molekul benzena). Setiap atom karbon mempunyai satu orbital p yang tidak berhibrid, yang mengandungi satu elektron. Enam p-elektron membentuk awan π-elektron tunggal (sistem aromatik), yang digambarkan sebagai bulatan di dalam kitaran enam anggota. Radikal hidrokarbon yang berasal daripada benzena dipanggil C 6 H 5 - - fenil (Ph-).
Sifat kimia benzena
Benzena dicirikan oleh tindak balas penggantian yang berjalan mengikut mekanisme elektrofilik:
- halogenasi (benzena berinteraksi dengan klorin dan bromin dengan kehadiran pemangkin - AlCl 3 kontang, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- penitratan (benzena mudah bertindak balas dengan campuran penitratan - campuran asid nitrik dan sulfurik pekat)

- alkilasi dengan alkena
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Tindak balas penambahan kepada benzena membawa kepada kemusnahan sistem aromatik dan hanya berlaku dalam keadaan yang teruk:
- penghidrogenan (tindak balas berlaku apabila dipanaskan, mangkinnya ialah Pt)

- penambahan klorin (berlaku di bawah tindakan sinaran UV dengan pembentukan produk pepejal - heksachlorocyclohexane (hexachloran) - C 6 H 6 Cl 6)

Seperti mana-mana sebatian organik, benzena memasuki tindak balas pembakaran dengan pembentukan karbon dioksida dan air sebagai hasil tindak balas (ia terbakar dengan nyalaan berasap):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
Sifat fizikal benzena
Benzena ialah cecair tidak berwarna, tetapi mempunyai bau pedas tertentu. Membentuk campuran azeotropik dengan air, bercampur baik dengan eter, petrol dan pelbagai pelarut organik. Takat didih - 80.1C, takat lebur - 5.5C. Toksik, karsinogen (iaitu menyumbang kepada perkembangan kanser).
Mendapatkan dan menggunakan benzena
Kaedah utama untuk mendapatkan benzena:
— penyahhidrocyclisasian heksana (mangkin - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
- penyahhidrogenan sikloheksana (tindak balas berlaku apabila dipanaskan, mangkinnya ialah Pt)
C 6 H 12 → C 6 H 6 + 4H 2;
– trimerisasi asetilena (tindak balas berlaku apabila dipanaskan hingga 600C, mangkin adalah karbon teraktif)
3HC≡CH → C 6 H 6 .
Benzena berfungsi sebagai bahan mentah untuk penghasilan homolog (etilbenzena, kumen), sikloheksana, nitrobenzena, klorobenzena, dan bahan-bahan lain. Sebelum ini, benzena digunakan sebagai bahan tambahan kepada petrol untuk meningkatkan nombor oktananya, namun kini, disebabkan ketoksikannya yang tinggi, kandungan benzena dalam bahan api dikawal dengan ketat. Kadangkala benzena digunakan sebagai pelarut.
Contoh penyelesaian masalah
CONTOH 1
| Tugas | Tuliskan persamaan yang anda boleh menjalankan penjelmaan berikut: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Penyelesaian | Untuk mendapatkan asetilena daripada metana, tindak balas berikut digunakan: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). Mendapatkan benzena daripada asetilena adalah mungkin melalui tindak balas trimerisasi asetilena, yang berlaku apabila dipanaskan (t = 600C) dan dengan kehadiran karbon teraktif: 3C 2 H 2 → C 6 H 6 . Tindak balas pengklorinan benzena untuk mendapatkan klorobenzena sebagai produk dijalankan dengan kehadiran besi (III) klorida: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
CONTOH 2
| Tugas | Kepada 39 g benzena dengan kehadiran besi (III) klorida telah ditambah 1 mol air bromin. Apakah jumlah bahan dan berapa gram produk apakah yang dihasilkan oleh ini? |
| Penyelesaian | Mari kita tulis persamaan untuk tindak balas pembrominasian benzena dengan kehadiran besi (III) klorida: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Hasil tindak balas ialah bromobenzena dan hidrogen bromida. Jisim molar benzena, dikira menggunakan jadual unsur kimia D.I. Mendeleev - 78 g/mol. Cari jumlah bahan benzena: n(C 6 H 6) = m(C 6 H 6) / M(C 6 H 6); n(C 6 H 6) = 39/78 = 0.5 mol. Mengikut keadaan masalah, benzena bertindak balas dengan 1 mol bromin. Akibatnya, benzena kekurangan bekalan dan pengiraan selanjutnya akan dibuat untuk benzena. Mengikut persamaan tindak balas n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1, oleh itu n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n(HBr) = 0.5 mol. Kemudian, jisim bromobenzena dan hidrogen bromida akan sama: m(C 6 H 5 Br) = n(C 6 H 5 Br)×M(C 6 H 5 Br); m(HBr) = n(HBr)×M(HBr). Jisim molar bromobenzena dan hidrogen bromida, dikira menggunakan jadual unsur kimia D.I. Mendeleev - 157 dan 81 g/mol, masing-masing. m(C 6 H 5 Br) = 0.5×157 = 78.5 g; m(HBr) = 0.5 x 81 = 40.5 g. |
| Jawab | Hasil tindak balas ialah bromobenzena dan hidrogen bromida. Jisim bromobenzena dan hidrogen bromida masing-masing ialah 78.5 dan 40.5 g. |
Sebatian seperti benzena, Puan Kimia dalam isi rumahnya akhirnya dan tidak boleh ditarik balik diperoleh hanya pada tahun 1833. Benzena ialah sebatian yang mempunyai sifat cepat marah, boleh dikatakan, malah sifat meletup. Bagaimana anda mengetahuinya?
Sejarah
Johann Glauber pada tahun 1649 mengalihkan perhatiannya kepada sebatian yang telah berjaya dibentuk semasa ahli kimia sedang mengusahakan tar arang batu. Tetapi ia mahu kekal inkognito.
Kira-kira 170 tahun kemudian, atau lebih tepat lagi, pada pertengahan dua puluhan abad ke-19, secara kebetulan, benzena telah diekstrak daripada gas pencahayaan, iaitu daripada kondensat yang dibebaskan. Umat manusia berhutang usaha sedemikian kepada Michael Faraday, seorang saintis dari England.
Baton untuk pemerolehan benzena telah dipintas oleh Eilgard Mitscherlich Jerman. Ini berlaku semasa pemprosesan garam kalsium anhydrous asid benzoik. Mungkin itulah sebabnya sebatian itu diberi nama sedemikian - benzena. Namun, sebagai pilihan, saintis memanggilnya petrol. Kemenyan, jika diterjemahkan daripada bahasa Arab.
Benzena terbakar dengan indah dan terang, sehubungan dengan pemerhatian ini, Auguste Laurent menasihatkan untuk memanggilnya "fen" atau "benzena". Cerah, bersinar - jika diterjemahkan daripada bahasa Yunani.
Berdasarkan pendapat konsep sifat ikatan elektronik, kualiti benzena, saintis menyediakan molekul sebatian dalam bentuk imej berikut. Ini adalah heksagon. Sebuah bulatan tertulis di dalamnya. Perkara di atas menunjukkan bahawa benzena mempunyai awan elektron integral, yang selamat mengandungi enam (tanpa pengecualian) atom karbon kitaran. Tiada ikatan binari tetap.
Benzena sebelum ini dianggap sebagai pelarut. Tetapi pada asasnya, seperti yang mereka katakan, dia bukan ahli, tidak mengambil bahagian, tidak terlibat. Tetapi ini pada abad ke-19. Perubahan ketara berlaku pada XX. Sifat benzena menyatakan kualiti paling berharga yang membantunya menjadi lebih popular. Nombor oktana, yang ternyata tinggi, memungkinkan untuk menggunakannya sebagai elemen bahan api untuk mengisi minyak kereta. Tindakan ini adalah dorongan untuk pengeluaran benzena secara meluas, pengekstrakan yang dijalankan sebagai hasil sampingan daripada pembuatan kokas pengeluaran keluli.
Menjelang empat puluhan, dalam bidang kimia, benzena mula digunakan dalam pembuatan bahan yang meletup dengan cepat. Abad ke-20 memahkotai dirinya dengan fakta bahawa industri penapisan minyak menghasilkan banyak benzena sehingga ia mula membekalkan industri kimia.
Pencirian benzena
Hidrokarbon tak tepu sangat mirip dengan benzena. Sebagai contoh, siri hidrokarbon etilena mencirikan dirinya sebagai hidrokarbon tak tepu. Ia mempunyai tindak balas penambahan. Benzena dengan rela hati memasuki Semua ini terima kasih kepada atom yang berada dalam satah yang sama. Dan sebagai fakta - awan elektron terkonjugasi.

Sekiranya terdapat cincin benzena dalam formula, maka kita boleh membuat kesimpulan asas bahawa ini adalah benzena, formula strukturnya kelihatan seperti ini.
Ciri-ciri fizikal
Benzena adalah cecair tidak berwarna, tetapi mempunyai bau yang tidak menyenangkan. Benzena cair apabila suhu mencapai 5.52 darjah Celsius. Mendidih pada 80.1. Ketumpatan ialah 0.879 g / cm 3, jisim molar ialah 78.11 g / mol. Apabila terbakar, ia berasap dengan kuat. Membentuk sebatian letupan apabila udara masuk. batu (petrol, eter dan lain-lain) digabungkan dengan bahan yang diterangkan tanpa masalah. Sebatian azeotropik terhasil dengan air. Pemanasan sebelum permulaan pengewapan berlaku pada 69.25 darjah (91% benzena). Pada 25 darjah Celcius, 1.79 g / l boleh larut dalam air.
Sifat kimia
Benzena bertindak balas dengan asid sulfurik dan nitrik. Dan juga dengan alkena, halogen, kloroalkana. Reaksi penggantian adalah ciri-cirinya. Suhu tekanan mempengaruhi penembusan cincin benzena, yang berlaku dalam keadaan yang agak keras.
Kita boleh mempertimbangkan setiap persamaan tindak balas benzena dengan lebih terperinci.
1. Penggantian elektrofilik. Bromin, dengan kehadiran pemangkin, berinteraksi dengan klorin. Hasilnya ialah klorobenzena:
С6H6+3Cl2 → C6H5Cl + HCl
2. Tindak balas Friedel-Crafts, atau alkilasi benzena. Penampilan alkilbenzena berlaku disebabkan oleh gabungan dengan alkana, yang merupakan terbitan halogen:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Penggantian elektrofilik. Berikut ialah tindak balas penitratan dan sulfonasi. Persamaan benzena akan kelihatan seperti ini:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Benzena apabila terbakar:
2C6H6 + 15O2 → 12CO2 + 6H2O
Dalam keadaan tertentu, ia mempamerkan ciri ciri hidrokarbon tepu. Awan p-elektron, yang berada dalam struktur bahan yang sedang dipertimbangkan, menerangkan tindak balas ini.
Pelbagai jenis benzena bergantung kepada teknologi khas. Di sinilah pelabelan petroleum benzena berasal. Contohnya, penulenan yang disucikan dan lebih tinggi, untuk sintesis. Saya ingin menyatakan secara berasingan homolog benzena, dan lebih khusus lagi, sifat kimianya. Ini adalah alkilbenzena.

Homolog Benzena lebih berkemungkinan untuk bertindak balas. Tetapi tindak balas benzena di atas, iaitu homolog, berlaku dengan sedikit perbezaan.
Halogenasi alkilbenzena
Bentuk persamaan adalah seperti berikut:
С6H5-CH3 + Br = C6H5-CH2Br + HBr.
Aspirasi bromin ke dalam gelang benzena tidak diperhatikan. Ia masuk ke rantai di sebelah. Tetapi terima kasih kepada pemangkin garam Al(+3), bromin dengan berani memasuki cincin.
Pennitratan alkilbenzena
Terima kasih kepada asid sulfurik dan nitrik, benzena dan alkilbenzena dinitratkan. Alkilbenzena reaktif. Dua produk diperoleh daripada tiga yang dibentangkan - ini adalah para- dan orto-isomer. Anda boleh menulis salah satu formula:
C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2)3.
Pengoksidaan
Untuk benzena, ini tidak boleh diterima. Tetapi alkilbenzena bertindak balas dengan rela. Contohnya, asid benzoik. Formulanya di bawah:
C6H5CH3 + [O] → C6H5COOH.
Alkilbenzena dan benzena, penghidrogenan mereka
Dengan adanya penambah, hidrogen mula bertindak balas dengan benzena, menghasilkan pembentukan sikloheksana, seperti yang dibincangkan di atas. Begitu juga, alkilbenzena mudah ditukar kepada alkilsikloheksana. Untuk mendapatkan alkilsikloheksana, ia dikehendaki menundukkan alkilbenzena yang dikehendaki kepada penghidrogenan. Pada asasnya, ia adalah prosedur yang diperlukan untuk pengeluaran produk tulen. Dan ini bukan semua tindak balas benzena dan alkilbenzena.
Pengeluaran Benzena. industri
Asas pengeluaran sedemikian adalah berdasarkan pemprosesan komponen: toluena, nafta, tar, yang dikeluarkan semasa retak arang batu, dan lain-lain. Oleh itu, benzena dihasilkan di perusahaan petrokimia, metalurgi. Adalah penting untuk mengetahui cara mendapatkan benzena dengan tahap penulenan yang berbeza-beza, kerana jenama bahan ini secara langsung bergantung pada prinsip pembuatan dan tujuan.
Bahagian singa dibuat oleh reformasi termokatalitik bahagian kaustobiolit, mendidih pada 65 darjah, mempunyai kesan ekstrak, penyulingan dengan dimetilformamida.
Semasa pengeluaran etilena dan propilena, produk cecair diperolehi, yang terbentuk semasa penguraian sebatian bukan organik dan organik di bawah pengaruh haba. Daripada jumlah ini, benzena diasingkan. Tetapi, malangnya, tidak banyak bahan sumber untuk pilihan pengeluaran benzena ini. Oleh itu, bahan yang menarik minat kita dihasilkan melalui pembaharuan. Dengan kaedah ini, isipadu benzena meningkat.

Dengan dealkylation pada suhu 610-830 darjah dengan tanda tambah, dengan kehadiran wap yang terbentuk semasa mendidih air dan hidrogen, benzena diperoleh daripada toluena. Terdapat pilihan lain - pemangkin. Apabila kehadiran zeolit, atau, sebagai alternatif, pemangkin oksida, diperhatikan, tertakluk kepada rejim suhu 227-627 darjah.
Terdapat satu lagi cara yang lebih lama untuk membangunkan benzena. Dengan bantuan penyerapan oleh penyerap organik, ia diasingkan daripada hasil akhir coking arang batu. Produk ini adalah gas wap dan telah disejukkan terlebih dahulu. Sebagai contoh, minyak digunakan, sumbernya adalah minyak atau arang batu. Apabila penyulingan dijalankan dengan wap, pemulung dipisahkan. Hydrotreating membantu membebaskan benzena mentah daripada bahan berlebihan.
Bahan mentah arang batu
Dalam metalurgi, apabila arang batu digunakan, atau, lebih tepat, penyulingan keringnya, kok diperolehi. Semasa prosedur ini, bekalan udara adalah terhad. Jangan lupa bahawa arang batu dipanaskan pada suhu 1200-1500 Celsius.
Benzena kimia arang batu memerlukan penulenan menyeluruh. Ia adalah perlu untuk menyingkirkan metil sikloheksana dan rakannya n-heptana tanpa gagal. juga harus dikeluarkan. Benzena akan menjalani proses pemisahan, penulenan, yang akan dijalankan lebih daripada sekali.
Kaedah yang diterangkan di atas adalah yang tertua, tetapi selepas masa ia kehilangan kedudukan tingginya.
Pecahan minyak
0.3-1.2% - penunjuk seperti komposisi wira kami dalam minyak mentah. Penunjuk yang sedikit untuk melabur kewangan dan kuasa. Adalah lebih baik untuk menggunakan prosedur industri untuk memproses pecahan petroleum. Itu adalah reformasi pemangkin. Dengan kehadiran penguat aluminium-platinum-rhenium, peratusan kemasukan karbohidrat aromatik meningkat, dan penunjuk yang menentukan keupayaan bahan api untuk tidak menyala secara spontan semasa pemampatannya meningkat.
Resin pirolisis
Jika produk minyak kami diekstrak daripada bahan mentah bukan pepejal, iaitu dengan pirolisis propilena dan etilena yang timbul dalam pembuatan, maka pendekatan ini akan menjadi yang paling boleh diterima. Untuk menjadi tepat, benzena dibebaskan daripada pirokondensat. Penguraian pecahan tertentu memerlukan rawatan hidro. Campuran sulfur dan tak tepu dikeluarkan semasa pembersihan. Dalam keputusan awal, kandungan xilena, toluena, benzena dicatatkan. Dengan bantuan penyulingan, yang bersifat ekstraktif, kumpulan BTX dipisahkan dan benzena diperoleh.

Hidrodealkilasi toluena
Protagonis proses, koktel aliran hidrogen dan toluena, disuapkan dipanaskan ke dalam reaktor. Toluena melalui dasar mangkin. Semasa proses ini, kumpulan metil dipisahkan untuk membentuk benzena. Terdapat cara penyucian tertentu di sini. Hasilnya ialah bahan yang sangat tulen (untuk penitratan).
Ketakkadaran Toluena
Hasil daripada penolakan kelas metil, penciptaan kepada benzena berlaku, xilena teroksida. Dalam proses ini, transalkilasi telah diperhatikan. Tindakan pemangkin adalah disebabkan oleh paladium, platinum dan neodymium, yang terdapat pada aluminium oksida.
Toluena dan hidrogen dibekalkan kepada reaktor dengan katil mangkin yang stabil. Tujuannya adalah untuk mengekalkan hidrokarbon daripada mendap pada satah mangkin. Aliran yang keluar dari reaktor disejukkan, dan hidrogen dipulihkan dengan selamat untuk dikitar semula. Apa yang tinggal disuling tiga kali. Pada peringkat awal, sebatian yang bukan aromatik ditarik balik. Benzena diekstrak kedua, dan langkah terakhir ialah pengekstrakan xilena.
Trimerisasi asetilena
Terima kasih kepada kerja ahli kimia fizikal Perancis Marcelin Berthelot, benzena mula dihasilkan daripada asetilena. Tetapi pada masa yang sama, koktel berat menonjol daripada banyak unsur lain. Persoalannya ialah bagaimana untuk menurunkan suhu tindak balas. Jawapannya diterima hanya pada penghujung empat puluhan abad XX. V. Reppe menemui pemangkin yang sesuai, ternyata nikel. Trimerisasi adalah satu-satunya cara untuk mendapatkan benzena daripada asetilena.

Pembentukan benzena berlaku dengan bantuan karbon teraktif. Pada kadar haba yang tinggi, asetilena melepasi arang batu. Benzena dibebaskan jika suhu sekurang-kurangnya 410 darjah. Pada masa yang sama, pelbagai hidrokarbon aromatik masih dilahirkan. Oleh itu, peralatan yang baik diperlukan yang mampu memurnikan asetilena secara kualitatif. Dengan kaedah yang sukar seperti trimerisasi, banyak asetilena digunakan. Untuk mendapatkan 15 ml benzena, 20 liter asetilena diambil. Anda boleh melihat bagaimana ia kelihatan dalam tindak balas tidak akan mengambil masa yang lama.
3C2H2 → C6H6 (persamaan Zelinsky).
3CH → CH = (t, kat) = C6H6.
Di mana benzena digunakan
Benzene adalah idea kimia yang agak popular. Terutama sering diperhatikan bagaimana benzena digunakan dalam pembuatan kumen, sikloheksana, etilbenzena. Untuk mencipta stirena, etilbenzena sangat diperlukan. Bahan permulaan untuk penghasilan kaprolaktam ialah sikloheksana. Apabila membuat resin termoplastik, ia adalah kaprolaktam yang digunakan. Bahan yang diterangkan sangat diperlukan dalam pembuatan pelbagai cat dan varnis.
Betapa bahayanya benzena
Benzena adalah bahan toksik. Manifestasi rasa malaise, yang disertai dengan loya dan pening yang teruk, adalah tanda keracunan. Malah kematian juga tidak diketepikan. Perasaan seronok yang tidak dapat digambarkan tidak kurang juga yang mengganggu jika berlaku keracunan benzena.
Benzena cecair menyebabkan kerengsaan kulit. Wap benzene mudah meresap walaupun melalui kulit yang utuh. Dengan hubungan jangka pendek yang paling singkat dengan bahan dalam dos yang kecil, tetapi secara tetap, akibat yang tidak menyenangkan tidak akan lama lagi. Ini mungkin lesi sumsum tulang dan leukemia akut pelbagai jenis.

Di samping itu, bahan tersebut menyebabkan ketagihan pada manusia. Benzena bertindak seperti dadah. Asap tembakau menghasilkan produk seperti tar. Apabila mereka mengkajinya, mereka membuat kesimpulan bahawa kandungan yang terakhir itu tidak selamat untuk manusia. Selain kehadiran nikotin, kehadiran karbohidrat aromatik jenis benzpyrene juga didapati. Ciri tersendiri benzpyrene ialah karsinogen. Mereka mempunyai kesan yang sangat berbahaya. Sebagai contoh, mereka menyebabkan kanser.
Walaupun yang dinyatakan di atas, benzena adalah bahan permulaan untuk pengeluaran pelbagai ubat, plastik, getah sintetik dan, sudah tentu, pewarna. Ini adalah idea kimia dan sebatian aromatik yang paling biasa.
Struktur kitaran benzena pertama kali dicadangkan oleh F.A. Kekule pada tahun 1865

Friedrich August Kekule von Stradonitz ialah seorang ahli kimia Jerman yang cemerlang pada abad ke-19. Pada tahun 1854, beliau menemui sebatian organik pertama yang mengandungi sulfur - asid thioacetic (asid thioethanoic). Di samping itu, beliau menubuhkan struktur sebatian diazo. Walau bagaimanapun, sumbangannya yang paling terkenal kepada pembangunan kimia ialah penubuhan struktur benzena (1866). Kekule menunjukkan bahawa ikatan berganda benzena silih berganti di sekeliling cincin (idea ini mula-mula berlaku kepadanya dalam mimpi). Dia kemudiannya menunjukkan bahawa dua susunan ikatan berganda yang mungkin adalah sama dan bahawa cincin benzena adalah hibrid antara kedua-dua struktur. Oleh itu, beliau menjangkakan konsep resonans (mesomerisme), yang muncul dalam teori ikatan kimia pada awal 1930-an.
Jika benzena benar-benar mempunyai struktur sedemikian, maka terbitan 1,2-tersubstitusinya harus mempunyai dua isomer setiap satu. Sebagai contoh,

Walau bagaimanapun, tiada satu pun daripada benzena tersubstitusi 1,2 boleh mengasingkan dua isomer.
Oleh itu, Kekule kemudiannya mencadangkan bahawa molekul benzena wujud sebagai dua struktur yang cepat melepasi satu sama lain:

Perhatikan bahawa gambaran skematik molekul benzena dan terbitannya biasanya tidak menunjukkan atom hidrogen yang melekat pada atom karbon cincin benzena.
Dalam kimia moden, molekul benzena dianggap sebagai hibrid resonan daripada dua bentuk resonan yang mengehadkan ini (lihat Bahagian 2.1). Penerangan lain tentang molekul benzena adalah berdasarkan pertimbangan orbital molekulnya. Dalam sek. 3.1, telah ditunjukkan bahawa elektron -elektron yang terletak dalam orbital ikatan - diasingkan di antara semua atom karbon gelang benzena dan membentuk awan -elektron. Selaras dengan perwakilan ini, molekul benzena boleh digambarkan secara konvensional seperti berikut:
Data eksperimen mengesahkan kehadiran struktur sedemikian dalam benzena. Jika benzena mempunyai struktur seperti yang dicadangkan oleh Kekule pada asalnya, dengan tiga ikatan rangkap terkonjugasi, maka benzena perlu bertindak balas seperti alkena. Walau bagaimanapun, seperti yang dinyatakan di atas, benzena tidak memasuki tindak balas penambahan. Di samping itu, benzena lebih stabil daripada jika ia mempunyai tiga ikatan berganda terpencil. Dalam sek. 5.3 telah ditunjukkan bahawa entalpi penghidrogenan benzena dengan pembentukan sikloheksana mempunyai negatif yang lebih besar.
Jadual 18.3. Panjang pelbagai ikatan karbon-karbon


nasi. 18.6. Struktur geometri molekul benzena.
nilai daripada tiga kali ganda entalpi penghidrogenan sikloheksena. Perbezaan antara nilai ini biasanya dipanggil entalpi penyahtempatan, tenaga resonans, atau tenaga penstabilan benzena.
Semua ikatan karbon-karbon dalam cincin benzena mempunyai panjang yang sama, iaitu kurang daripada panjang ikatan C-C dalam alkana, tetapi lebih panjang daripada panjang ikatan C=C dalam alkena (Jadual 18.3). Ini mengesahkan bahawa ikatan karbon-karbon dalam benzena adalah hibrid antara ikatan tunggal dan berganda.
Molekul benzena mempunyai struktur rata, yang ditunjukkan dalam Rajah. 18.6.
Ciri-ciri fizikal
Dalam keadaan biasa, benzena ialah cecair tidak berwarna yang membeku pada 5.5°C dan mendidih pada 80°C. Ia mempunyai ciri bau yang menyenangkan, tetapi, seperti yang dinyatakan di atas, sangat toksik. Benzena tidak boleh bercampur dengan air, dan dalam sistem benzena, air membentuk bahagian atas dua lapisan. Walau bagaimanapun, ia larut dalam pelarut organik bukan polar dan ia sendiri merupakan pelarut yang baik untuk sebatian organik lain.
Sifat kimia
Walaupun benzena memasuki tindak balas penambahan tertentu (lihat di bawah), ia tidak menunjukkan kereaktifan tipikal alkena di dalamnya. Contohnya, ia tidak menyahwarnakan air bromin atau larutan α-ion. Selain itu, benzena
memasuki tindak balas penambahan dengan asid kuat, seperti asid hidroklorik atau sulfurik.
Pada masa yang sama, benzena mengambil bahagian dalam beberapa tindak balas penggantian elektrofilik. Sebatian aromatik adalah hasil tindak balas jenis ini, kerana sistem elektron terdelokalisasi benzena dikekalkan dalam tindak balas ini. Mekanisme umum penggantian atom hidrogen pada cincin benzena oleh beberapa elektrofil diterangkan dalam Bahagian. 17.3. Contoh penggantian elektrofilik benzena ialah nitrasi, halogenasi, sulfonasi, dan tindak balas Friedel-Crafts.
Nitrasi. Benzena boleh dinitratkan (memasukkan kumpulan ke dalamnya) dengan merawatnya dengan campuran asid nitrik dan sulfurik pekat:

Nitrobenzena
Keadaan untuk tindak balas ini dan mekanismenya diterangkan dalam Bahagian. 17.3.
Nitrobenzene ialah cecair kuning pucat dengan ciri bau badam. Semasa penitratan benzena, sebagai tambahan kepada nitrobenzena, kristal 1,3-dinitrobenzena juga terbentuk, yang merupakan hasil tindak balas berikut:

Halogenasi. Jika anda mencampurkan benzena dalam gelap dengan klorin atau bromin, tiada kanser akan berlaku. Walau bagaimanapun, dengan kehadiran pemangkin dengan sifat asid Lewis, tindak balas penggantian elektrofilik berlaku dalam campuran tersebut. Pemangkin biasa untuk tindak balas ini ialah besi(III) bromida dan aluminium klorida. Tindakan pemangkin ini ialah mereka mencipta polarisasi dalam molekul halogen, yang kemudiannya membentuk kompleks dengan mangkin:
walaupun tiada bukti langsung bahawa ion bebas terbentuk dalam kes ini. Mekanisme pembrominasian benzena menggunakan besi (III) bromida sebagai pembawa ion boleh diwakili seperti berikut:

Sulfonasi. Benzena boleh tersulfonasi (menggantikan atom hidrogen di dalamnya dengan kumpulan sulfo) dengan merefluks campurannya dengan asid sulfurik pekat selama beberapa jam. Sebaliknya, benzena boleh dipanaskan perlahan-lahan bercampur dengan asid sulfurik wasap. Asid sulfurik wasap mengandungi sulfur trioksida. Mekanisme tindak balas ini boleh diwakili oleh skema

Reaksi Friedel-Crafts. Tindak balas Friedel-Crafts pada asalnya dipanggil tindak balas pemeluwapan antara sebatian aromatik dan alkil halida dengan kehadiran mangkin aluminium klorida kontang.
Dalam tindak balas pemeluwapan, dua molekul bahan tindak balas (atau satu bahan tindak balas) bergabung antara satu sama lain, membentuk molekul sebatian baru, manakala molekul beberapa sebatian ringkas, seperti air atau hidrogen klorida, dipisahkan (menghapuskan) daripadanya.
Pada masa ini, tindak balas Friedel-Crafts ialah sebarang penggantian elektrofilik bagi sebatian aromatik di mana karbokation atau kompleks sangat terpolarisasi dengan atom karbon bercas positif memainkan peranan sebagai elektrofil. Agen elektrofilik biasanya alkil halida atau klorida asid karboksilik, walaupun ia juga boleh, sebagai contoh, alkena atau alkohol. Aluminium klorida kontang biasanya digunakan sebagai pemangkin untuk tindak balas ini. Tindak balas Friedel-Crafts biasanya dibahagikan kepada dua jenis: alkilasi dan asilasi.
Alkilasi. Dalam tindak balas Friedel-Crafts jenis ini, satu atau lebih atom hidrogen dalam cincin benzena digantikan oleh kumpulan alkil. Sebagai contoh, apabila campuran benzena dan klorometana dipanaskan dengan berhati-hati dengan kehadiran aluminium klorida kontang, metilbenzena terbentuk. Klorometana memainkan peranan sebagai agen elektrofilik dalam tindak balas ini. Ia dipolarisasi oleh aluminium klorida dengan cara yang sama seperti yang berlaku dengan molekul halogen:
Mekanisme tindak balas yang sedang dipertimbangkan boleh diwakili seperti berikut:

Perlu diingat bahawa dalam tindak balas pemeluwapan antara benzena dan klorometana ini, molekul hidrogen klorida dipisahkan. Kami juga ambil perhatian bahawa kewujudan sebenar karbokation logam dalam bentuk ion bebas adalah diragui.
Alkilasi benzena dengan klorometana dengan kehadiran mangkin - aluminium klorida kontang tidak berakhir dengan pembentukan metilbenzena. Dalam tindak balas ini, pengalkilasi selanjutnya bagi cincin benzena berlaku, yang membawa kepada pembentukan 1,2-dimetilbenzena:

Asilasi. Dalam tindak balas Friedel-Crafts jenis ini, atom hidrogen dalam cincin benzena digantikan oleh kumpulan asil, mengakibatkan pembentukan keton aromatik.
Kumpulan asil mempunyai formula umum
Nama sistematik sebatian asil dibentuk dengan menggantikan akhiran dan berakhiran -ova dalam nama asid karboksilik yang sepadan, yang mana sebatian asil yang diberikan adalah terbitan, dengan akhiran -(o)yl. Sebagai contoh

Asilasi benzena dilakukan dengan menggunakan klorida atau anhidrida asid karboksilik dengan kehadiran mangkin aluminium klorida kontang. Sebagai contoh

Tindak balas ini adalah pemeluwapan di mana penyingkiran molekul hidrogen klorida berlaku. Perhatikan juga bahawa nama "fenil" sering digunakan untuk menandakan cincin benzena dalam sebatian di mana benzena bukan kumpulan utama:

Tindak balas penambahan. Walaupun benzena adalah paling ciri tindak balas penggantian elektrofilik, ia juga memasuki beberapa tindak balas penambahan. Kami telah pun bertemu dengan salah seorang daripada mereka. Kita bercakap tentang penghidrogenan benzena (lihat Bahagian 5.3). Apabila campuran benzena dan hidrogen disalurkan ke atas permukaan mangkin nikel yang dikisar halus pada suhu 150–160 °C, keseluruhan urutan tindak balas berlaku, yang berakhir dengan pembentukan sikloheksana. Persamaan stoikiometri keseluruhan untuk tindak balas ini boleh diwakili seperti berikut:

Di bawah pengaruh sinaran ultraungu atau cahaya matahari langsung, benzena juga bertindak balas dengan klorin. Tindak balas ini dijalankan oleh mekanisme radikal yang kompleks. Produk akhirnya ialah 1,2,3,4,5,6-hexachlorocyclohexane:

Tindak balas yang serupa berlaku antara benzena dan bromin di bawah tindakan sinaran ultraungu atau cahaya matahari.
Pengoksidaan. Benzena dan cincin benzena dalam sebatian aromatik lain secara amnya tahan terhadap pengoksidaan walaupun oleh agen pengoksidaan yang kuat seperti larutan berasid atau beralkali kalium permanganat. Walau bagaimanapun, benzena dan sebatian aromatik lain terbakar dalam udara atau oksigen untuk membentuk nyalaan yang sangat berasap, yang tipikal untuk hidrokarbon dengan kandungan karbon relatif tinggi.

Ciri-ciri fizikal
Benzena dan homolog terdekatnya ialah cecair tidak berwarna dengan bau tertentu. Hidrokarbon aromatik lebih ringan daripada air dan tidak larut di dalamnya, bagaimanapun, mereka mudah larut dalam pelarut organik - alkohol, eter, aseton.
Benzena dan homolognya adalah pelarut yang baik untuk banyak bahan organik. Semua arena terbakar dengan nyalaan berasap kerana kandungan karbon yang tinggi dalam molekulnya.
Sifat fizikal beberapa arene dibentangkan dalam jadual.
Jadual. Sifat fizikal sesetengah arena
|
nama |
Formula |
t°.pl., |
t°.bp., |
|
Benzena |
C 6 H 6 |
5,5 |
80,1 |
|
Toluena (metilbenzena) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Etilbenzena |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Xylene (dimetilbenzena) |
C 6 H 4 (CH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pasangan- |
13,26 |
138,35 |
|
|
Propilbenzena |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Kumene (isopropilbenzena) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Stirena (vinilbenzena) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
Benzena - mendidih rendah ( tkip= 80.1°C), cecair tidak berwarna, tidak larut dalam air
Perhatian! Benzena - racun, bertindak pada buah pinggang, menukar formula darah (dengan pendedahan berpanjangan), boleh mengganggu struktur kromosom.
Kebanyakan hidrokarbon aromatik mengancam nyawa dan toksik.
Mendapatkan arena (benzena dan homolognya)
Dalam makmal
1. Percantuman garam asid benzoik dengan alkali pepejal
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
natrium benzoat
2. Tindak balas Wurtz-Fitting: (di sini G ialah halogen)
Dari 6H 5 -G+2Na + R-G →C 6 H 5 - R + 2 NaG
DARI 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Dalam industri
- diasingkan daripada minyak dan arang batu melalui penyulingan pecahan, reformasi;
- daripada tar arang batu dan gas ketuhar kok
1. Dehydrocyclization alkana dengan lebih daripada 6 atom karbon:
C 6 H 14 t , kat→C 6 H 6 + 4H 2
2. Trimerisasi asetilena(hanya untuk benzena) - R. Zelinsky:
3С 2 H2 600°C, Akta. arang→C 6 H 6
3. Penyahhidrogenan sikloheksana dan homolognya:
Ahli Akademik Soviet Nikolai Dmitrievich Zelinsky menegaskan bahawa benzena terbentuk daripada sikloheksana (penyahhidrogenan sikloalkana
C 6 H 12 t, kucing→C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat→C 6 H 5 -CH 3 + 3H 2
metilcyclohexanetoluene
4. Pengalkilasi benzena(mendapatkan homolog benzena) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
klooetana etilbenzena

Sifat kimia arene
saya. TINDAK BALAS PENGOKSIDAAN
1. Pembakaran (nyalaan asap):
2C 6 H 6 + 15O 2 t→12CO 2 + 6H 2 O + Q
2. Benzena dalam keadaan normal tidak menyahwarnakan air bromin dan larutan kalium permanganat berair
3. Homolog benzena dioksidakan oleh kalium permanganat (kalium permanganat berubah warna):
A) dalam persekitaran berasid kepada asid benzoik
Di bawah tindakan kalium permanganat dan oksidan kuat lain pada homolog benzena, rantai sampingan teroksida. Tidak kira betapa kompleksnya rantai substituen itu, ia dimusnahkan, kecuali atom a-karbon, yang teroksida menjadi kumpulan karboksil.
Homolog benzena dengan satu rantai sampingan memberikan asid benzoik:
Homolog yang mengandungi dua rantai sampingan memberikan asid dibasic:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Dipermudahkan :
C 6 H 5 -CH 3 + 3O KMnO4→C 6 H 5 COOH + H 2 O
B) dalam neutral dan sedikit beralkali kepada garam asid benzoik
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. TINDAK BALAS TAMBAHAN (lebih keras daripada alkena)
1. Halogenasi
C 6 H 6 + 3Cl 2 h ν → C 6 H 6 Cl 6 (hexachlorocyclohexane - hexachloran)
2. Penghidrogenan
C 6 H 6 + 3H 2 t , PtatauNi→C 6 H 12 (sikloheksana)
3. Pempolimeran
III. TINDAK BALAS PENGGANTIAN - mekanisme ionik (lebih ringan daripada alkana)
b) benzena homolog apabila penyinaran atau pemanasan
Dari segi sifat kimia, radikal alkil adalah serupa dengan alkana. Atom hidrogen di dalamnya digantikan oleh halogen oleh mekanisme radikal bebas. Oleh itu, jika tiada pemangkin, pemanasan atau penyinaran UV membawa kepada tindak balas penggantian radikal dalam rantai sisi. Pengaruh cincin benzena pada substituen alkil membawa kepada fakta bahawa atom hidrogen sentiasa digantikan pada atom karbon yang terikat terus pada cincin benzena (atom a-karbon).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) homolog benzena dengan kehadiran mangkin
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (campuran orta, pasangan derivatif) +HCl
2. Nitrasi (dengan asid nitrik)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzena - bau badam!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ DARI H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotoluene (tol, trotil)
Penggunaan benzena dan homolognya
Benzena C 6 H 6 ialah pelarut yang baik. Benzena sebagai bahan tambahan meningkatkan kualiti bahan api motor. Ia berfungsi sebagai bahan mentah untuk pengeluaran banyak sebatian organik aromatik - nitrobenzene C 6 H 5 NO 2 (pelarut, aniline diperoleh daripadanya), klorobenzena C 6 H 5 Cl, fenol C 6 H 5 OH, stirena, dll.
Toluene C 6 H 5 -CH 3 - pelarut yang digunakan dalam pembuatan pewarna, dadah dan bahan letupan (trotil (tol), atau 2,4,6-trinitrotoluene TNT).
Xylene C 6 H 4 (CH 3) 2 . Xilena teknikal ialah campuran tiga isomer ( ortho-, meta- Dan sepasang-xylenes) - digunakan sebagai pelarut dan produk permulaan untuk sintesis banyak sebatian organik.
Isopropilbenzena C 6 H 5 -CH (CH 3) 2 berfungsi untuk mendapatkan fenol dan aseton.
Terbitan klorin benzena digunakan untuk perlindungan tumbuhan. Oleh itu, hasil penggantian atom H dalam benzena dengan atom klorin ialah heksaklorobenzena C 6 Cl 6 - racun kulat; ia digunakan untuk pembalut benih kering gandum dan rai terhadap kotoran keras. Hasil penambahan klorin kepada benzena ialah heksachlorocyclohexane (heksachloran) C 6 H 6 Cl 6 - racun serangga; ia digunakan untuk mengawal serangga berbahaya. Bahan ini merujuk kepada racun perosak - cara kimia untuk memerangi mikroorganisma, tumbuhan dan haiwan.
Stirena C 6 H 5 - CH \u003d CH 2 berpolimer dengan sangat mudah, membentuk polistirena, dan kopolimer dengan butadiena - getah stirena-butadiena.
PENGALAMAN VIDEO
Apa lagi yang perlu dibaca
NOTA TERAKHIR
- Bagaimana untuk bekerja dengan perspektif dalam Photoshop
- Jalur tarik HVAT
- Bagaimana untuk belajar berenang untuk kanak-kanak: nasihat jurulatih Bila hendak mengajar kanak-kanak berenang
- Majikan enggan membayar untuk pemeriksaan perubatan Apa yang perlu dilakukan selepas
- Jem aprikot: memasak tanpa perlu bersusah payah!
