Liqandlar. Zülalın aktiv mərkəzi və onun liqandla qarşılıqlı əlaqəsi
Modul quruluşu | Mövzular |
Modul vahid 1 | 1.1. Zülalların struktur təşkili. Doğma zülal konformasiyasının formalaşması mərhələləri 1.2. Protein fəaliyyətinin əsasları. Protein funksiyasına təsir edən liqandlar kimi dərmanlar 1.3. Zülalların denatürasiyası və onların özbaşına renativasiyasının mümkünlüyü |
Modul vahid 2 | 1.4. Hemoqlobin nümunəsindən istifadə edərək oliqomerik zülalların quruluşu və fəaliyyətinin xüsusiyyətləri 1.5. Hüceyrə şəraitində yerli zülal konformasiyasının saxlanması 1.6. Zülalların müxtəlifliyi. İmmunoqlobulinlərdən istifadə edərək zülal ailələri 1.7. Zülalların fiziki-kimyəvi xassələri və onların ayrılması üsulları |
Modul vahid 1 MONOMER ZÜLALLARIN STRUKTUR TƏŞKİLİ VƏ ONLARIN FƏALİYYƏTİNİN ƏSASLARI
Tədris məqsədləri Bacarmaq:
1. İrsi və qazanılmış proteinopatiyaların inkişaf mexanizmlərini başa düşmək üçün zülalların struktur xüsusiyyətləri və zülal funksiyalarının onların strukturundan asılılığı haqqında biliklərdən istifadə edin.
2. Zülallarla qarşılıqlı əlaqədə olan və aktivliyini dəyişən liqandlar kimi bəzi dərman vasitələrinin müalicəvi təsir mexanizmlərini izah edin.
3. Zülalların struktur və funksional qeyri-sabitliyini və dəyişən şəraitdə denaturasiyaya meylini başa düşmək üçün onların strukturu və konformasiya labilliyi haqqında biliklərdən istifadə edin.
4. Tibbi materialların və alətlərin, həmçinin antiseptiklərin sterilizasiyası üçün vasitə kimi denaturasiya edən maddələrin istifadəsini izah edin.
Bilin:
1. Səviyyələr struktur təşkilatı zülallar.
2. Zülalların struktur və funksional müxtəlifliyini müəyyən edən ilkin quruluşunun əhəmiyyəti.
3. Zülallarda əmələ gəlmə mexanizmi aktiv mərkəz və zülalların fəaliyyətinin əsasını təşkil edən liqandla onun spesifik qarşılıqlı əlaqəsi.
4. Ekzogen liqandların (dərmanlar, toksinlər, zəhərlər) zülalların konformasiyasına və funksional fəaliyyətinə təsirinə dair nümunələr.
5. Zülal denaturasiyasının səbəbləri və nəticələri, denaturasiyaya səbəb olan amillər.
6. Təbabətdə denaturasiya edən amillərin antiseptiklər və tibbi alətlərin sterilizasiyası üçün vasitələr kimi istifadəsinə dair nümunələr.
MÖVZU 1.1. ZÜLALLARIN STRUKTUR TƏŞKİLİ. DOĞUMUN TƏLƏBƏLƏMƏ MƏRHƏLƏLƏRİ
ZÜLAL KONFORMASİYALARI
Zülallar monomerləri yalnız 20 α-amin turşusu olan polimer molekullardır. Zülaldakı amin turşularının dəsti və birləşmə qaydası fərdlərin DNT-sindəki genlərin quruluşu ilə müəyyən edilir. Hər bir zülal, özünəməxsus quruluşuna uyğun olaraq, öz funksiyasını yerinə yetirir. Müəyyən bir orqanizmin zülal dəsti onun fenotipik xüsusiyyətlərini, həmçinin irsi xəstəliklərin mövcudluğunu və ya onların inkişafına meylini müəyyənləşdirir.
1. Zülalları təşkil edən amin turşuları. Peptid bağı. Zülallar monomerlərdən - 20 α-amin turşularından əmələ gələn polimerlərdir, ümumi formula hansı
Amin turşuları α-karbon atomuna birləşən radikalların quruluşuna, ölçüsünə və fiziki-kimyəvi xüsusiyyətlərinə görə fərqlənir. Amin turşularının funksional qrupları müxtəlif α-amin turşularının xassələrinin xüsusiyyətlərini müəyyən edir. α-amin turşularında olan radikalları bir neçə qrupa bölmək olar:
Prolin, Digər 19 protein monomerindən fərqli olaraq, o, amin turşusu deyil, iminoturşudur; prolindəki radikal həm α-karbon atomu, həm də imino qrupu ilə əlaqələndirilir.
 Amin turşuları suda həll olma qabiliyyətinə görə dəyişir. Bu, radikalların su (hidrat) ilə qarşılıqlı təsir qabiliyyəti ilə bağlıdır.
Amin turşuları suda həll olma qabiliyyətinə görə dəyişir. Bu, radikalların su (hidrat) ilə qarşılıqlı təsir qabiliyyəti ilə bağlıdır.
TO hidrofilik tərkibində anion, kation və qütb yüksüz funksional qruplar olan radikallar daxildir.
TO hidrofobik tərkibində metil qrupları, alifatik zəncirlər və ya halqalar olan radikallar daxildir.
2. Peptid bağları amin turşularını birləşdirərək peptidlər əmələ gətirir. Peptid sintezi zamanı bir amin turşusunun α-karboksil qrupu digər amin turşusunun α-amin qrupu ilə qarşılıqlı əlaqədə olur. peptid bağı:
Proteinlər polipeptidlərdir, yəni. peptid bağı ilə bağlanmış α-amin turşularının xətti polimerləri (Şəkil 1.1.)
 düyü. 1.1. Peptidlərin quruluşunu təsvir etmək üçün istifadə olunan terminlər
düyü. 1.1. Peptidlərin quruluşunu təsvir etmək üçün istifadə olunan terminlər
Polipeptidləri təşkil edən amin turşularının monomerləri adlanır amin turşusu qalıqları. Təkrarlanan qruplar zənciri - NH-CH-CO- formalar peptid onurğa sütunu. Sərbəst α-aminqrupu olan amin turşusu qalığına N-terminal, sərbəst α-karboksil qrupuna malik olana isə C-terminal deyilir. Peptidlər N-terminusdan C-terminusuna qədər yazılır və oxunur.
Prolinin imino qrupunun yaratdığı peptid bağı digər peptid bağlarından fərqlənir: peptid qrupunun azot atomunda hidrogen,
əvəzinə, bir radikal ilə bir əlaqə var, bunun nəticəsində halqanın bir tərəfi peptid onurğasına daxildir:
 Peptidlər amin turşularının tərkibinə, amin turşularının sayına və amin turşularının birləşmə qaydasına görə fərqlənir, məsələn, Ser-Ala-Glu-Gis və His-Glu-Ala-Ser iki fərqli peptiddir.
Peptidlər amin turşularının tərkibinə, amin turşularının sayına və amin turşularının birləşmə qaydasına görə fərqlənir, məsələn, Ser-Ala-Glu-Gis və His-Glu-Ala-Ser iki fərqli peptiddir.
Peptid bağları çox güclüdür və onların kimyəvi qeyri-enzimatik hidrolizi sərt şərtlər tələb edir: analiz edilən zülal 24 saat ərzində təxminən 110° temperaturda konsentratlaşdırılmış xlorid turşusunda hidroliz edilir. Canlı hüceyrədə peptid bağları pozula bilər proteolitik fermentlər,çağırdı proteazlar və ya peptid hidrolazlar.
3. Zülalların ilkin quruluşu. Müxtəlif zülalların peptid zəncirlərindəki amin turşusu qalıqları təsadüfi bir-birini əvəz etmir, müəyyən ardıcıllıqla düzülür. Polipeptid zəncirindəki amin turşusu qalıqlarının xətti ardıcıllığı və ya növbə sırası adlanır. zülalın ilkin quruluşu.
Hər bir fərdi zülalın ilkin strukturu DNT molekulunda (gen adlanan bölgədə) kodlanır və transkripsiya (mRNT-yə məlumatın kopyalanması) və tərcümə (zülalın ilkin strukturunun sintezi) zamanı həyata keçirilir. Nəticə etibarilə, fərdi şəxsin zülallarının ilkin strukturu, mövcud zülalların funksiyasının asılı olduğu müəyyən bir orqanizmin zülallarının struktur xüsusiyyətlərini təyin edən valideynlərdən uşaqlara irsi ötürülən məlumatdır (Şəkil 1.2.).
 düyü. 1.2. Fərdi orqanizmdə sintez olunan zülalların genotipi ilə uyğunluğu arasında əlaqə
düyü. 1.2. Fərdi orqanizmdə sintez olunan zülalların genotipi ilə uyğunluğu arasında əlaqə
İnsan bədənində təxminən 100.000 fərdi zülalın hər birində var unikal ilkin quruluş. Eyni tip zülalın molekulları (məsələn, albumin) albumini hər hansı digər fərdi zülaldan fərqləndirən amin turşusu qalıqlarının eyni növbələşməsinə malikdir.
Peptid zəncirində amin turşusu qalıqlarının ardıcıllığı məlumatın qeyd forması hesab edilə bilər. Bu məlumat xətti peptid zəncirinin fəza düzülüşü adlanan daha yığcam üçölçülü struktura çevrilməsini müəyyən edir. uyğunlaşma dələ. Funksional aktiv zülal konformasiyasının əmələ gəlməsi prosesi deyilir qatlama
4. Zülal konformasiyası. Peptid onurğasında sərbəst fırlanma peptid qrupunun azot atomu ilə qonşu α-karbon atomu arasında, həmçinin α-karbon atomu ilə karbonil qrupunun karbonu arasında mümkündür. Amin turşusu qalıqlarının funksional qruplarının qarşılıqlı təsiri nəticəsində zülalların ilkin strukturu daha mürəkkəb məkan strukturları əldə edə bilir. Qlobulyar zülallarda peptid zəncirlərinin konformasiyasının iki əsas qatlanma səviyyəsi var: ikinci dərəcəli Və üçüncü struktur.
İkinci dərəcəli quruluş zülallar peptid onurğasının -C=O və -NH- funksional qrupları arasında hidrogen bağlarının yaranması nəticəsində əmələ gələn fəza quruluşudur. Bu vəziyyətdə peptid zənciri iki növ müntəzəm quruluş əldə edə bilər: α-spirallar Və β-strukturlar.
IN α-spirallar karbonil qrupunun oksigen atomu ilə ondan 4-cü amin turşusunun amid azotunun hidrogeni arasında hidrogen bağları əmələ gəlir; amin turşusu qalıqlarının yan zəncirləri
ikincil strukturun formalaşmasında iştirak etmədən spiralın periferiyası boyunca yerləşirlər (şək. 1.3.).
Kütləvi radikallar və ya bərabər yüklü radikallar α-spiralın əmələ gəlməsinin qarşısını alır. Halqa quruluşuna malik olan prolin qalığı α-heliksi kəsir, çünki peptid zəncirindəki azot atomunda hidrogen olmaması səbəbindən hidrogen bağı yaratmaq mümkün deyil. Azot və α-karbon atomu arasındakı əlaqə prolin halqasının bir hissəsidir, buna görə də peptid onurğası bu nöqtədə əyilir.
β-struktur bir polipeptid zəncirinin peptid onurğasının xətti bölgələri arasında əmələ gəlir və bununla da bükülmüş strukturlar əmələ gətirir. Polipeptid zəncirləri və ya onların hissələri əmələ gələ bilər paralel və ya antiparalel β-strukturlar. Birinci halda, qarşılıqlı peptid zəncirlərinin N- və C-terminalları üst-üstə düşür, ikincidə isə əks istiqamətə malikdirlər (şəkil 1.4).
düyü. 1.3. Zülalın ikincil quruluşu - α-heliks
 düyü. 1.4. Paralel və antiparalel β təbəqə strukturları
düyü. 1.4. Paralel və antiparalel β təbəqə strukturları
β-strukturlar geniş oxlarla göstərilir: A - Antiparalel β-struktur. B - Paralel β-vərəq strukturları
Bəzi zülallarda müxtəlif polipeptid zəncirlərinin peptid onurğasının atomları arasında hidrogen bağlarının əmələ gəlməsi hesabına β-strukturlar əmələ gələ bilər.
Zülallarda da olur nizamsız ikincili sahələr polipeptid onurğasının əyilmələri, ilmələri və dönüşlərini ehtiva edən quruluş. Onlar tez-tez peptid zəncirinin istiqamətinin dəyişdiyi yerlərdə, məsələn, paralel β-vərəq strukturu yarandıqda yerləşirlər.
α-spiralların və β-strukturların mövcudluğuna əsasən, qlobulyar zülalları dörd kateqoriyaya bölmək olar.
düyü. 1.5. Mioqlobinin (A) və hemoglobinin β-zəncirinin (B) ikincili quruluşu, səkkiz α-sarmaldan ibarətdir
 düyü. 1.6. Triosefosfat izomeraza və piruvat kinaz domeninin ikincil quruluşu
düyü. 1.6. Triosefosfat izomeraza və piruvat kinaz domeninin ikincil quruluşu
 düyü. 1.7. İmmunoqlobulinin (A) və superoksid dismutaz fermentinin (B) daimi sahəsinin ikincili quruluşu
düyü. 1.7. İmmunoqlobulinin (A) və superoksid dismutaz fermentinin (B) daimi sahəsinin ikincili quruluşu
IN dördüncü kateqoriya az miqdarda müntəzəm ikincil strukturları ehtiva edən zülallar daxildir. Bu zülallara kiçik sisteinlə zəngin zülallar və ya metalloproteinlər daxildir.
Proteinin üçüncü quruluşu- peptid zəncirində bir-birindən xeyli məsafədə yerləşə bilən amin turşusu radikalları arasında qarşılıqlı təsir nəticəsində əmələ gələn konformasiya növü. Əksər zülallar qlobula (qlobulyar zülallar) bənzəyən məkan strukturu əmələ gətirir.
Hidrofob amin turşusu radikalları sözdə vasitəsilə birləşməyə meyllidir hidrofobik qarşılıqlı təsirlər və molekullararası van der Waals qüvvələrinin təsiri altında zülal kürəsinin içərisində sıx hidrofobik nüvə əmələ gəlir. Hidrofilik ionlaşmış və qeyri-ionlaşmış radikallar əsasən zülalın səthində yerləşərək onun suda həllolma qabiliyyətini təyin edirlər.
 düyü. 1.8. Zülalın üçüncü quruluşunun formalaşması zamanı amin turşusu radikalları arasında yaranan bağların növləri
düyü. 1.8. Zülalın üçüncü quruluşunun formalaşması zamanı amin turşusu radikalları arasında yaranan bağların növləri
1 - ion bağı- müsbət və mənfi yüklü funksional qruplar arasında baş verir;
2 - hidrogen bağı- hidrofilik yüksüz qrupla hər hansı digər hidrofilik qrup arasında baş verir;
3 - hidrofobik qarşılıqlı təsirlər- hidrofobik radikallar arasında yaranır;
4 - disulfid bağı- sistein qalıqlarının SH qruplarının oksidləşməsi və onların bir-biri ilə qarşılıqlı təsiri nəticəsində əmələ gəlir.
Hidrofob nüvənin içərisində yerləşən hidrofilik amin turşusu qalıqları istifadə edərək bir-biri ilə qarşılıqlı əlaqədə ola bilər ion Və hidrogen bağları(Şəkil 1.8).
İon və hidrogen rabitələri, həmçinin hidrofobik qarşılıqlı təsirlər zəifdir: onların enerjisi otaq temperaturunda molekulların istilik hərəkətinin enerjisindən çox da yüksək deyil. Zülalın konformasiyası bir çox belə zəif bağların əmələ gəlməsi ilə qorunur. Zülalı təşkil edən atomlar daimi hərəkətdə olduqları üçün bəzi zəif bağları qırıb digərlərini əmələ gətirmək mümkündür ki, bu da polipeptid zəncirinin ayrı-ayrı hissələrinin cüzi hərəkətlərinə səbəb olur. Zülalların bu xüsusiyyətinə bəzilərinin qırılması və digər zəif bağların əmələ gəlməsi nəticəsində konformasiya dəyişməsi deyilir konformasiya labilliyi.
İnsan bədənində dəstəkləyən sistemlər var homeostaz- sağlam orqanizm üçün müəyyən məqbul hədlərdə daxili mühitin sabitliyi. Homeostaz şəraitində konformasiyadakı kiçik dəyişikliklər zülalların ümumi quruluşunu və funksiyasını pozmur. Zülalın funksional aktiv konformasiyası deyilir doğma uyğunlaşma. Daxili mühitin dəyişməsi (məsələn, qlükoza, Ca ionlarının, protonların və s. konsentrasiyası) konformasiyanın dəyişməsinə və zülal funksiyalarının pozulmasına səbəb olur.
Bəzi zülalların üçüncü strukturu sabitləşir disulfid bağları, iki qalığın -SH qruplarının qarşılıqlı təsiri nəticəsində əmələ gəlir
 düyü. 1.9. Zülal molekulunda disulfid bağının əmələ gəlməsi
düyü. 1.9. Zülal molekulunda disulfid bağının əmələ gəlməsi
sistein (Şəkil 1.9). Əksər hüceyrədaxili zülalların üçüncü strukturunda kovalent disulfid bağları yoxdur. Onların mövcudluğu hüceyrə tərəfindən ifraz olunan zülallar üçün xarakterikdir ki, bu da onların hüceyrədənkənar şəraitdə daha sabitliyini təmin edir. Beləliklə, insulin və immunoqlobulinlərin molekullarında disulfid bağları mövcuddur.
insulin- mədəaltı vəzinin β-hüceyrələrində sintez olunan və qanda qlükoza konsentrasiyasının artmasına cavab olaraq qana ifraz olunan zülal hormonu. İnsulinin strukturunda A və B polipeptid zəncirlərini birləşdirən iki disulfid rabitəsi və A zəncirində bir disulfid rabitəsi mövcuddur (şək. 1.10).
 düyü. 1.10. İnsulinin strukturunda disulfid bağları
düyü. 1.10. İnsulinin strukturunda disulfid bağları
5. Zülalların superikinci quruluşu. Müxtəlif əsas quruluş və funksiyaları olan zülallarda bəzən aşkar edilir oxşar birləşmələr və ikinci dərəcəli strukturların nisbi mövqeləri, bunlara superikinci struktur deyilir. Zülalın üçüncü strukturunun formalaşmasında ikincili strukturun elementlərinin spesifik birləşməsi olduğundan, ikinci və üçüncü strukturlar arasında aralıq mövqe tutur. Superikinci strukturların xüsusi adları var, məsələn, “α-heliks-dönüş-a-heliks”, “leysin fermuarı”, “sink barmaqları” və s. Bu cür superikinci strukturlar DNT-ni bağlayan zülallar üçün xarakterikdir.
"Lösin fermuarı." Bu tip supersekonder quruluş iki zülalı birləşdirmək üçün istifadə olunur. Qarşılıqlı təsir göstərən zülalların səthində ən azı dörd lösin qalığı olan α-spiral bölgələr var. α-heliksdəki lösin qalıqları altı amin turşusu məsafəsində yerləşir. α-spiralın hər döngəsində 3,6 amin turşusu qalığı olduğundan, hər ikinci döngənin səthində lösin radikalları yerləşir. Bir zülalın α-spiralının leysin qalıqları digər zülalın leysin qalıqları ilə (hidrofobik qarşılıqlı təsirlər) qarşılıqlı əlaqə yarada bilər, onları bir-birinə bağlaya bilər (Şəkil 1.11.). Bir çox DNT-ni bağlayan zülallar oliqomerik komplekslərdə fəaliyyət göstərir, burada ayrı-ayrı alt bölmələr bir-biri ilə “leysin fermuarları” ilə bağlanır.
 düyü. 1.11. İki zülalın α-spiral bölgələri arasında "leysin fermuarı"
düyü. 1.11. İki zülalın α-spiral bölgələri arasında "leysin fermuarı"
Belə zülallara misal olaraq histonları göstərmək olar. Histonlar- nüvə zülalları, o cümlədən çoxlu sayda müsbət yüklü amin turşuları - arginin və lizin (80% -ə qədər). Histon molekulları, bu molekulların əhəmiyyətli omonim yükünə baxmayaraq, "lösin fermuarlarından" istifadə edərək səkkiz monomerdən ibarət oliqomerik komplekslərə birləşdirilir.
"Sink barmağı"- DNT-ni bağlayan zülallar üçün xarakterik olan supersekondar strukturun variantı, zülalın səthində uzanmış fraqment formasına malikdir və 20-yə yaxın amin turşusu qalıqlarını ehtiva edir (şək. 1.12). "Uzanmış barmaq" forması dörd amin turşusu radikalına - iki sistein qalığı və iki histidin qalığına bağlı bir sink atomu tərəfindən dəstəklənir. Bəzi hallarda histidin qalıqları əvəzinə sistein qalıqları olur. Bir-birinə yaxın olan iki sistein qalığı digər iki Gisili qalığından təxminən 12 amin turşusu qalığından ibarət Cys ardıcıllığı ilə ayrılır. Zülalın bu bölgəsi α-sarmal əmələ gətirir, onun radikalları xüsusi olaraq DNT-nin əsas yivinin tənzimləyici bölgələrinə bağlana bilir. Fərdi bağlama spesifikliyi
 düyü. 1.12. "Sink barmağı" quruluşunu meydana gətirən DNT-ni bağlayan zülallar bölgəsinin ilkin quruluşu (hərflər bu quruluşu təşkil edən amin turşularını göstərir)
düyü. 1.12. "Sink barmağı" quruluşunu meydana gətirən DNT-ni bağlayan zülallar bölgəsinin ilkin quruluşu (hərflər bu quruluşu təşkil edən amin turşularını göstərir)
Tənzimləyici DNT bağlayıcı zülal sink barmağı bölgəsində yerləşən amin turşusu qalıqlarının ardıcıllığından asılıdır. Belə strukturlar, xüsusən də transkripsiyanın tənzimlənməsində (DNT-dən RNT-yə məlumatın oxunması) iştirak edən steroid hormonların reseptorlarını ehtiva edir.
MÖVZU 1.2. ZÜLAL FƏALİYYƏTİNİN ƏSASLARI. ZÜLAL FONKSİYASINA TƏSİR EDƏN LİQANDLAR KİMİ DƏRMANLAR
1. Zülalın aktiv mərkəzi və onun liqandla qarşılıqlı əlaqəsi.Üçüncü strukturun formalaşması zamanı funksional aktiv zülalın səthində, adətən, ilkin quruluşda bir-birindən uzaq olan aminturşu radikallarının əmələ gətirdiyi girintidə bir bölgə əmələ gəlir. Müəyyən bir zülal üçün unikal quruluşa malik olan və xüsusi molekul və ya oxşar molekullar qrupu ilə qarşılıqlı əlaqə qura bilən bu bölgə zülal-liqand bağlama yeri və ya aktiv sahə adlanır. Liqandlar zülallarla qarşılıqlı əlaqədə olan molekullardır.
Yüksək spesifiklik Zülalın liqandla qarşılıqlı əlaqəsi aktiv mərkəzin strukturunun liqandın strukturunu tamamlaması ilə təmin edilir.
Tamamlayıcılıq- bu, qarşılıqlı təsir edən səthlərin məkan və kimyəvi uyğunluğudur. Aktiv mərkəz təkcə ona daxil olan liqandla fəza uyğunlaşmamalı, həm də aktiv mərkəzə daxil olan radikalların funksional qrupları ilə liqandı saxlayan liqand arasında bağlar (ion, hidrogen və hidrofobik qarşılıqlı təsirlər) yaranmalıdır. aktiv mərkəzdə (Şəkil 1.13 ).
 düyü. 1.13. Zülalın liqandla tamamlayıcı qarşılıqlı təsiri
düyü. 1.13. Zülalın liqandla tamamlayıcı qarşılıqlı təsiri
Bəzi liqandlar zülalın aktiv mərkəzinə bağlandıqda zülalların fəaliyyətində köməkçi rol oynayırlar. Belə liqandlara kofaktorlar, tərkibində zülal olmayan hissəsi olan zülallara isə deyilir mürəkkəb zülallar(yalnız zülal hissəsindən ibarət sadə zülallardan fərqli olaraq). Zülalla möhkəm bağlı olan qeyri-zülal hissəsi deyilir protez qrupu. Məsələn, miyoqlobin, hemoglobin və sitoxromlar aktiv mərkəzə möhkəm bağlanmış bir dəmir ionunu ehtiva edən protez qrupu, hemi ehtiva edir. Tərkibində hem olan kompleks zülallara hemoproteinlər deyilir.
Zülallara spesifik liqandlar bağlandıqda bu zülalların funksiyası özünü göstərir. Belə ki, qan plazmasının ən mühüm zülalı olan albumin, hidrofobik liqandları aktiv mərkəzə birləşdirərək nəqliyyat funksiyasını nümayiş etdirir. yağ turşusu, bilirubin, bəzi dərmanlar və s. (Şəkil 1.14)
Peptid zəncirinin üçölçülü quruluşu ilə qarşılıqlı əlaqədə olan ligandlar yalnız aşağı molekulyar üzvi və qeyri-üzvi molekullar deyil, həm də makromolekullar ola bilər:
DNT (yuxarıda müzakirə edilən DNT bağlayan zülallarla nümunələr);
polisaxaridlər;
 düyü. 1.14. Genotip və fenotip arasındakı əlaqə
düyü. 1.14. Genotip və fenotip arasındakı əlaqə
İnsan zülallarının DNT molekulunda kodlanmış unikal ilkin quruluşu hüceyrələrdə unikal konformasiya, aktiv mərkəz quruluşu və zülal funksiyaları şəklində həyata keçirilir.
Bu hallarda, zülal bağlanma yerinə mütənasib və tamamlayıcı olan ligandın xüsusi bölgəsini tanıyır. Beləliklə, hepatositlərin səthində insulin hormonu üçün reseptor zülalları var ki, onlar da zülal quruluşuna malikdir. İnsulinin reseptorla qarşılıqlı təsiri onun konformasiyasının dəyişməsinə və siqnal sistemlərinin aktivləşməsinə səbəb olur, yeməkdən sonra hepatositlərdə qida maddələrinin saxlanmasına gətirib çıxarır.
Beləliklə, Zülalların fəaliyyəti zülalın aktiv mərkəzinin liqandla xüsusi qarşılıqlı əlaqəsinə əsaslanır.
2. Domen strukturu və onun zülalların fəaliyyətində rolu. Qlobular zülalların uzun polipeptid zəncirləri tez-tez bir neçə kompakt, nisbətən müstəqil bölgələrə qatlanır. Onlar globulyar zülalları xatırladan müstəqil üçüncü quruluşa malikdirlər və adlanırlar domenlər. Zülalların domen quruluşu sayəsində onların üçüncü quruluşunu yaratmaq daha asandır.
Domen zülallarında liqand bağlayan yerlər çox vaxt domenlər arasında yerləşir. Beləliklə, tripsin mədəaltı vəzinin ekzokrin hissəsi tərəfindən istehsal olunan və qida zülallarının həzm edilməsi üçün zəruri olan bir proteolitik fermentdir. O, iki domenli quruluşa malikdir və tripsinin öz liqandı - qida zülalı ilə bağlanma mərkəzi iki domen arasındakı yivdə yerləşir. Aktiv mərkəzdə qida zülalının müəyyən bir sahəsinin effektiv bağlanması və onun peptid bağlarının hidrolizi üçün lazım olan şərait yaradılır.
Aktiv mərkəz liqandla qarşılıqlı əlaqədə olduqda zülalda müxtəlif domenlər bir-birinə nisbətən hərəkət edə bilər (şək. 1.15).
Heksokinaza- ATP istifadə edərək qlükozanın fosforlaşmasını kataliz edən ferment. Fermentin aktiv yeri iki domen arasındakı yarıqda yerləşir. Heksokinaza qlükoza ilə bağlandıqda, onu əhatə edən domenlər bağlanır və substrat tələyə düşür, burada fosforlaşma baş verir (bax. Şəkil 1.15).
 düyü. 1.15. Heksokinaza domenlərinin qlükozaya bağlanması
düyü. 1.15. Heksokinaza domenlərinin qlükozaya bağlanması
Bəzi zülallarda domenlər müxtəlif liqandlara bağlanaraq müstəqil funksiyalar yerinə yetirirlər. Belə zülallara çoxfunksiyalı deyilir.
3. Dərmanlar zülalların funksiyasına təsir edən liqandlardır. Zülalların liqandlarla qarşılıqlı təsiri spesifikdir. Bununla belə, zülalın və onun aktiv mərkəzinin konformasiya labilliyinə görə, aktiv mərkəzdə və ya molekulun digər hissəsindəki zülalla da qarşılıqlı təsir göstərə bilən başqa bir maddə seçmək mümkündür.
Quruluşuna görə təbii liqandla oxşar maddə deyilir liqandın struktur analoqu və ya qeyri-təbii liqand. O, həmçinin aktiv yerdəki zülalla qarşılıqlı əlaqədə olur. Bir liqandın struktur analoqu həm protein funksiyasını gücləndirə bilər (aqonist), və azaldın (antaqonist). Liqand və onun struktur analoqları eyni yerdə zülala bağlanmaq üçün bir-biri ilə rəqabət aparır. Belə maddələr deyilir rəqabətli modulyatorlar protein funksiyalarının (tənzimləyiciləri). Çox dərmanlar protein inhibitorları kimi çıxış edir. Onların bəziləri təbii liqandların kimyəvi modifikasiyası yolu ilə əldə edilir. Protein funksiyalarının inhibitorları dərmanlar və zəhərlər ola bilər.
Atropin M-xolinergik reseptorların rəqabətli inhibitorudur. Asetilkolin xolinergik sinapslar vasitəsilə sinir impulslarının ötürülməsi üçün bir nörotransmitterdir. Həyəcanlandırmanı həyata keçirmək üçün sinaptik yarığa salınan asetilkolin postsinaptik membranın reseptor zülalı ilə qarşılıqlı əlaqədə olmalıdır. İki növ tapıldı xolinergik reseptorlar:
M reseptoru asetilkolinlə yanaşı, muskarinlə (milçək agarik toksini) seçici şəkildə qarşılıqlı təsir göstərir. M - xolinergik reseptorlar hamar əzələlərdə mövcuddur və asetilkolinlə qarşılıqlı əlaqədə olduqda onların daralmasına səbəb olur;
H reseptoru Xüsusilə nikotinə bağlanır. N-xolinergik reseptorlar zolaqlı sinapslarda olur skelet əzələləri.
Xüsusi inhibitor M-xolinergik reseptorlar atropindir. Belladonna və henbane bitkilərində olur.
 Atropin strukturunda asetilkolin və onların məkan düzülüşü ilə oxşar funksional qruplara malikdir, buna görə də M-xolinergik reseptorların rəqabətli inhibitorudur. Asetilkolinin M-xolinergik reseptorlara bağlanmasının hamar əzələlərin daralmasına səbəb olduğunu nəzərə alaraq, atropin onların spazmını aradan qaldıran dərman kimi istifadə olunur. (antispazmodik). Beləliklə, göz dibinə baxarkən göz əzələlərini rahatlaşdırmaq, həmçinin mədə-bağırsaq kolikası zamanı spazmları aradan qaldırmaq üçün atropindən istifadə edildiyi məlumdur. M-xolinergik reseptorlar da mərkəzdə mövcuddur sinir sistemi(CNS), buna görə də böyük dozada atropin mərkəzi sinir sistemindən arzuolunmaz reaksiyaya səbəb ola bilər: motor və zehni həyəcan, halüsinasiyalar, konvulsiyalar.
Atropin strukturunda asetilkolin və onların məkan düzülüşü ilə oxşar funksional qruplara malikdir, buna görə də M-xolinergik reseptorların rəqabətli inhibitorudur. Asetilkolinin M-xolinergik reseptorlara bağlanmasının hamar əzələlərin daralmasına səbəb olduğunu nəzərə alaraq, atropin onların spazmını aradan qaldıran dərman kimi istifadə olunur. (antispazmodik). Beləliklə, göz dibinə baxarkən göz əzələlərini rahatlaşdırmaq, həmçinin mədə-bağırsaq kolikası zamanı spazmları aradan qaldırmaq üçün atropindən istifadə edildiyi məlumdur. M-xolinergik reseptorlar da mərkəzdə mövcuddur sinir sistemi(CNS), buna görə də böyük dozada atropin mərkəzi sinir sistemindən arzuolunmaz reaksiyaya səbəb ola bilər: motor və zehni həyəcan, halüsinasiyalar, konvulsiyalar.
Ditilin, sinir-əzələ sinapslarının funksiyasını maneə törədən H-xolinergik reseptorların rəqabət qabiliyyətli agonistidir.
 Skelet əzələlərinin sinir-əzələ sinapslarında H-xolinergik reseptorlar var. Onların asetilkolinlə qarşılıqlı təsiri əzələ daralmasına səbəb olur. Bəzi cərrahi əməliyyatlar zamanı, eləcə də endoskopik tədqiqatlarda skelet əzələlərinin rahatlamasına səbəb olan dərmanlar istifadə olunur. (əzələ gevşetici). Bunlara asetilkolinin struktur analoqu olan ditilin daxildir. H-xolinergik reseptorlara bağlanır, lakin asetilkolindən fərqli olaraq, asetilkolinesteraza fermenti tərəfindən çox yavaş məhv edilir. İon kanallarının uzun müddət açılması və membranın davamlı depolarizasiyası nəticəsində sinir impulslarının keçirilməsi pozulur və əzələlərin rahatlaması baş verir. Əvvəlcə bu xüsusiyyətlər kurare zəhərində aşkar edildi, buna görə də belə dərmanlar deyilir kürəyə bənzəyir.
Skelet əzələlərinin sinir-əzələ sinapslarında H-xolinergik reseptorlar var. Onların asetilkolinlə qarşılıqlı təsiri əzələ daralmasına səbəb olur. Bəzi cərrahi əməliyyatlar zamanı, eləcə də endoskopik tədqiqatlarda skelet əzələlərinin rahatlamasına səbəb olan dərmanlar istifadə olunur. (əzələ gevşetici). Bunlara asetilkolinin struktur analoqu olan ditilin daxildir. H-xolinergik reseptorlara bağlanır, lakin asetilkolindən fərqli olaraq, asetilkolinesteraza fermenti tərəfindən çox yavaş məhv edilir. İon kanallarının uzun müddət açılması və membranın davamlı depolarizasiyası nəticəsində sinir impulslarının keçirilməsi pozulur və əzələlərin rahatlaması baş verir. Əvvəlcə bu xüsusiyyətlər kurare zəhərində aşkar edildi, buna görə də belə dərmanlar deyilir kürəyə bənzəyir.
MÖVZU 1.3. ZÜLALLARIN DENATURASİYASI VƏ ONLARIN KÖTÜ RENATİVASİYA MÜMKÜNÜ
1. Zəif qarşılıqlı təsirlər, zülalları əhatə edən mühitin tərkibində və xassələrindəki dəyişikliklər, təsir nəticəsində zülalların yerli konformasiyası qorunur. kimyəvi reagentlər fiziki amillər isə onların konformasiyasının dəyişməsinə səbəb olur (konformasiya labilliyi xassəsi). Çoxlu sayda bağların qırılması zülalların yerli konformasiyasının pozulmasına və denatürasiyasına gətirib çıxarır.
Zülalların denatürasiyası- bu, zülalın məkan quruluşunu sabitləşdirən zəif bağların qırılması nəticəsində yaranan denatürasiyaedici maddələrin təsiri altında onların doğma konformasiyasının məhv edilməsidir. Denaturasiya zülalın unikal üçölçülü strukturunun və aktiv mərkəzinin məhv edilməsi və onun bioloji fəaliyyətinin itirilməsi ilə müşayiət olunur (Şəkil 1.16).
Bir zülalın bütün denatürasiya olunmuş molekulları eyni zülalın digər molekullarından fərqlənən təsadüfi bir konformasiya əldə edir. Aktiv mərkəzi meydana gətirən amin turşusu radikalları məkan baxımından bir-birindən uzaqlaşır, yəni. zülalın liqandla xüsusi bağlanma yeri məhv edilir. Denatürasiya zamanı zülalların ilkin strukturu dəyişməz qalır.
Bioloji tədqiqatlarda və təbabətdə denaturasiya edən maddələrin tətbiqi. Biyokimyəvi tədqiqatlarda, bioloji materialda aşağı molekulyar ağırlıqlı birləşmələri təyin etməzdən əvvəl, zülallar ilk növbədə məhluldan çıxarılır. Trichloroacetic acid (TCA) ən çox bu məqsədlə istifadə olunur. Məhlula TCA əlavə edildikdən sonra denaturasiya olunmuş zülallar çökür və filtrasiya yolu ilə asanlıqla çıxarılır (Cədvəl 1.1.)
Tibbdə denaturasiyaedici maddələr tez-tez avtoklavlarda tibbi alətlərin və materialların sterilizasiyası üçün (denatürləşdirici maddə yüksək temperaturdur) və patogen mikrofloranı ehtiva edən çirklənmiş səthlərin müalicəsi üçün antiseptik (spirt, fenol, xloramin) kimi istifadə olunur.
2. Spontan zülalın yenidən aktivləşməsi- zülalların ilkin quruluşunun, konformasiyasının və funksiyasının determinizminin sübutu. Fərdi zülallar eyni amin turşusu ardıcıllığına malik olan və hüceyrədə eyni uyğunluğu əldə edən bir genin məhsullarıdır. Zülalın ilkin strukturunda artıq onun konformasiyası və funksiyası haqqında məlumatın olması ilə bağlı fundamental nəticə bəzi zülalların (xüsusən, ribonukleaz və mioqlobinin) kortəbii renativasiya – denaturasiyadan sonra öz doğma konformasiyasını bərpa etmək qabiliyyəti əsasında qəbul edilmişdir.
Məkan zülal strukturlarının formalaşması öz-özünə yığılma üsulu ilə həyata keçirilir - unikal ilkin quruluşa malik polipeptid zəncirinin ən kiçik ilə uyğunluğu qəbul etməyə meylli olduğu kortəbii bir proses. pulsuz enerji. Denatürasiyadan sonra ilkin strukturunu saxlayan zülalları renativasiya etmək qabiliyyəti ribonukleaza fermenti ilə aparılan təcrübədə təsvir edilmişdir.
Ribonukleaza bir RNT molekulunda fərdi nukleotidlər arasındakı bağları parçalayan bir fermentdir. Bu qlobular zülalın üçüncü strukturu bir çox zəif və dörd disulfid bağı ilə sabitləşən bir polipeptid zəncirinə malikdir.
Ribonükleazanın molekulda hidrogen bağlarını qıran karbamid və disulfid bağlarını qıran reduksiyaedici maddə ilə müalicəsi fermentin denatürasiyasına və aktivliyinin itirilməsinə səbəb olur.
Denaturasiya edən maddələrin dializ yolu ilə çıxarılması zülalın konformasiyası və funksiyasının bərpasına gətirib çıxarır, yəni. yenidən doğulmaq. (Şəkil 1.17).
 düyü. 1.17. Ribonükleazanın denaturasiyası və renatasiyası
düyü. 1.17. Ribonükleazanın denaturasiyası və renatasiyası
A - üçüncü strukturunda dörd disulfid bağı olan ribonukleazın yerli konformasiyası; B - denaturasiya olunmuş ribonukleaza molekulu;
B - bərpa edilmiş strukturu və funksiyası ilə yenidən aktivləşdirilmiş ribonukleaza molekulu
1. Cədvəl 1.2-ni doldurun.
Cədvəl 1.2. Amin turşularının radikalların polaritesinə görə təsnifatı
2. Tetrapeptidin düsturunu yazın:
Asp - Pro - Fen - Liz
a) peptiddə peptid onurğasını təşkil edən təkrarlanan qrupları və amin turşusu radikalları ilə təmsil olunan dəyişən qrupları vurğulayın;
b) N- və C-terminallarını etiketləyin;
c) peptid bağlarını vurğulamaq;
d) eyni aminturşulardan ibarət başqa peptid yazın;
d) kəmiyyəti saymaq mümkün variantlar oxşar amin turşusu tərkibinə malik tetrapeptid.
3. Məməlilərin neyrohipofizinin strukturca oxşar və təkamül baxımından yaxın iki peptid hormonunun - oksitosin və vazopressinin müqayisəli təhlili nümunəsindən istifadə edərək zülalların ilkin strukturunun rolunu izah edin (Cədvəl 1.3).
Cədvəl 1.3. Oksitosin və vazopressinin quruluşu və funksiyaları
 Bunun üçün:
Bunun üçün:
a) iki peptidin tərkibini və amin turşusu ardıcıllığını müqayisə edin;
b) iki peptidin ilkin quruluşunun oxşarlığını və bioloji təsirinin oxşarlığını tapın;
c) iki peptidin strukturunda fərqləri və onların funksiyalarında fərqləri tapmaq;
d) peptidlərin ilkin strukturunun onların funksiyalarına təsiri haqqında nəticə çıxarın.
4. Qlobulyar zülalların konformasiyasının əmələ gəlməsinin əsas mərhələlərini (ikinci, üçüncü strukturlar, superikinci struktur anlayışı) təsvir edin. Zülal strukturlarının formalaşmasında iştirak edən bağ növlərini göstərin. Hansı amin turşusu radikalları hidrofobik qarşılıqlı təsirlərin, ion, hidrogen bağlarının formalaşmasında iştirak edə bilər.
Nümunələr verin.
5. “Zülalların konformasiya labilliyi” anlayışını müəyyənləşdirin, onun mövcudluğunun səbəblərini və əhəmiyyətini göstərin.
6. Aşağıdakı ifadənin mənasını genişləndirin: "Zülalların fəaliyyəti onların liqandla xüsusi qarşılıqlı əlaqəsinə əsaslanır" terminlərindən istifadə edərək və onların mənasını izah edin: zülal konformasiyası, aktiv mərkəz, liqand, tamamlayıcılıq, zülal funksiyası.
7. Bir nümunədən istifadə edərək, domenlərin nə olduğunu və zülalların fəaliyyətində rolunun nə olduğunu izah edin.
ÖZÜNÜNƏNİZƏT VƏZİFƏLƏRİ
1. Qarşılaşma.
Amin turşusu radikalının funksional qrupu:
A. Karboksil qrupu B. Hidroksil qrupu C Quanidin qrupu D. Tiol qrupu E. Amin qrupu
2. Düzgün cavabları seçin.
Qütb yüksüz radikalları olan amin turşuları bunlardır:
A. Cis B. Asn
B. Glu G. Üç
3. Düzgün cavabları seçin.
Amin turşusu radikalları:
A. İlkin strukturun spesifikliyini təmin edir B. Üçüncü strukturun formalaşmasında iştirak edir
B. Zülalın səthində yerləşərək onun həll olunmasına təsir göstərirlər D. Aktiv mərkəzi əmələ gətirirlər
D. Peptid bağlarının formalaşmasında iştirak edir
4. Düzgün cavabları seçin.
Amin turşusu radikalları arasında hidrofobik qarşılıqlı təsirlər yarana bilər:
A. Tre Lay B. Pro Üç
B. Met İle G. Tir Ala D. Val Fen
5. Düzgün cavabları seçin.
Amin turşusu radikalları arasında ion bağları yarana bilər:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Gis Asp D. Asn Apr
6. Düzgün cavabları seçin.
Amin turşusu radikalları arasında hidrogen bağları yarana bilər:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Qarşılaşma.
Zülal quruluşunun formalaşmasında iştirak edən bağ növü:
A. İlkin struktur B. İkinci dərəcəli quruluş
B. Üçüncü quruluş
D. İkinci dərəcəli quruluş E. Konformasiya.
1. Peptid onurğasının atomları arasında hidrogen bağları
2. Amin turşusu radikallarının funksional qrupları arasında zəif bağlar
3. Amin turşularının α-amin və α-karboksil qrupları arasında bağlar
8. Düzgün cavabları seçin. Tripsin:
A. Proteolitik ferment B. İki sahə ehtiva edir
B. Nişastanı hidroliz edir
D. Aktiv sayt domenlər arasında yerləşir. D. İki polipeptid zəncirindən ibarətdir.
9. Düzgün cavabları seçin. Atropin:
A. Neyrotransmitter
B. Asetilkolinin struktur analoqu
B. H-xolinergik reseptorlarla qarşılıqlı təsir göstərir
D. Xolinergik sinapslar vasitəsilə sinir impulslarının keçirilməsini gücləndirir
D. M-xolinergik reseptorların rəqabətli inhibitoru
10. Düzgün ifadələri seçin. Zülallarda:
A. İlkin struktur onun aktiv sahəsinin strukturu haqqında məlumatı ehtiva edir
B. Aktiv mərkəz ilkin struktur səviyyəsində formalaşır
B. Konformasiya kovalent bağlarla sərt şəkildə sabitlənir
D. Aktiv sahə oxşar liqandlar qrupu ilə qarşılıqlı əlaqədə ola bilər
zülalların konformasiya labilliyinə görə D. Dəyişiklik mühit, aktivin yaxınlığına təsir göstərə bilər
mərkəzdən ligand
1. 1-B, 2-G, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
ƏSAS ŞƏRTLƏR VƏ KONSEPSİYALAR
1. Zülal, polipeptid, amin turşuları
2. İlkin, ikincili, üçüncü dərəcəli zülal strukturları
3. Konformasiya, yerli zülal konformasiyası
4. Zülalda kovalent və zəif bağlar
5. Konformasiya labilliyi
6. Protein aktiv sahəsi
7. Liqandlar
8. Protein qatlanması
9. Liqandların struktur analoqları
10. Domen zülalları
11. Sadə və mürəkkəb zülallar
12. Zülalın denaturasiyası, denaturasiyaedici maddələr
13. Zülalların yenidən aktivləşməsi
Problemləri həll etmək
“Zülalların struktur təşkili və onların fəaliyyətinin əsasları”
1. Zülalın əsas funksiyası - hemoglobin A (HbA) oksigenin toxumalara daşınmasıdır. İnsan populyasiyasında bu zülalın bir çox formaları dəyişdirilmiş xassələri və funksiyaları ilə tanınır - sözdə anormal hemoglobinlər. Məsələn, oraqvari hüceyrə xəstəliyi (HbS) olan xəstələrin qırmızı qan hüceyrələrində olan hemoglobin S-nin oksigenin aşağı parsial təzyiqi şəraitində (venoz qanda olduğu kimi) aşağı həll qabiliyyəti olduğu aşkar edilmişdir. Bu, bu proteinin aqreqatlarının meydana gəlməsinə səbəb olur. Zülal öz funksiyasını itirir, çökür və qırmızı qan hüceyrələri əldə edir düzensiz forma(onların bəziləri oraq formasını əmələ gətirir) və dalaqda adi haldan daha tez məhv olur. Nəticədə oraqvari hüceyrəli anemiya inkişaf edir.
HbA-nın ilkin strukturunda yeganə fərq hemoglobin β-zəncirinin N-terminal bölgəsində aşkar edilmişdir. β-telin N-terminal bölgələrini müqayisə edin və zülalın ilkin strukturunda dəyişikliklərin onun xassələrinə və funksiyalarına necə təsir etdiyini göstərin.
 Bunun üçün:
Bunun üçün:
a) HbA-nın fərqləndiyi amin turşularının düsturlarını yazın və bu amin turşularının xassələrini (qütblük, yük) müqayisə edin.
b) həllolma qabiliyyətinin azalması və oksigenin toxumalara daşınmasının pozulmasının səbəbi haqqında nəticə çıxarın.
2. Şəkildə liqandla (aktiv mərkəz) bir əlaqə mərkəzi olan zülalın quruluşunun diaqramı göstərilir. Zülalın liqand seçimində niyə seçici olduğunu izah edin. Bunun üçün:
a) zülalın aktiv mərkəzinin nə olduğunu xatırlayın və şəkildə göstərilən zülalın aktiv mərkəzinin strukturunu nəzərdən keçirin;
b) aktiv mərkəzi təşkil edən aminturşu radikallarının düsturlarını yazın;
c) zülalın aktiv yeri ilə xüsusi olaraq qarşılıqlı təsir göstərə bilən liqand çəkin. Onun üzərində aktiv mərkəzi təşkil edən amin turşusu radikalları ilə əlaqə yarada bilən funksional qrupları göstərin;
d) aktiv sahənin liqand və amin turşusu radikalları arasında yaranan rabitə növlərini göstərin;
e) zülal-liqand qarşılıqlı təsirinin spesifikliyinin nəyə əsaslandığını izah edin.
 3.
Şəkildə zülalın aktiv yeri və bir neçə liqand göstərilir.
3.
Şəkildə zülalın aktiv yeri və bir neçə liqand göstərilir.
Hansı liqandın zülalın aktiv yeri ilə qarşılıqlı əlaqədə olma ehtimalını və nə üçün olduğunu müəyyənləşdirin.
 Zülal-liqand kompleksinin əmələ gəlməsi zamanı hansı növ bağlar yaranır?
Zülal-liqand kompleksinin əmələ gəlməsi zamanı hansı növ bağlar yaranır?
4. Təbii protein liqandlarının struktur analoqları zülalların fəaliyyətini dəyişdirmək üçün dərman kimi istifadə edilə bilər.
Asetilkolin sinir-əzələ sinapslarında həyəcan ötürülməsinin vasitəçisidir. Asetilkolin zülallarla - skelet əzələlərinin postsinaptik membranının reseptorları ilə qarşılıqlı əlaqədə olduqda ion kanalları açılır və əzələ daralması baş verir. Ditilin, sinir-əzələ sinapsları vasitəsilə sinir impulslarının ötürülməsini pozduğu üçün əzələləri rahatlaşdırmaq üçün bəzi əməliyyatlarda istifadə olunan bir dərmandır. Ditilinin əzələ gevşetici kimi təsir mexanizmini izah edin. Bunun üçün:
a) asetilkolin və ditilinin düsturlarını yazın və strukturlarını müqayisə edin;
b) ditilinin rahatlaşdırıcı təsir mexanizmini təsvir edin.
5. Bəzi xəstəliklər zamanı xəstənin bədən istiliyi yüksəlir ki, bu da orqanizmin qoruyucu reaksiyası kimi qəbul edilir. Bununla belə, yüksək temperatur bədən zülalları üçün zərərlidir. 40 °C-dən yuxarı temperaturda zülalların funksiyasının niyə pozulduğunu və insan həyatı üçün təhlükə yarandığını izah edin. Bunu etmək üçün unutmayın:
1) Zülalların quruluşu və onun strukturunu yerli konformasiyada saxlayan bağlar;
2) Temperaturun artması ilə zülalların quruluşu və funksiyası necə dəyişir?;
3) Homeostaz nədir və insan sağlamlığının qorunması üçün nə üçün vacibdir.
Modul vahid 2 OLİQOMERİK ZÜLALLAR TƏNZİMLƏNƏN TƏSİRLƏRİN MƏQSƏDİ KİMİ. ZÜLALLARIN STRUKTUR VƏ FUNKSİONAL MÜXTƏLİFLİYİ. ZÜLALLARIN AYRILMASI VƏ TƏMİZLƏNMƏSİ ÜSULLARI
Tədris məqsədləri Bacarmaq:
1. Oliqomer zülalların quruluşunun xüsusiyyətləri və funksiyaları haqqında biliklərdən onların funksiyalarının tənzimlənməsinin adaptiv mexanizmlərini başa düşmək üçün istifadə edin.
2. Hüceyrə şəraitində zülal konformasiyasının sintezində və saxlanmasında şaperonların rolunu izah edin.
3. Orqanizmdə sintez olunan zülalların struktur və funksiyalarının müxtəlifliyi ilə həyatın təzahürlərinin müxtəlifliyini izah edin.
4. Bağlı hemoproteinlərin - mioqlobin və hemoglobinin, eləcə də immunoqlobulinlər ailəsinin beş sinif zülalının nümayəndələrinin müqayisəsi nümunələrindən istifadə edərək zülalların strukturu və onların funksiyası arasındakı əlaqəni təhlil edin.
5. Zülalların fiziki və kimyəvi xassələrinin xüsusiyyətləri haqqında bilikləri onların digər zülallardan və çirklərdən təmizləmə üsullarını seçmək üçün tətbiq etmək.
6. Klinik diaqnozu təsdiqləmək və ya aydınlaşdırmaq üçün qan plazması zülallarının kəmiyyət və keyfiyyət tərkibinin nəticələrini şərh edin.
Bilin:
1. Oliqomer zülalların strukturunun xüsusiyyətləri və hemoglobin nümunəsindən istifadə edərək onların funksiyalarını tənzimləyən adaptiv mexanizmlər.
2. Şaperonların quruluşu və funksiyaları və hüceyrə şəraitində zülalların yerli konformasiyasını saxlamaq üçün əhəmiyyəti.
3. İmmunoqlobulinlər nümunəsindən istifadə etməklə onların konformasiyası və funksiyalarının oxşarlığına əsaslanan zülalların ailələrə birləşmə prinsipləri.
4. Zülalların fiziki-kimyəvi xassələrinin xüsusiyyətlərinə görə ayrılması üsulları.
5. Qan plazmasının elektroforezi zülalların keyfiyyət və kəmiyyət tərkibinin qiymətləndirilməsi üsulu kimi.
MÖVZU 1.4. HEMOQLOBİN NÜMUNƏSİNDƏN İSTİFADƏ EDİLƏN OLİQOMER ZÜLALLARIN STRUKTURU VƏ FƏALİYYƏTİNİN XÜSUSİYYƏTLƏRİ
1. Bir çox protein bir neçə polipeptid zəncirindən ibarətdir. Belə zülallar adlanır oliqomerik, və fərdi zəncirlər - protomerlər. Oliqomerik zülallardakı protomerlər çoxlu zəif qeyri-kovalent bağlarla (hidrofobik, ion, hidrogen) bağlanır. Qarşılıqlı əlaqə
protomerlər sayəsində həyata keçirilir tamamlayıcılıq onların təmas səthləri.
Oliqomerik zülallarda protomerlərin sayı çox fərqli ola bilər: hemoglobində 4 protomer, aspartat aminotransferaza fermentində 12 protomer, tütün mozaika virusu zülalında isə kovalent olmayan bağlarla birləşən 2120 protomer var. Nəticədə, oliqomerik zülallar çox yüksək molekulyar ağırlığa malik ola bilər.
Bir protomerin digərləri ilə qarşılıqlı əlaqəsi zülal-liqand qarşılıqlı təsirinin xüsusi halı hesab edilə bilər, çünki hər bir protomer digər protomerlər üçün liqand rolunu oynayır. Zülalda protomerlərin birləşməsinin sayı və üsulu deyilir dördüncü zülal quruluşu.
Zülalların tərkibində eyni və ya müxtəlif strukturların protomerləri ola bilər, məsələn, homodimerlər iki eyni protomerdən ibarət zülallardır, heterodimerlər isə iki fərqli protomerdən ibarət zülallardır.
Əgər zülalların tərkibində müxtəlif protomerlər varsa, onda onların üzərində quruluşca fərqlənən müxtəlif liqandlara malik bağlama mərkəzləri əmələ gələ bilər. Bir liqand aktiv sahəyə bağlandıqda, bu zülalın funksiyası özünü göstərir. Fərqli bir protomerdə yerləşən mərkəzə allosterik deyilir (aktivdən fərqli). Əlaqə allosterik liqand və ya effektor, tənzimləyici funksiyanı yerinə yetirir (şək. 1.18). Allosterik mərkəzin effektorla qarşılıqlı təsiri onun konformasiya labilliyinə görə bütün oliqomer zülalın strukturunda konformasiya dəyişikliklərinə səbəb olur. Bu, aktiv sahənin müəyyən bir ligand üçün yaxınlığına təsir göstərir və həmin zülalın funksiyasını tənzimləyir. Oliqomerik zülalın ən azı bir liqandla qarşılıqlı təsiri zamanı bütün protomerlərin konformasiyası və funksiyasının dəyişməsi kooperativ konformasiya dəyişiklikləri adlanır. Protein funksiyasını gücləndirən effektlər deyilir aktivatorlar, və onun funksiyasını maneə törədən effektlər - inhibitorları.
Beləliklə, oliqomer zülallar, eləcə də domen strukturuna malik zülallar monomer zülallarla müqayisədə yeni xüsusiyyətə malikdir - funksiyaları allosterik tənzimləmək qabiliyyəti (zülala müxtəlif liqandlar əlavə etməklə tənzimləmə). Bunu iki yaxından əlaqəli kompleks zülalın, miyoqlobin və hemoglobinin struktur və funksiyalarını müqayisə etməklə görmək olar.
 düyü. 1.18. Dimerik zülalın quruluşunun sxemi
düyü. 1.18. Dimerik zülalın quruluşunun sxemi
2. Məkan strukturlarının formalaşması və mioqlobinin fəaliyyəti.
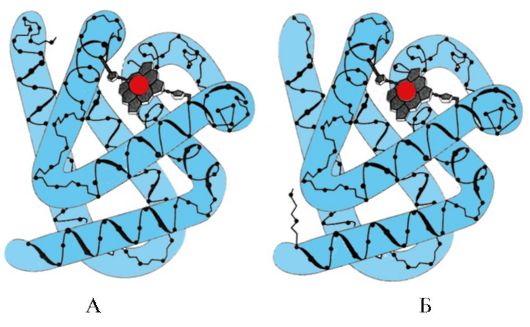
Mioqlobin (Mb) qırmızı əzələlərdə olan bir zülaldır, əsas funksiyası intensiv əzələ işi üçün lazım olan O 2 ehtiyatlarını yaratmaqdır. Mb zülal hissəsi - apoMb və qeyri-zülal hissəsi - hem olan kompleks zülaldır. ApoMB-nin ilkin strukturu onun yığcam qlobulyar konformasiyasını və mioqlobinin qeyri-zülal hissəsi olan hemin bağlandığı aktiv mərkəzin strukturunu müəyyən edir. Qandan əzələlərə gələn oksigen miyoqlobində Fe+2 heme bağlanır. Mb, O 2 üçün çox yüksək yaxınlığa malik olan monomerik bir zülaldır, buna görə də miyoglobin tərəfindən oksigenin sərbəst buraxılması yalnız intensiv əzələ işi zamanı, O 2-nin qismən təzyiqi kəskin şəkildə azaldıqda baş verir.
Mv konformasiyasının formalaşması. Qırmızı əzələlərdə, tərcümə zamanı ribosomlarda, 153 amin turşusu qalıqlarının xüsusi bir ardıcıllığı ilə təmsil olunan MB-nin ilkin quruluşu sintez olunur. Mb-nin ikinci dərəcəli strukturu latın hərfləri ilə A-dan H-yə qədər adlanan səkkiz α-sarmaldan ibarətdir, onların arasında spiral olmayan bölgələr var. Mb-nin üçüncü strukturu yığcam qlobul formasına malikdir, onun girintisində aktiv mərkəz F və E α-sarmalları arasında yerləşir (şək. 1.19).
 düyü. 1.19. Mioqlobinin quruluşu
düyü. 1.19. Mioqlobinin quruluşu
3. MV-nin aktiv mərkəzinin quruluşu və fəaliyyətinin xüsusiyyətləri. Mb-nin aktiv mərkəzi əsasən ilkin strukturda bir-birindən geniş məsafədə yerləşən hidrofobik amin turşusu radikallarından əmələ gəlir (məsələn, Tri 3 9 və Fen 138) Suda zəif həll olunan liqandlar - hem və O 2 - aktiv mərkəzə yapışırlar. Heme apoMB-nin spesifik liqandıdır (şək. 1.20), onun əsasını metenil körpüləri ilə birləşdirilmiş dörd pirol halqası təşkil edir; mərkəzdə dörd koordinasiya bağı ilə pirol halqalarının azot atomlarına bağlı Fe+ 2 atomu var. Mb-nin aktiv mərkəzində hidrofobik amin turşusu radikallarına əlavə olaraq, hidrofilik radikallarla iki amin turşusunun qalıqları da var - Gis E 7(Gis 64) və GIS F 8(Onun 93) (Şəkil 1.21).
 düyü. 1.20. Hemin quruluşu - miyoqlobinin və hemoglobinin zülal olmayan hissəsi
düyü. 1.20. Hemin quruluşu - miyoqlobinin və hemoglobinin zülal olmayan hissəsi
 düyü. 1.21. Apomioqlobin və hemoglobin protomerlərinin aktiv yerində heme və O2-nin yeri
düyü. 1.21. Apomioqlobin və hemoglobin protomerlərinin aktiv yerində heme və O2-nin yeri
Heme bir dəmir atomu vasitəsilə Onun F8 ilə kovalent şəkildə bağlıdır. O 2 heme müstəvisinin digər tərəfində dəmirə yapışır. Onun E 7 O 2-nin düzgün istiqamətləndirilməsi üçün lazımdır və oksigenin Fe + 2 heme əlavə edilməsini asanlaşdırır.
GIS F 8 Fe+2 ilə koordinasiya əlaqəsi yaradır və hemeni aktiv mərkəzdə möhkəm şəkildə sabitləşdirir. Gis E 7 Fe + 2 heme ilə qarşılıqlı əlaqəsi zamanı başqa bir ligandın - O 2-nin aktiv mərkəzində düzgün oriyentasiya üçün zəruridir. Hemin mikromühiti O 2-nin Fe + 2 ilə güclü, lakin geri dönən bağlanması üçün şərait yaradır və suyun hidrofobik aktiv sahəyə daxil olmasının qarşısını alır, bu da onun Fe + 3-ə qədər oksidləşməsinə səbəb ola bilər.
Mb və onun aktiv mərkəzinin monomer quruluşu zülalın O 2 üçün yüksək yaxınlığını müəyyən edir.
4. Hb-nin oliqomer quruluşu və Hb-nin O 2 liqandlarına yaxınlığının tənzimlənməsi. İnsan hemoglobinləri- kompleks zülallarla (hemoproteinlər) əlaqəli miyoqlobin kimi zülallar ailəsi. Onlar tetramer quruluşa malikdir və iki α-zəncirindən ibarətdir, lakin digər iki polipeptid zəncirinin (2α-, 2x-zəncirləri) strukturunda fərqlənirlər. İkinci polipeptid zəncirinin quruluşu Hb-nin bu formalarının işləmə xüsusiyyətlərini müəyyənləşdirir. Yetkin bir insanın qırmızı qan hüceyrələrində olan hemoglobinin təxminən 98% -ni təşkil edir hemoglobin A(2α-, 2p-zəncirləri).
Dölün inkişafı zamanı hemoglobinlərin iki əsas növü fəaliyyət göstərir: embrion Hb(2α, 2ε), dölün inkişafının erkən mərhələlərində rast gəlinir və hemoglobin F (fetal)- (2α, 2γ), intrauterin inkişafın altıncı ayında erkən fetal hemoglobini əvəz edir və yalnız doğuşdan sonra Hb A ilə əvəz olunur.
HB A, yetkin insan qırmızı qan hüceyrələrində olan miyoqlobin (MB) ilə əlaqəli bir proteindir. Onun fərdi protomerlərinin quruluşu miyoqlobinə bənzəyir. Mioqlobin və hemoglobin protomerlərinin ikincili və üçüncü strukturları çox oxşardır, baxmayaraq ki, onların polipeptid zəncirlərinin ilkin strukturunda yalnız 24 amin turşusu qalıqları eynidir (hemoqlobin protomerlərinin ikincili quruluşu, miyoqlobin kimi, səkkiz α-sarmal, A-dan H-ə qədər latın hərfləri ilə təyin olunur və üçüncü quruluş yığcam qlobul formasına malikdir). Lakin miyoqlobindən fərqli olaraq, hemoglobin qeyri-kovalent bağlarla bağlanmış dörd polipeptid zəncirindən ibarət oliqomer quruluşa malikdir (Şəkil 1.22).
Hər bir Hb protomeri zülal olmayan hissə ilə - hem və qonşu protomerlərlə əlaqələndirilir. Hb-nin zülal hissəsinin heme ilə əlaqəsi miyoqlobinə bənzəyir: zülalın aktiv mərkəzində, hemin hidrofobik hissələri His F 8 və Onun E 7 istisna olmaqla, hidrofobik amin turşusu radikalları ilə əhatə olunur, hem müstəvisinin hər iki tərəfində yerləşir və zülalın fəaliyyətində və oksigenlə bağlanmasında oxşar rol oynayır (mioqlobinin quruluşuna bax).
 düyü. 1.22. Hemoqlobinin oliqomerik quruluşu
düyü. 1.22. Hemoqlobinin oliqomerik quruluşu
Bundan başqa, Gis E 7 mühüm icra edir əlavə rol Nv-nin fəaliyyətində. Sərbəst hemin CO-ya O2 ilə müqayisədə 25.000 dəfə yüksək yaxınlığı var. CO bədəndə az miqdarda əmələ gəlir və heme yüksək yaxınlığını nəzərə alaraq, hüceyrə həyatı üçün lazım olan O 2-nin daşınmasını poza bilər. Bununla belə, hemoglobinin tərkibində hemin dəm qazına yaxınlığı, aktiv mərkəzdə Onun E 7 olması səbəbindən O 2-yə yaxınlığı cəmi 200 dəfə üstələyir. Bu amin turşusunun qalan hissəsini meydana gətirir optimal şərait hemanı O 2-yə bağlamaq və hemin CO ilə qarşılıqlı təsirini zəiflədir.
5. HB-nin əsas funksiyası O2-nin ağciyərlərdən toxumalara daşınmasıdır. O2 üçün çox yüksək yaxınlığa malik olan və qırmızı əzələlərdə oksigeni saxlamaq funksiyasını yerinə yetirən monomerik miyoqlobindən fərqli olaraq, hemoglobinin oliqomerik quruluşu aşağıdakıları təmin edir:
1) HB-nin ağciyərlərdə oksigenlə sürətli doyması;
2) HB-nin nisbətən yüksək qismən O 2 təzyiqində (20-40 mm Hg) toxumalarda oksigeni buraxma qabiliyyəti;
3) Hb-nin O 2-yə yaxınlığını tənzimləmək imkanı.
6. Hemoqlobin protomerlərinin konformasiyasında kooperativ dəyişikliklər ağciyərlərdə O 2-nin bağlanmasını və toxumalara salınmasını sürətləndirir. Ağciyərlərdə O 2-nin yüksək qismən təzyiqi onun dörd protomerin (2α və 2β) aktiv yerində Hb ilə bağlanmasına kömək edir. Hər bir protomerin aktiv mərkəzi, miyoqlobində olduğu kimi, hidrofobik cibdə iki α-sarmal (F və E) arasında yerləşir. Tərkibində qeyri-zülal hissəsi var - heme, zülal hissəsinə çoxlu zəif hidrofobik qarşılıqlı təsirlər və Fe 2 + heme və Onun F 8 arasında güclü bir əlaqə ilə bağlanır (bax. Şəkil 1.21).
Dezoksihemoqlobində Onun F 8 ilə bu əlaqəyə görə Fe 2+ atomu hem müstəvisindən histidinə doğru çıxır. O 2-nin Fe 2 + ilə bağlanması tək sərbəst koordinasiya bağından istifadə edərək His E 7 bölgəsindəki hemin digər tərəfində baş verir. Onun E 7 O 2-nin heme dəmirə bağlanması üçün optimal şərait yaradır.
Bir protomerin Fe + 2 atomuna O 2-nin əlavə edilməsi onun hem müstəvisinə, sonra isə onunla əlaqəli histidin qalığının hərəkətinə səbəb olur.
 düyü. 1.23. O 2 ilə birləşdirildikdə hemoglobin protomerinin konformasiyasında dəyişiklik
düyü. 1.23. O 2 ilə birləşdirildikdə hemoglobin protomerinin konformasiyasında dəyişiklik
Bu, bütün polipeptid zəncirlərinin konformasiya labilliyinə görə onların konformasiyasının dəyişməsinə gətirib çıxarır. Digər zəncirlərin konformasiyasının dəyişdirilməsi onların sonrakı O 2 molekulları ilə qarşılıqlı əlaqəsini asanlaşdırır.
Dördüncü O 2 molekulu birincidən 300 dəfə daha asan hemoglobinə bağlanır (şək. 1.24).
 düyü. 1.24. O2 ilə qarşılıqlı əlaqə zamanı hemoglobin protomerlərinin konformasiyasında kooperativ dəyişikliklər
düyü. 1.24. O2 ilə qarşılıqlı əlaqə zamanı hemoglobin protomerlərinin konformasiyasında kooperativ dəyişikliklər
Dokularda hər bir sonrakı O 2 molekulu, həmçinin protomerlərin konformasiyasındakı kooperativ dəyişikliklər səbəbindən əvvəlkindən daha asan ayrılır.
7. Üzvi maddələrin katabolizmi zamanı əmələ gələn CO 2 və H+ onların konsentrasiyasına mütənasib olaraq hemoglobinin O 2-yə yaxınlığını azaldır. Hüceyrə fəaliyyəti üçün lazım olan enerji, ilk növbədə, hemoglobin tərəfindən ağciyərlərdən çatdırılan O 2-dən istifadə edərək üzvi maddələrin oksidləşməsi zamanı mitoxondriyada istehsal olunur. Üzvi maddələrin oksidləşməsi nəticəsində onların parçalanmasının son məhsulları əmələ gəlir: CO 2 və K 2 O, onların miqdarı davam edən oksidləşmə proseslərinin intensivliyi ilə mütənasibdir.
CO 2 hüceyrələrdən qana yayılır və qırmızı qan hüceyrələrinə nüfuz edir, burada karbanhidraz fermentinin təsiri altında karbon turşusuna çevrilir. Bu zəif turşu protona və bikarbonat ionuna ayrılır.
H+ onun radikallarına qoşulmağa qadirdir 14 6 hemoglobinin α- və β-zəncirlərində, yəni. hemedən uzaq ərazilərdə. Hemoqlobinin protonlaşması onun O 2-yə yaxınlığını azaldır, O 2-nin oxyHb-dən çıxarılmasına, deoksiHb əmələ gəlməsinə kömək edir və əmələ gələn protonların sayına mütənasib olaraq toxumaların oksigenlə təchizatını artırır (şək. 1.25).
Qırmızı qan hüceyrələrində H+ konsentrasiyasının artmasından asılı olaraq ayrılan oksigenin miqdarının artmasına Bor effekti deyilir (bu effekti ilk dəfə kəşf etmiş Danimarka fizioloqu Kristian Borun şərəfinə adlandırılmışdır).
Ağciyərlərdə oksigenin yüksək qismən təzyiqi onun deoksiHb-yə bağlanmasına kömək edir ki, bu da zülalın H+-a yaxınlığını azaldır. Karbon turşusunun təsiri altında sərbəst buraxılan protonlar bikarbonatlarla reaksiyaya girərək CO 2 və H 2 O əmələ gətirir.

 düyü. 1.25. Hb-nin O 2 üçün yaxınlığının CO 2 və protonların konsentrasiyasından asılılığı (Bohr effekti):
düyü. 1.25. Hb-nin O 2 üçün yaxınlığının CO 2 və protonların konsentrasiyasından asılılığı (Bohr effekti):
A- HB ilə kompleksdən O 2-nin ayrılmasına CO 2 və H+ konsentrasiyasının təsiri (Bohr effekti); B- ağciyərlərdə deoksihemoqlobinin oksigenləşməsi, CO 2-nin əmələ gəlməsi və sərbəst buraxılması.
Nəticədə CO 2 alveolyar boşluğa daxil olur və ekshalasiya edilmiş hava ilə çıxarılır. Beləliklə, toxumalarda hemoglobin tərəfindən ayrılan oksigenin miqdarı üzvi maddələrin katabolizm məhsulları ilə tənzimlənir: maddələrin parçalanması nə qədər intensiv olarsa, məsələn, fiziki məşqlər zamanı CO 2 və H + konsentrasiyası bir o qədər yüksək olar və oksigen bir o qədər çox olar. toxumalar Hb-nin O 2-yə yaxınlığının azalması nəticəsində qəbul edilir.
8. Hb-nin O2-yə yaxınlığının allosterik tənzimlənməsi liqand - 2,3-bifosfogliserat tərəfindən. Eritrositlərdə hemoglobinin allosterik liqandı 2,3-bifosfogliserat (2,3-BPG) qlükoza oksidləşmə məhsulundan - 1,3-bifosfogliseratdan sintez olunur. Normal şəraitdə 2,3-BPG konsentrasiyası yüksəkdir və Hb konsentrasiyası ilə müqayisə edilə bilər. 2,3-BPG güclü mənfi yükə malikdir -5.
 Doku kapilyarlarında olan bifosfogliserat deoksihemoqlobinə bağlanaraq, toxumalara oksigenin buraxılmasını artırır, Hb-nin O 2-yə yaxınlığını azaldır.
Doku kapilyarlarında olan bifosfogliserat deoksihemoqlobinə bağlanaraq, toxumalara oksigenin buraxılmasını artırır, Hb-nin O 2-yə yaxınlığını azaldır.
Tetramerik hemoglobin molekulunun mərkəzində bir boşluq var. Bütün dörd protomerin amin turşusu qalıqları ilə əmələ gəlir (bax. Şəkil 1.22). Toxuma kapilyarlarında Hb-nin protonlaşması (Bohr effekti) hem dəmiri ilə O2 arasındakı əlaqənin qırılmasına səbəb olur. Bir molekulda
deoksihemoqlobin, oksihemoqlobinlə müqayisədə, protomerləri birləşdirən əlavə ion bağları meydana çıxır, bunun nəticəsində mərkəzi boşluğun ölçüləri oksihemoqlobinlə müqayisədə artır. Mərkəzi boşluq 2,3-BPG-nin hemoglobinə bağlandığı yerdir. Mərkəzi boşluğun ölçüsünün fərqinə görə, 2,3-BPG yalnız deoksihemoqlobinə bağlana bilər.
2,3-BPG zülalın aktiv mərkəzlərindən uzaq bir yerdə hemoglobinlə qarşılıqlı əlaqədə olur və allosterik(tənzimləyici) ligandlar və Hb-nin mərkəzi boşluğudur allosterik mərkəz. 2,3-BPG güclü mənfi yükə malikdir və Hb-nin iki β-zəncirinin beş müsbət yüklü qrupu ilə qarşılıqlı əlaqədə olur: Valın N-terminal α-amino qrupu və Lys 82 His 143 radikalları (Şəkil 1.26).
 düyü. 1.26. Deoksihemoqlobinin mərkəzi boşluğunda BPG
düyü. 1.26. Deoksihemoqlobinin mərkəzi boşluğunda BPG
BPG hər β-teldə üç müsbət yüklü qrupa bağlanır.
Toxuma kapilyarlarında yaranan dezoksihemoqlobin 2,3-BPG ilə qarşılıqlı əlaqədə olur və β-zəncirlərinin müsbət yüklü radikalları ilə mənfi yüklü liqand arasında ion bağları əmələ gəlir ki, bu da zülalın konformasiyasını dəyişdirir və Hb-nin O2-yə yaxınlığını azaldır. . Hb-nin O 2-yə yaxınlığının azalması O 2-nin toxumaya daha səmərəli buraxılmasına kömək edir.
Ağciyərlərdə yüksək qismən təzyiqdə oksigen Hb ilə qarşılıqlı əlaqədə olur, heme dəmiri birləşdirir; bu zaman zülalın konformasiyası dəyişir, mərkəzi boşluq azalır və 2,3-BPG allosterik mərkəzdən sıxışdırılır.
Beləliklə, oliqomer zülallar monomerik zülallarla müqayisədə yeni xüsusiyyətlərə malikdir. Liqandların yerlərdə bağlanması
bir-birindən məkanca uzaq (allosterik), bütün zülal molekulunda konformasiya dəyişikliklərinə səbəb ola bilər. Tənzimləyici liqandlarla qarşılıqlı təsir nəticəsində zülal molekulunun funksiyasının ətraf mühitdəki dəyişikliklərə uyğunlaşması və uyğunlaşması baş verir.
MÖVZU 1.5. ZÜLLLƏRİN HÜCƏRİYYƏ ŞƏRTLƏRİNDƏ DOĞRU KONFORMASİYALARININ SAXLANILMASI
Hüceyrələrdə polipeptid zəncirlərinin sintezi zamanı onların membranlar vasitəsilə hüceyrənin müvafiq hissələrinə daşınması, qatlama prosesində (doğma konformasiyanın əmələ gəlməsi) və oliqomer zülalların yığılması zamanı, həmçinin onların fəaliyyəti zamanı aralıq , zülal strukturunda aqreqasiyaya meylli, qeyri-sabit konformasiyalar yaranır. Adətən yerli konformasiyada zülal molekulunun daxilində gizlənən hidrofobik radikallar səthdə qeyri-sabit konformasiyada görünür və suda zəif həll olunan digər zülal qrupları ilə birləşməyə meyllidirlər. Bütün məlum orqanizmlərin hüceyrələrində hüceyrə zülallarının optimal qatlanmasını təmin edən, fəaliyyət zamanı onların yerli konformasiyasını sabitləşdirən və ən əsası homeostaz pozulduqda hüceyrədaxili zülalların strukturunu və funksiyalarını qoruyan xüsusi zülallar aşkar edilmişdir. Bu zülallar adlanır "şaperonlar" fransızca "dayə" deməkdir.
1. Molekulyar şaperonlar və onların zülal denaturasiyasının qarşısının alınmasında rolu.
Şaperonlar (CH) alt bölmələrinin kütləsinə görə təsnif edilir. Yüksək molekulyar ağırlıqlı şaperonların kütləsi 60 ilə 110 kDa arasındadır. Onların arasında üç sinif daha çox öyrənilmişdir: Ş-60, Ş-70 və Ş-90. Hər bir sinfə əlaqəli zülallar ailəsi daxildir. Beləliklə, Sh-70 molekulyar çəkisi 66 ilə 78 kDa arasında olan zülalları ehtiva edir. Aşağı molekulyar ağırlıqlı şaperonların molekulyar çəkisi 40 ilə 15 kDa arasındadır.
Şaperonlar arasında da var konstitutiv yüksək bazal sintezi orqanizmin hüceyrələrinə stress təsirindən asılı olmayan zülallar və induksiya edilə bilən, normal şəraitdə sintezi zəifdir, lakin stress altında kəskin şəkildə artır. İnduksiya olunan şaperonlar həmçinin "istilik şoku zülalları" adlanır, çünki onlar ilk dəfə təsirə məruz qalan hüceyrələrdə aşkar edilmişdir. yüksək temperatur. Hüceyrələrdə zülalların yüksək konsentrasiyası səbəbindən qismən denatürasiya olunmuş zülalların kortəbii reaktivləşməsi çətindir. Sh-70 denatürasiyanın başlanmasının qarşısını ala bilər və zülalların təbii uyğunlaşmasını bərpa etməyə kömək edir. Molekulyar şaperonlar-70- hüceyrənin bütün hissələrində olan yüksək dərəcədə qorunan zülal sinfi: sitoplazma, nüvə, endoplazmatik retikulum, mitoxondriya. Tək polipeptid zəncirinin karboksil ucunda Ş-70 uzunluqlu peptidlərlə qarşılıqlı əlaqə qura bilən bir yiv olan bir bölgə var.
hidrofobik radikallarla zənginləşdirilmiş 7-9 amin turşusu qalıqları. Qlobular zülallarda belə bölgələr təxminən hər 16 amin turşusunda olur. Sh-70 zülalları temperaturun inaktivasiyasından qorumağa və qismən denatürasiya olunmuş zülalların konformasiyasını və aktivliyini bərpa etməyə qadirdir.
2. Protein qatlanmasında şaperonların rolu. Ribosomda zülal sintezi zamanı polipeptidin N-terminal bölgəsi C-terminaldan əvvəl sintez olunur. Doğma konformasiyanı yaratmaq üçün zülalın tam amin turşusu ardıcıllığı tələb olunur. Protein sintezi prosesində, şaperonlar-70, aktiv mərkəzinin quruluşuna görə, sintez tamamlanana qədər hidrofob amin turşusu radikalları ilə zənginləşdirilmiş polipeptidin birləşməyə meylli sahələrini bağlaya bilir (Şəkil 1.27, A). ).
 düyü. 1.27. Şaperonların protein qatlanmasında iştirakı
düyü. 1.27. Şaperonların protein qatlanmasında iştirakı
A - sintez edilmiş polipeptidin bölmələri arasında hidrofobik qarşılıqlı təsirlərin qarşısının alınmasında şaperonlar-70-in iştirakı; B - şaperon kompleksində zülalın yerli konformasiyasının formalaşması
Domen quruluşu kimi mürəkkəb konformasiyaya malik olan bir çox yüksək molekullu zülallar Sh-60-ın əmələ gətirdiyi xüsusi boşluqda qatlanır. Ш-60 14 alt bölmədən ibarət oliqomerik kompleks kimi fəaliyyət göstərir. Onlar hər biri yeddi alt hissədən ibarət olan iki içi boş halqa əmələ gətirir, bu halqalar bir-birinə bağlıdır. Hər bir Sh-60 alt bölməsi üç domendən ibarətdir: apikal (apikal), halqanın boşluğuna baxan hidrofobik radikallarla zənginləşdirilmiş, aralıq və ekvatorial (Şəkil 1.28).
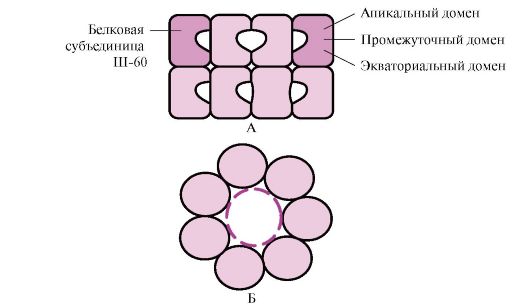 düyü. 1.28. 14 Ш-60-dan ibarət chaperonin kompleksinin quruluşu
düyü. 1.28. 14 Ш-60-dan ibarət chaperonin kompleksinin quruluşu
A - yan görünüş; B - yuxarıdan görünüş
Qatlanmamış molekulların səthində xarakterik elementləri olan sintez edilmiş zülallar, xüsusən hidrofobik radikallar şaperon halqalarının boşluğuna daxil olur. Bu boşluqların xüsusi mühitində enerji baxımından ən əlverişli olan yeganə olanı tapılana qədər mümkün konformasiyalar axtarılır (şək. 1.27, B). Konformasiyaların formalaşması və zülalların sərbəst buraxılması ekvator bölgəsində ATP hidrolizi ilə müşayiət olunur. Tipik olaraq, bu cür şaperona bağlı qatlama əhəmiyyətli miqdarda enerji tələb edir.
Şaperonlar zülalların üçölçülü strukturunun formalaşmasında və qismən denatürasiya olunmuş zülalların renativasiyasında iştirak etməklə yanaşı, oliqomer zülalların yığılması, denatürləşdirilmiş zülalların tanınması və lizosomlara daşınması kimi fundamental proseslərin baş verməsi üçün də lazımdır. zülalların membranlar vasitəsilə daşınması və zülal komplekslərinin fəaliyyətinin tənzimlənməsində iştirak.
MÖVZU 1.6. Zülalların müxtəlifliyi. ZÜLAL AİLƏLƏRİ: İMMUNOQLOBULİNLƏRİN NÜMUNƏSİ
1. Sincablar oynayır həlledici rol ayrı-ayrı hüceyrələrin və bütün çoxhüceyrəli orqanizmin həyat fəaliyyətində və onların funksiyaları təəccüblü dərəcədə müxtəlifdir. Bu, zülalların ilkin strukturunun və konformasiyasının xüsusiyyətləri, aktiv mərkəzin unikal strukturu və xüsusi liqandları bağlamaq qabiliyyəti ilə müəyyən edilir.
Peptid zəncirlərinin bütün mümkün variantlarının yalnız çox kiçik bir hissəsi sabit məkan quruluşunu qəbul edə bilər; çoxluq
onlardan təxminən eyni Gibbs enerjisi ilə bir çox uyğunlaşma qəbul edə bilər, lakin ilə müxtəlif xassələri. Ən çox tanınan zülalların ilkin quruluşu seçilmişdir bioloji təkamül, bu zülalın işləmə xüsusiyyətlərini təyin edən konformasiyalardan birinin müstəsna sabitliyini təmin edir.
2. Zülal ailələri. Eyni bioloji növlər daxilində amin turşusu qalıqlarının əvəzlənməsi əlaqəli funksiyaları yerinə yetirən və homoloji amin turşusu ardıcıllığına malik olan müxtəlif zülalların yaranmasına səbəb ola bilər. Bu cür əlaqəli zülallar heyrətamiz dərəcədə oxşar konformasiyalara malikdir: α-spiralların və/yaxud β-strukturların sayı və nisbi mövqeləri və polipeptid zəncirlərinin əksər növbələri və əyilmələri oxşar və ya eynidir. Polipeptid zəncirinin homoloji bölgələri, oxşar konformasiyası və əlaqəli funksiyaları olan zülallar zülal ailələrinə təsnif edilir. Zülal ailələrinə nümunələr: serin proteinazlar, immunoqlobulinlər ailəsi, miyoqlobin ailəsi.
Serin proteinazlar- proteolitik fermentlərin funksiyasını yerinə yetirən zülallar ailəsi. Bunlara həzm fermentləri - kimotripsin, tripsin, elastaz və bir çox qan laxtalanması faktorları daxildir. Bu zülallar öz mövqelərinin 40%-də eyni amin turşularına və çox oxşar konformasiyaya malikdirlər (Şəkil 1.29).

düyü. 1.29. Elastaz (A) və kimotripsinin (B) məkan strukturları
Bəzi amin turşularının dəyişdirilməsi bu zülalların substrat spesifikliyində dəyişikliklərə və ailə daxilində funksional müxtəlifliyin yaranmasına səbəb olmuşdur.
3. İmmunoqlobulinlər ailəsi.İmmunitet sisteminin fəaliyyətində böyük rol zülallar üç zülal ailəsini əhatə edən immunoqlobulin super ailəsində oynayır:
antikorlar (immunoqlobulinlər);
T-limfosit reseptorları;
Əsas histouyğunluq kompleksinin zülalları - MHC sinifləri 1 və 2 (Əsas Histouyğunluq Kompleksi).
Bütün bu zülallar bir domen quruluşuna malikdir, homoloji immunitetə bənzər domenlərdən ibarətdir və oxşar funksiyaları yerinə yetirir: onlar ya qanda, limfada və ya hüceyrələrarası mayedə (antikorlarda) həll edilmiş yad strukturlarla qarşılıqlı əlaqədə olurlar və ya hüceyrələrin səthində (öz və ya xarici).
4. Antikorlar- bədənə yad bir quruluşun daxil olmasına cavab olaraq B limfositləri tərəfindən istehsal olunan xüsusi zülallar adlanır. antigen.
Antikorların quruluşunun xüsusiyyətləri
Ən sadə antikor molekulları dörd polipeptid zəncirindən ibarətdir: iki eyni yüngül - L, təxminən 220 amin turşusu və iki eyni ağır - H, 440-700 amin turşusundan ibarətdir. Antikor molekulunun bütün dörd zəncirləri bir çox qeyri-kovalent bağ və dörd disulfid rabitəsi ilə bağlıdır (şək. 1.30).
Antikor yüngül zəncirləri iki domendən ibarətdir: polipeptid zəncirinin N-terminal bölgəsində yerləşən dəyişən domen (VL) və C-terminusunda yerləşən daimi domen (CL). Ağır zəncirlər adətən dörd sahəyə malikdir: N-terminusda yerləşən bir dəyişən (VH) və üç sabit domen (CH1, CH2, CH3) (bax. Şəkil 1.30). Hər bir immunoqlobulin domenində iki sistein qalığının disulfid bağı ilə bağlandığı β-yaşaq üst quruluşu var.
İki daimi CH1 və CH2 domenləri arasında çoxlu sayda prolin qalıqları olan bir bölgə var ki, bu da ikincil strukturun formalaşmasına və bu seqmentdə qonşu H zəncirlərinin qarşılıqlı təsirinə mane olur. Bu menteşə bölgəsi antikor molekuluna elastiklik verir. Ağır və yüngül zəncirlərin dəyişkən domenləri arasında iki eyni antigen bağlayan yer (antigenləri bağlayan aktiv yerlər) var, buna görə də belə antikorlar tez-tez adlanır. bivalentlər. Antigenin antikorla bağlanmasında hər iki zəncirin dəyişən bölgələrinin bütün amin turşusu ardıcıllığı deyil, hər zəncirin hiperdəyişən bölgələrində yerləşən yalnız 20-30 amin turşusu iştirak edir. Məhz bu bölgələr hər bir antikor növünün müvafiq tamamlayıcı antigenlə qarşılıqlı əlaqədə unikal qabiliyyətini müəyyən edir.
Antikorlar bədənin xarici orqanizmlərə daxil olmasına qarşı müdafiə xəttlərindən biridir. Onların fəaliyyətini iki mərhələyə bölmək olar: birinci mərhələ yad orqanizmlərin səthində antigenin tanınması və bağlanmasıdır ki, bu da antikor strukturunda antigen bağlayan yerlərin olması səbəbindən mümkündür; ikinci mərhələ antigenin inaktivasiyası və məhv edilməsi prosesinin başlanmasıdır. İkinci mərhələnin spesifikliyi antikorların sinfindən asılıdır. Daimi domenlərin strukturunda bir-birindən fərqlənən beş ağır zəncir sinfi var: α, δ, ε, γ və μ, bunlara görə immunoqlobulinlərin beş sinfi fərqləndirilir: A, D, E, G və M.
Ağır zəncirlərin struktur xüsusiyyətləri ağır zəncirlərin menteşə bölgələrinə və C-terminal bölgələrinə hər bir sinif üçün uyğunluq xarakteristikasını verir. Antigen antikorla bağlandıqdan sonra daimi domenlərdəki konformasiya dəyişiklikləri antigenin çıxarılması yolunu müəyyən edir.
 düyü. 1. 30. IgG-nin domen strukturu
düyü. 1. 30. IgG-nin domen strukturu
İmmunoqlobulinlər M
İmmunoqlobulin M iki forma malikdir.
Monomer forma- inkişaf edən B limfositləri tərəfindən istehsal olunan 1-ci sinif antikorlar. Sonradan, bir çox B hüceyrəsi eyni antigen bağlayan yerə malik olan digər antikor sinifləri istehsal etməyə keçir. IgM membrana yerləşdirilir və antigenin tanınması reseptoru kimi çıxış edir. İgM-nin hüceyrə membranına inteqrasiyası bölgənin quyruq hissəsində 25 hidrofobik amin turşusu qalıqlarının olması səbəbindən mümkündür.
IgM-nin sekretor forması disulfid bağları və əlavə J polipeptid zənciri ilə bir-birinə bağlı beş monomerik alt bölmədən ibarətdir (Şəkil 1.31). Bu formada olan monomerlərin ağır zəncirlərində hidrofobik quyruq yoxdur. Pentamerin 10 antigen bağlayan yeri var və buna görə də bədənə ilk daxil olan antigeni tanımaqda və xaric etməkdə effektivdir. IgM-nin sekretor forması ilkin immun cavab zamanı qana ifraz olunan antikorların əsas sinfidir. IgM-nin antigenə bağlanması IgM-nin konformasiyasını dəyişir və onun komplement sisteminin birinci zülal komponentinə bağlanmasına (kompleman sistemi antigenin məhv edilməsində iştirak edən zülallar toplusudur) və bu sistemin aktivləşməsinə səbəb olur. Antigen mikroorqanizmin səthində yerləşirsə, komplement sistemi hüceyrə membranının bütövlüyünün pozulmasına və bakteriya hüceyrəsinin ölümünə səbəb olur.
İmmunoqlobulinlər G
Kəmiyyət baxımından qanda immunoqlobulinlərin bu sinfi üstünlük təşkil edir (bütün İq-lərin 75%-i). IgG - monomerlər, ikincil immun cavab zamanı qana ifraz olunan antikorların əsas sinfi. IgG-nin mikroorqanizmlərin səthi antigenləri ilə qarşılıqlı əlaqəsindən sonra antigen-antikor kompleksi komplement sisteminin zülallarını bağlaya və aktivləşdirməyə qadirdir və ya makrofaqların və neytrofillərin xüsusi reseptorları ilə qarşılıqlı əlaqədə ola bilər. Faqositlərlə qarşılıqlı əlaqə səbəb olur
 düyü. 1.31. IgM-nin sekretor formasının quruluşu
düyü. 1.31. IgM-nin sekretor formasının quruluşu
antigen-antikor komplekslərinin udulmasına və onların hüceyrə faqosomlarında məhvinə. IgG, plasenta baryerinə nüfuz edə bilən və dölün infeksiyalardan intrauterin qorunmasını təmin edən yeganə antikor sinfidir.
İmmunoqlobulinlər A
Sekresiyalarda (süd, tüpürcək, tənəffüs sekresiyaları və bağırsaq traktının). IgA ilk növbədə dimerik formada ifraz olunur, burada monomerlər əlavə J zənciri vasitəsilə bir-biri ilə bağlıdır (şəkil 1.32).
IgA komplement sistemi və faqositar hüceyrələrlə qarşılıqlı təsir göstərmir, lakin mikroorqanizmlərə bağlanaraq, antitellər onların epitel hüceyrələrinə yapışmasının və bədənə nüfuz etməsinin qarşısını alır.
İmmunoqlobulinlər E
İmmunoqlobulinlər E, ağır ε-zəncirlərinin, M immunoqlobulinlərinin μ-zəncirləri kimi bir dəyişən və dörd sabit domen ehtiva etdiyi monomerlərlə təmsil olunur. Sekresiyadan sonra IgE onunla bağlanır
 düyü. 1.32. IgA-nın quruluşu
düyü. 1.32. IgA-nın quruluşu
Mast hüceyrələrinin və bazofillərin səthində müvafiq reseptorları olan C-terminal bölgələri. Nəticədə, onlar bu hüceyrələrin səthində antigenlər üçün reseptorlara çevrilirlər (şəkil 1.33).
 düyü. 1.33. IgE-nin mast hüceyrəsinin səthində antigenlə qarşılıqlı əlaqəsi
düyü. 1.33. IgE-nin mast hüceyrəsinin səthində antigenlə qarşılıqlı əlaqəsi
Antigen IgE-nin müvafiq antigen bağlayan yerlərinə yapışdıqdan sonra hüceyrələr iltihab reaksiyasının inkişafı və allergik reaksiyaların təzahürü üçün böyük ölçüdə cavabdeh olan bioloji aktiv maddələri (histamin, serotonin) ifraz etmək üçün siqnal alır. astma, ürtiker, ot qızdırması.
İmmunoqlobulinlər D
İmmunoqlobulin D çox miqdarda serumda olur kiçik miqdar, onlar monomerlərdir. Ağır δ zəncirlərində bir dəyişən və üç sabit domen var. IgD-lər B limfositləri üçün reseptor kimi çıxış edir, digər funksiyaları hələ də məlum deyil. Xüsusi antigenlərin B-limfositlərin (IgD) səthindəki reseptorlarla qarşılıqlı əlaqəsi bu siqnalların hüceyrəyə ötürülməsinə və verilmiş limfosit klonunun yayılmasını təmin edən mexanizmlərin işə salınmasına səbəb olur.
MÖVZU 1.7. ZÜLALLARIN FİZİKİ-KİMYƏSİ XÜSUSİYYƏTLƏRİ VƏ ONLARIN AYRILMASI ÜSULLARI.
1. Fərdi zülallar fiziki və kimyəvi xüsusiyyətlərinə görə fərqlənir:
Molekulların forması;
Molekulyar çəki;
Böyüklüyü amin turşularının anion və kation qruplarının nisbətindən asılı olan ümumi yük;
Molekulların səthində qütblü və qeyri-qütblü amin turşusu radikallarının nisbəti;
Müxtəlif denaturasiyaedici maddələrə qarşı müqavimət dərəcələri.
2. Protein həlli asılıdır yuxarıda sadalanan zülalların xassələri, həmçinin zülalın həll olunduğu mühitin tərkibi (pH dəyərləri, duzun tərkibi, temperatur, zülalla qarşılıqlı təsir göstərə bilən digər üzvi maddələrin olması) haqqında. Zülal molekullarının yükünün miqdarı onların həll olunma qabiliyyətinə təsir edən amillərdən biridir. İzoelektrik nöqtədəki yük itirildikdə, zülallar daha asan birləşir və çökür. Bu, xüsusilə səthdə hidrofobik amin turşusu radikallarının göründüyü denatürləşdirilmiş zülallar üçün xarakterikdir.
Zülal molekulunun səthində həm müsbət, həm də mənfi yüklü amin turşusu radikalları var. Bu qrupların sayı və buna görə də zülalların ümumi yükü mühitin pH-dan asılıdır, yəni. H+ - və OH - qruplarının konsentrasiyalarının nisbəti. Turşu mühitdə H+ konsentrasiyasının artması karboksil qruplarının -COO - + H+ > - COOH dissosiasiyasının basdırılmasına və zülalların mənfi yükünün azalmasına səbəb olur. Qələvi mühitdə artıq OH-nin - amin qruplarının -NH 3 + + OH - - NH 2 + H 2 O-nun suyun əmələ gəlməsi ilə dissosiasiyası zamanı əmələ gələn protonlarla bağlanması zülalların müsbət yükünün azalmasına səbəb olur. . Bir zülalın xalis sıfır yükü olduğu pH dəyəri deyilir izoelektrik nöqtə (IEP). IET-də müsbət və mənfi yüklü qrupların sayı eynidir, yəni. zülal izoelektrik vəziyyətdədir.
3. Fərdi zülalların ayrılması. Bədənin quruluşu və fəaliyyətinin xüsusiyyətləri onda sintez olunan zülalların dəstindən asılıdır. Zülalların quruluşunu və xassələrini öyrənmək onları hüceyrədən təcrid etmədən, digər zülallardan və üzvi molekullardan təmizləmədən mümkün deyil. Fərdi zülalların ayrılması və təmizlənməsi mərhələləri:
Hüceyrə məhviöyrənilən toxuma və homogenat əldə edilir.
Homojenatın fraksiyalara ayrılması sentrifuqasiya yolu ilə, nüvə, mitoxondrial, sitozolik və ya arzu olunan zülalı ehtiva edən digər fraksiya əldə edilir.
Seçici termal denaturasiya- zülal məhlulunun qısa müddətli qızdırılması, bu müddət ərzində bəzi denatürləşdirilmiş zülal çirkləri çıxarıla bilər (zülal nisbətən istiliyə davamlıdırsa).
Tuzlama. Müxtəlif zülallar nə zaman çökür müxtəlif konsentrasiyalar məhluldakı duzlar. Duz konsentrasiyasını tədricən artırmaqla, onlardan birində təcrid olunmuş zülalın üstünlük təşkil etdiyi bir sıra ayrı-ayrı fraksiyalar əldə etmək mümkündür. Ammonium sulfat ən çox protein fraksiyaları üçün istifadə olunur. Ən az həll olunan zülallar aşağı duz konsentrasiyalarında çökür.
Gel filtrasiyası- şişmiş Sephadex qranulları (məsamələri olan dekstranın üçölçülü polisaxarid zəncirləri) vasitəsilə molekulların süzülməsi üsulu. Zülalların Sephadex ilə doldurulmuş sütundan keçmə sürəti onların molekulyar çəkisindən asılı olacaq: zülal molekullarının kütləsi nə qədər kiçik olsa, onlar qranulalara bir o qədər asan nüfuz edər və orada daha uzun müddət qalırlar; kütlə nə qədər böyük olarsa, zülallardan bir o qədər tez ayrılırlar. sütun.
Ultrasentrifuqalama- bir sentrifuqa borusuna zülalların ultrasentrifuqanın rotoruna yerləşdirilməsini nəzərdə tutan üsul. Rotor fırlananda zülalların çökmə sürəti onların molekulyar çəkisi ilə mütənasibdir: daha ağır zülalların fraksiyaları sınaq borusunun dibinə, daha yüngül olanlar isə səthə yaxın yerləşir.
Elektroforez- elektrik sahəsində zülalların hərəkət sürətindəki fərqlərə əsaslanan üsul. Bu dəyər zülalların yükü ilə mütənasibdir. Zülalların elektroforezi kağız üzərində (bu halda zülalların hərəkət sürəti yalnız onların yükü ilə mütənasibdir) və ya müəyyən məsamə ölçüsü olan poliakrilamid geldə (zülalların hərəkət sürəti onların yükü və molekulyar çəkisi ilə mütənasibdir) aparılır. .
İon mübadiləsi xromatoqrafiyası- ionlaşmış zülal qruplarının əks yüklü ion mübadilə qatranları (həll olmayan) qrupları ilə bağlanmasına əsaslanan fraksiya üsulu polimer materiallar). Zülalın qatranla bağlanmasının gücü zülalın yükü ilə mütənasibdir. İon dəyişdirici polimerə adsorbsiya edilmiş zülallar NaCl məhlullarının artan konsentrasiyası ilə yuyula bilər; zülal yükü nə qədər aşağı olarsa, qatranın ion qruplarına bağlanmış zülalın yuyulması üçün tələb olunan NaCl konsentrasiyası bir o qədər aşağı olar.
Yaxınlıq xromatoqrafiyası- ayrı-ayrı zülalları təcrid etmək üçün ən spesifik üsul.Zülalın liqandı inert polimerə kovalent şəkildə bağlanır. Bir zülal məhlulu polimerlə bir sütundan keçirildikdə, zülalın liqandla tamamlayıcı bağlanması səbəbindən sütunda yalnız müəyyən bir liqand üçün xüsusi zülal adsorbsiya olunur.
Dializ- təcrid olunmuş zülal məhlulundan aşağı molekulyar ağırlıqlı birləşmələrin çıxarılması üçün istifadə edilən üsul. Metod aşağı molekulyar ağırlıqlı maddələrdən fərqli olaraq zülalların yarımkeçirici membrandan keçə bilməməsinə əsaslanır. Zülalları aşağı molekulyar çirklərdən, məsələn, duzdan sonra duzlardan təmizləmək üçün istifadə olunur.
SİNFDƏN XARXI İŞ ÜÇÜN TOPŞURLAR
1. Cədvəli doldurun. 1.4.
Cədvəl 1.4. Əlaqəli zülalların - miyoqlobin və hemoglobinin strukturu və funksiyalarının müqayisəli təhlili
a) Mb və Hb-nin aktiv mərkəzinin quruluşunu xatırlayın. Bu zülalların aktiv mərkəzlərinin əmələ gəlməsində hidrofobik amin turşusu radikalları hansı rol oynayır? Mb və Hb-nin aktiv mərkəzinin quruluşunu və ona liqandların bağlanma mexanizmlərini təsvir edin. Onun F 8 və Onun E 7 qalıqları Mv iHv-nin aktiv mərkəzinin fəaliyyətində hansı rol oynayır?
b) yaxından əlaqəli oliqomer zülal olan hemoglobin monomer miyoqlobinə nisbətən hansı yeni xüsusiyyətlərə malikdir? Hemoqlobin molekulunda protomerlərin konformasiyasında kooperativ dəyişikliklərin rolunu, CO 2 və proton konsentrasiyalarının hemoglobinin oksigenə yaxınlığına təsirini, həmçinin Hb funksiyasının allosterik tənzimlənməsində 2,3-BPG-nin rolunu izah edin. .
2. Molekulyar şaperonları xarakterizə edin, onların quruluşu və funksiyası arasındakı əlaqəyə diqqət yetirin.
3. Hansı zülallar ailələrə qruplaşdırılır? İmmunoqlobulinlər ailəsinin nümunəsindən istifadə edərək, bu ailənin zülallarının oxşar struktur xüsusiyyətlərini və əlaqəli funksiyalarını müəyyənləşdirin.
4. Təmizlənmiş fərdi zülallar tez-tez biokimyəvi və dərman məqsədləri üçün tələb olunur. Zülalların ayrılması və təmizlənməsi üçün istifadə olunan üsulların hansı fiziki-kimyəvi xüsusiyyətlərinə əsaslandığını izah edin.
ÖZÜNÜNƏNİZƏT VƏZİFƏLƏRİ
1. Düzgün cavabları seçin.
Hemoqlobinin funksiyaları:
A. O 2-nin ağciyərlərdən toxumaya daşınması B. H+-nın toxumalardan ağciyərlərə daşınması
B. Qanın pH səviyyəsinin sabit saxlanılması D. CO 2-nin ağciyərlərdən toxumalara daşınması
D. CO 2-nin toxumalardan ağciyərlərə daşınması
2. Düzgün cavabları seçin. liqandα -protomer Hb: A. Heme
B. Oksigen
B. CO G. 2,3-BPG
D. β-protomer
3. Düzgün cavabları seçin.
Hemoqlobin miyoqlobindən fərqli olaraq:
A. Dördüncü quruluşa malikdir
B. İkinci dərəcəli struktur yalnız α-sarmallarla təmsil olunur
B. Mürəkkəb zülallara aiddir
D. Allosterik liqandla qarşılıqlı təsirə girir D. Heme kovalent bağlıdır
4. Düzgün cavabları seçin.
Hb-nin O2-yə yaxınlığı azalır:
A. Bir O 2 molekulu əlavə edildikdə B. Bir O 2 molekulu çıxarıldıqda
B. 2,3-BPG ilə qarşılıqlı əlaqədə olduqda
D. protomerlərə H + D əlavə edildikdə. 2,3-BPG konsentrasiyası azaldıqda
5. Qarşılaşma.
HB növləri aşağıdakılarla xarakterizə olunur:
A. Deoksi şəklində fibrilyar aqreqatlar əmələ gətirir B. İki α- və iki δ-zəncirdən ibarətdir.
B. Yetkin eritrositlərdə Hb-nin üstünlük təşkil edən forması D. Aktiv mərkəzdə Fe+ 3 olan heme ehtiva edir.
D. İki α- və iki γ-zəncirindən ibarətdir 1. HbA 2.
6. Qarşılaşma.
Hb liqandları:
A. Allosterik mərkəzdə Hb ilə birləşir
B. Hb-nin aktiv sahəsinə çox yüksək yaxınlığa malikdir
B. Birləşərək, Hb-nin O 2 G-yə yaxınlığını artırır. Fe+ 2-ni Fe+ 3-ə oksidləşdirir.
D. OnunF8 ilə kovalent rabitə əmələ gətirir
7. Düzgün cavabları seçin.
Şaperonlar:
A. Zülallar hüceyrənin bütün hissələrində mövcuddur
B. Stress altında sintez artır
B. Denatürləşdirilmiş zülalların hidrolizində iştirak edir
D. Zülalların yerli konformasiyasının saxlanmasında iştirak edir
D. Onlar zülalların konformasiyasının əmələ gəldiyi orqanoidlər yaradırlar.
8. Uyğunluq. İmmunoqlobulinlər:
A. Sekretor forması pentamerdir.
B. Plasental maneəyə nüfuz edən Ig sinfi
B. Ig - mast hüceyrə reseptoru
D. epitel hüceyrələrinin ifraz mövcud Ig əsas sinif. D. B-limfosit reseptoru, aktivləşdirilməsi hüceyrə proliferasiyasını təmin edir
9. Düzgün cavabları seçin.
İmmunoqlobulin E:
A. Makrofaqlar tərəfindən istehsal olunur B. Onların ağır ε zəncirləri var.
B. T-limfositlərin membranında yerləşdirilmişdir
D. Mast hüceyrələri və bazofillər üzərində membran antigen reseptorları kimi fəaliyyət göstərir
D. Allergik reaksiyalara cavabdehdir
10. Düzgün cavabları seçin.
Zülalların ayrılması üsulu onların molekulyar çəkilərindəki fərqlərə əsaslanır:
A. Gel filtrasiyası
B. Ultrasentrifuqalama
B. Poliakrilamid gel elektroforezi D. İon mübadiləsi xromatoqrafiyası
D. Yaxınlıq xromatoqrafiyası
11. Düzgün cavabı seç.
Zülalların ayrılması üsulu onların suda həllolma fərqlərinə əsaslanır:
A. Gel filtrasiyası B. Tuzlanması
B. İon mübadiləsi xromatoqrafiyası D. Yaxınlıq xromatoqrafiyası
D. Poliakrilamid geldə elektroforez
“ÖZÜNÜNƏZƏRƏT VƏZİFƏLƏRİNƏ” CAVAB STANDARTLARI
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-G
6. 1-B, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-B
ƏSAS ŞƏRTLƏR VƏ KONSEPSİYALAR
1. Oliqomer zülallar, protomer, zülalların dördüncü quruluşu
2. Protomer konformasiyasında kooperativ dəyişikliklər
3. Bor effekti
4. Zülal funksiyalarının allosterik tənzimlənməsi, allosterik mərkəz və allosterik effektor
5. Molekulyar şaperonlar, istilik şoku zülalları
6. Zülal ailələri (serin proteazlar, immunoqlobulinlər)
7. IgM-, G-, E-, A-struktur-funksiya əlaqəsi
8. Zülalların ümumi yükü, zülalların izoelektrik nöqtəsi
9. Elektroforez
10. Duzlama
11. Gel filtrasiyası
12. İon mübadiləsi xromatoqrafiyası
13. Ultrasentrifuqalama
14. Yaxınlıq xromatoqrafiyası
15. Qan plazma zülallarının elektroforezi
SİNF İŞLƏRİ ÜÇÜN TAPŞIQLAR
1. Hemoqlobinin (Hb) və miyoqlobinin (Mb) oksigenlə doyma dərəcələrinin onun toxumalarda qismən təzyiqindən asılılıqlarını müqayisə edin.
 düyü. 1.34. Doyma Mv asılılığı vəNHonun qismən təzyiqindən oksigen
düyü. 1.34. Doyma Mv asılılığı vəNHonun qismən təzyiqindən oksigen
Nəzərə alın ki, zülalın oksigenlə doyma əyrilərinin forması fərqlidir: miyoqlobin üçün - hiperbola, hemoglobin üçün - sigmoid forma.
1. Mb və Hb-nin O 2 ilə 50% doyduğu oksigenin qismən təzyiqinin dəyərlərini müqayisə edin. Bu zülallardan hansının O2-yə daha çox yaxınlığı var?
2. Mb-nin hansı struktur xüsusiyyətləri onun O 2 üçün yüksək yaxınlığını müəyyən edir?
3. HB-nin hansı struktur xüsusiyyətləri ona istirahət edən toxumaların kapilyarlarında O2-ni buraxmağa imkan verir (O2-nin nisbətən yüksək parsial təzyiqində) və işləyən əzələlərdə bu ifrazı kəskin şəkildə artırır? Oliqomerik zülalların hansı xüsusiyyəti bu effekti təmin edir?
4. O 2 (%) oksigenləşdirilmiş hemoglobinin istirahət edən və işləyən əzələlərə hansı miqdarını verdiyini hesablayın?
5. zülalın strukturu ilə onun funksiyası arasındakı əlaqə haqqında nəticə çıxarın.
2. Kapilyarlarda hemoglobin tərəfindən ayrılan oksigenin miqdarı toxumalarda katabolik proseslərin intensivliyindən asılıdır (Bohr effekti). Toxuma mübadiləsində dəyişikliklər Hb-nin O2-yə yaxınlığını necə tənzimləyir? CO 2 və H+-nın Hb-nin O 2-yə yaxınlığına təsiri
 1. Bor effektini təsvir edin.
1. Bor effektini təsvir edin.
2. diaqramda göstərilən proses hansı istiqamətdə gedir:
a) ağciyərlərin kapilyarlarında;
b) toxuma kapilyarlarında?
3. Bor effektinin fizioloji əhəmiyyəti nədir?
4. Nə üçün Hb-nin H+ ilə hemadan uzaq yerlərdə qarşılıqlı təsiri zülalın O 2-yə yaxınlığını dəyişir?
3. Hb-nin O2-yə yaxınlığı onun liqandının - Hb-nin O2-yə yaxınlığının allosterik tənzimləyicisi olan 2,3-bifosfogliseratın konsentrasiyasından asılıdır. Nə üçün aktiv bölgədən uzaqda olan ligandların qarşılıqlı təsiri protein funksiyasına təsir edir? 2,3-BPG Hb-nin O2-yə yaxınlığını necə tənzimləyir? Problemi həll etmək üçün aşağıdakı suallara cavab verin:
1. 2.3-bifosfogliserat (2,3-BPG) harada və nədən sintez olunur? Onun düsturunu yazın, bu molekulun yükünü göstərin.
2. BPG hansı hemoglobinin forması (oksi və ya deoksi) ilə qarşılıqlı təsir göstərir və niyə? Hb molekulunun hansı hissəsində qarşılıqlı təsir baş verir?
3. diaqramda göstərilən proses hansı istiqamətdə baş verir?
a) toxuma kapilyarlarında;
b) ağciyərlərin kapilyarlarında?
4. burada kompleksin konsentrasiyası daha yüksək olmalıdır
Nv-2,3-BFG:
a) istirahətdə olan əzələlərin kapilyarlarında;
b) işləyən əzələlərin kapilyarlarında (eritrositlərdə BPG-nin eyni konsentrasiyası təmin edilir)?
5. İnsan yüksək hündürlük şəraitinə uyğunlaşdıqda, eritrositlərdə BPG-nin konsentrasiyası artarsa, HB-nin oksigenə yaxınlığı necə dəyişəcək? Bu fenomenin fizioloji əhəmiyyəti nədir?
4. Konservləşdirilmiş qanın saxlanması zamanı 2,3-BPG-nin məhv edilməsi HB-nin funksiyalarını pozur. Eritrositlərdə 2,3-BPG-nin konsentrasiyası 8-dən 0,5 mmol/l-ə qədər azala bilsə, konservləşdirilmiş qanda HB-nin O 2-yə yaxınlığı necə dəyişəcək. 2,3-BPG konsentrasiyası üç gündən gec olmayaraq bərpa olunarsa, bu cür qanı ağır xəstələrə köçürmək mümkündürmü? Qana 2,3-BPG əlavə etməklə qırmızı qan hüceyrələrinin funksiyalarını bərpa etmək mümkündürmü?
5. Ən sadə immunoqlobulin molekullarının quruluşunu xatırlayın. İmmunoglobulinlər immunitet sistemində hansı rol oynayır? Niyə Igs çox vaxt bivalent adlanır? İglərin quruluşu onların funksiyası ilə necə əlaqəlidir? (İmmunoqlobulinlər sinfinin nümunəsindən istifadə edərək təsvir edin.)
Zülalların fiziki-kimyəvi xassələri və onların ayrılması üsulları.
6. Zülalın xalis yükü onun həllinə necə təsir edir?
a) pH 7-də peptidin ümumi yükünü təyin edin
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) pH >7, pH-da bu peptidin yükü necə dəyişəcək<7, рН <<7?
c) zülalın (İEP) izoelektrik nöqtəsi nədir və o, hansı mühitdə yerləşir?
Bu peptidin IET?
d) bu peptidin ən az həllolma qabiliyyəti hansı pH dəyərində müşahidə olunacaq.
7. Niyə turş süd təzə süddən fərqli olaraq qaynadılan zaman “qıvrılır” (yəni süd zülalı kazeini çökür)? Təzə süddə kazein molekulları mənfi yükə malikdir.
8. Gel filtrasiyası fərdi zülalları ayırmaq üçün istifadə olunur. Molekulyar çəkisi müvafiq olaraq 160.000, 80.000 və 60.000-ə bərabər olan A, B, C zülallarından ibarət qarışıq gel filtrasiyası ilə təhlil edilmişdir (şək. 1.35). Şişmiş gel qranulları molekulyar çəkisi 70.000-dən az olan zülallara keçiricidir.Bu ayırma metodunun əsasında hansı prinsip dayanır? Hansı qrafik fraksiyaların nəticələrini düzgün əks etdirir? A, B və C zülallarının sütundan çıxma ardıcıllığını göstərin.
 düyü. 1.35. Zülalların ayrılması üçün gel filtrasiyasından istifadə
düyü. 1.35. Zülalların ayrılması üçün gel filtrasiyasından istifadə
9. Şəkildə. 1.36, A sağlam bir insanın qan serum zülallarının kağız üzərində elektroforez diaqramını göstərir. Bu üsulla əldə edilən zülal fraksiyalarının nisbi miqdarı bunlardır: albuminlər 54-58%, α1-qlobulinlər 6-7%, α2-qlobulinlər 8-9%, β-qlobulinlər 13%, γ-qlobulinlər 11-12% .
 düyü. 1.36 Sağlam bir insanın (A) və xəstənin (B) qan plazma zülallarının kağız üzərində elektroforezi
düyü. 1.36 Sağlam bir insanın (A) və xəstənin (B) qan plazma zülallarının kağız üzərində elektroforezi
I - γ-qlobulinlər; II - β-qlobulinlər; III -α 2 - qlobulin; IV -α 2 - qlobulin; V - albuminlər
Bir çox xəstəliklər serum zülallarının tərkibində kəmiyyət dəyişiklikləri (disproteinemiya) ilə müşayiət olunur. Diaqnoz qoyularkən və xəstəliyin şiddətini və mərhələsini qiymətləndirərkən bu dəyişikliklərin xarakteri nəzərə alınır.
Cədvəldə verilmiş məlumatlardan istifadə etməklə. 1.5, Şəkildə göstərilən elektroforetik profil ilə xarakterizə olunan xəstəlik haqqında bir təxmin edin. 1.36.
Cədvəl 1.5. Patologiyada serum zülallarının konsentrasiyasında dəyişikliklər
Mövzu: TRANSMEMBRAN TRANSFERİ
Hüceyrədaxili reseptorlar: https://www.youtube.com/watch?v=Nm9u4lNCPyM
İkinci mesaj sistemi ilə əlaqəli metabotropik membran reseptorları: https://www.youtube.com/watch?v=dQ4yVuLAbH0
Tirozin kinaz fəaliyyəti ilə əlaqəli metabotropik membran reseptorları:
Transmembran nəqlinin növləri.
Transmembran nəqliyyat kanallarının növləri.
Qütblü və qeyri-qütblü maddələr haqqında anlayış.
Transmembran seçici keçiriciliyi hüceyrə homeostazını, hüceyrədəki ionların, suyun, fermentlərin və substratların optimal tərkibini saxlayır. Selektiv membran keçiriciliyinin həyata keçirilməsi yolları: passiv nəqliyyat, katalizləşdirilmiş nəqliyyat (asanlaşdırılmış diffuziya), aktiv nəqliyyat. İki qatlı nüvənin hidrofobik təbiəti, fizikokimyəvi nöqteyi-nəzərdən müxtəlif maddələrin (ilk növbədə qütblü və qeyri-qütblü) membran vasitəsilə birbaşa nüfuz etmə imkanını (və ya qeyri-mümkünlüyünü) müəyyənləşdirir.
Qütb olmayan maddələr(məsələn, xolesterol və onun törəmələri) bioloji membranlara sərbəst şəkildə nüfuz edir. Bu səbəbdən qütb birləşmələrinin (məsələn, peptid hormonlarının) endositoz və ekzositozu membran veziküllərinin köməyi ilə, steroid hormonların ifrazı isə belə veziküllərin iştirakı olmadan baş verir. Eyni səbəbdən, qeyri-qütblü molekullar üçün reseptorlar (məsələn, steroid hormonları) hüceyrənin içərisində yerləşir.
Qütb maddələr(məsələn, zülallar və ionlar) bioloji membranlara nüfuz edə bilməz. Buna görə də qütb molekulları üçün reseptorlar (məsələn, peptid hormonları) plazma membranında qurulur və ikinci xəbərçilər digər hüceyrə bölmələrinə siqnal ötürülməsini həyata keçirirlər. Eyni səbəbdən, qütb birləşmələrinin transmembran ötürülməsi bioloji membranlara quraşdırılmış xüsusi sistemlər tərəfindən həyata keçirilir.
Seçici keçiricilik hüceyrə membranı tərəfindən təmin edilir; Reseptor funksiyası karbohidrat hissələri qlikokaliksdə yerləşən qlikoproteinlər tərəfindən həyata keçirilir; forma saxlanması və hərəkətliliyi submembran təbəqəsində fibrilyar və boru zülalları tərəfindən təmin edilir və s.
Reseptor və liqand anlayışı
Hüceyrə reseptoru- hüceyrənin, nüvənin, hüceyrə orqanoidlərinin səthində və ya sitoplazmada həll olunan bir molekul. Hüceyrə reseptoru, müəyyən bir kimyəvi maddənin molekulunun ona bağlanmasına məkan konfiqurasiyasını (formasını) dəyişdirərək xüsusi reaksiya verir - liqand, xarici tənzimləyici siqnalın ötürülməsi. Bu da öz növbəsində bu siqnalı hüceyrəyə və ya hüceyrə orqanoidinə ötürür. Reseptorun bağlandığı yer liqand sayt adlanır. Eyni reseptorda bir neçə yer ola bilər. Hüceyrə reseptorlarını iki əsas sinfə bölmək olar: membran reseptorları (hüceyrəni xarici mühitdən ayıran membranda yerləşir) və hüceyrədaxili reseptorlar.
Bir reseptorla xüsusi olaraq bağlanan bir maddə deyilir liqand (messenger tərəfindən) bu reseptor. Beləliklə, liqand (sinonimi: messencer) reseptorla qarşılıqlı təsir göstərə bilən kimyəvi maddədir. Bu qarşılıqlı əlaqənin nəticəsi fərqli ola bilər. Əgər ligand (xəbərçi) forma dəyişikliyinə gətirib çıxarırsa reseptor və onun aktivləşdirilməsi agonist adlanır . Əgər liqand (messencer) reseptorun formasını (konformasiyasını) dəyişdirirsə və bu reseptoru bloklayır ona antaqonist deyilir.
Hisslərə gəldikdə, liqandlar (xəbərçilər) qoxu və ya dad reseptorlarına təsir edən maddələrdir.
Membran potensialındakı dəyişikliklərə cavab verən termosensitiv reseptor zülalları və reseptor zülalları da var.
Suda həll olunan ligandlar (messencerlər) üçün reseptorlar - protein hormonları, adrenalin, norepinefrin - membranın səthində yerləşir (membran reseptorları), bu, hidrofilik liqandların membranın hidrofobik səthindən keçə bilməməsi ilə əlaqədardır. Yağda həll olunan liqandlar (xəbərçilər) hüceyrə membranının və nüvənin fosfolipid iki qatından asanlıqla keçir və buna görə də hüceyrə içərisində onlar üçün reseptorlar (hüceyrədaxili reseptorlar) yerləşdirir: orqanoidlərdə, nüvədə. Yağda həll olunan ligandlara misal olaraq adrenal bezlərin və cinsi vəzilərin steroid hormonları ola bilər.
Bundan əlavə, liqandlar ayrıla bilər ekzogenə(kənardan gələn) və endogen(bədən daxilində əmələ gəlir). Bir qayda olaraq, bəzi ekzogen maddənin hüceyrələrdə reseptorları varsa, o zaman orqanizmdə də bu reseptor üçün endogen liqandlar olur. Məsələn, sirr alkaloidlərinin bağlandığı kannabinoid reseptorlarının endogen liqandı orqanizm tərəfindən araxidon yağ turşusundan istehsal olunan anandamid maddəsidir. Və ya endorfin reseptorları (ağrı və emosional vəziyyətin formalaşmasında mühüm rol oynayır): endogen liqandlarla - endorfinlərlə əlaqə qura bilər və ya morfin qrupunun dərmanları ilə bağlana bilər.
Zülalın liqandla bağlanmasının yüksək spesifikliyi zülalın aktiv mərkəzinin strukturunun liqandın strukturunu tamamlaması ilə təmin edilir.
Tamamlayıcılıq qarşılıqlı təsir göstərən molekulların məkan və kimyəvi uyğunluğuna aiddir. Liqand aktiv sahənin konformasiyasına daxil olmaq və məkan baxımından üst-üstə düşmə qabiliyyətinə malik olmalıdır. Bu təsadüf tam olmaya bilər, lakin zülalın konformasiya labilliyinə görə aktiv mərkəz kiçik dəyişikliklərə qadirdir və liqandla “tənzimlənir”. Bundan əlavə, liqandın funksional qrupları ilə aktiv mərkəzi meydana gətirən amin turşusu radikalları arasında liqandı aktiv mərkəzdə saxlayan bağlar yaranmalıdır. Liqand ilə zülalın aktiv mərkəzi arasındakı bağlar kovalent olmayan (ion, hidrogen, hidrofobik) və ya kovalent ola bilər.
1. Aktiv saytın xüsusiyyətləri
Zülalın aktiv mərkəzi zülalı əhatə edən mühitdən nisbətən təcrid olunmuş, amin turşusu qalıqlarından əmələ gələn bölgədir. Bu bölgədə hər bir qalıq fərdi ölçüsünə və funksional qruplarına görə aktiv mərkəzin “relyefini” təşkil edir.
Belə amin turşularının vahid funksional kompleksdə birləşməsi onların radikallarının reaktivliyini dəyişir, necə ki, ansamblda musiqi alətinin səsi dəyişir. Buna görə də, aktiv mərkəzi təşkil edən amin turşusu qalıqlarına çox vaxt amin turşularının “ansamblı” deyilir.
Aktiv mərkəzin unikal xüsusiyyətləri təkcə onu əmələ gətirən amin turşularının kimyəvi xassələrindən deyil, həm də onların kosmosda dəqiq nisbi oriyentasiyasından asılıdır. Buna görə də, zülalın ilkin strukturunda və ya ətraf mühit şəraitində nöqtə dəyişiklikləri nəticəsində onun ümumi konformasiyasında cüzi pozuntular belə aktiv mərkəzi təşkil edən radikalların kimyəvi və funksional xassələrinin dəyişməsinə, zülalın bağlanmasını poza bilər. liqand və onun funksiyası. Denatürasiya zamanı zülalların aktiv mərkəzi məhv olur və onların bioloji aktivliyi itir.
Tez-tez aktiv mərkəz elə bir şəkildə formalaşır ki, suyun onun radikallarının funksional qruplarına çıxışı məhduddur, yəni. liqandın amin turşusu radikallarına bağlanması üçün şərait yaradılır.
Bəzi hallarda, ligand müəyyən reaktivliyə malik olan atomlardan yalnız birinə, məsələn, miyoqlobinin və ya hemoglobinin dəmirinə O 2 əlavə edilməsinə bağlanır. Bununla belə, müəyyən bir atomun O2 ilə seçmə qarşılıqlı əlaqəsi xüsusiyyətləri tərkibindəki dəmir atomunu əhatə edən radikalların xüsusiyyətləri ilə müəyyən edilir. Heme digər zülallarda, məsələn, sitoxromlarda da olur. Bununla belə, sitoxromlarda dəmir atomunun funksiyası fərqlidir, o, elektronların bir maddədən digərinə ötürülməsi üçün vasitəçi kimi xidmət edir, dəmir isə iki və ya üçvalent olur.
Zülalların funksiyalarının əsasını təşkil edən əsas xassə, zülal molekulunun müəyyən hissələrinə xüsusi liqandların bağlanmasının seçiciliyidir.
2. Liqandların müxtəlifliyi
Liqandlar qeyri-üzvi (tez-tez metal ionları) və üzvi maddələr, aşağı molekulyar çəki və yüksək molekulyar ağırlıqlı maddələr ola bilər;
bir zülalın aktiv yerinə bağlandıqda kimyəvi quruluşunu dəyişən liqandlar var (fermentin aktiv yerində substratın dəyişməsi);
zülala yalnız fəaliyyət göstərdiyi zaman bağlanan liqandlar (məsələn, hemoglobin tərəfindən daşınan O 2) və zülalla daim əlaqəli olan və zülalların fəaliyyətində köməkçi rol oynayan liqandlar (məsələn, dəmir, hemoglobinin bir hissəsidir).
Aktiv mərkəzi meydana gətirən amin turşusu qalıqları müəyyən bir zülalın işləməsini təmin edə bilmədiyi hallarda, zülal olmayan molekullar aktiv mərkəzin müəyyən sahələrinə yapışa bilər. Beləliklə, bir çox fermentlərin aktiv mərkəzində metal ionu (kofaktor) və ya üzvi qeyri-zülal molekulu (koenzim) var. Zülalın aktiv mərkəzi ilə möhkəm bağlı olan və onun işləməsi üçün zəruri olan qeyri-zülal hissəsi “prostat qrupu” adlanır. Mioqlobin, hemoglobin və sitoxromlar aktiv mərkəzdə protez qrupa malikdir - heme, tərkibində dəmir.
Oliqomerik zülalda protomerlərin əlaqəsi yüksək molekulyar ağırlıqlı liqandların qarşılıqlı təsirinə misaldır. Digər protomerlərlə əlaqəli hər bir protomer, onlar üçün olduğu kimi, onlar üçün də bir ligand rolunu oynayır.
Bəzən liqandın birləşməsi zülalın konformasiyasını dəyişir, nəticədə digər liqandlarla bağlanma yeri əmələ gəlir. Məsələn, kalmodulin zülalı, xüsusi bölgələrdə dörd Ca 2+ ionu ilə bağlandıqdan sonra, onların aktivliyini dəyişdirərək, müəyyən fermentlərlə qarşılıqlı əlaqədə olmaq qabiliyyəti əldə edir.
8. Zülalların dördüncü quruluşu. Hemoqlobin nümunəsindən istifadə edərək oliqomerik zülalların quruluşu və fəaliyyətinin xüsusiyyətləri. Protomer konformasiyasında kooperativ dəyişikliklər. Oliqomer zülalların bioloji funksiyasının allosterik liqandlarla tənzimlənməsinin mümkünlüyü.
Dördüncü quruluş dedikdə, eyni (və ya fərqli) ibtidai, ikincili və ya üçüncü quruluşa malik olan ayrı-ayrı polipeptid zəncirlərinin kosmosda salınması və struktur və funksional olaraq vahid makromolekulyar formasiyanın əmələ gəlməsi üsulu başa düşülür. Bir çox funksional zülallar kovalent bağlarla deyil, qeyri-kovalent bağlarla (üçüncü quruluşun sabitliyini təmin edənlərə bənzər) birləşən bir neçə polipeptid zəncirindən ibarətdir. Protomer, monomer və ya subunit adlanan hər bir fərdi polipeptid zəncirinin çox vaxt bioloji aktivliyi yoxdur. Zülal bu qabiliyyəti onun tərkib protomerlərinin məkan birləşməsinin müəyyən bir üsulu ilə əldə edir, yəni. monomerik zülal üçün xarakterik olmayan yeni keyfiyyət yaranır. Yaranan molekul adətən oliqomer (və ya multimer) adlanır. Oliqomerik zülallar çox vaxt eyni və ya fərqli molekulyar çəkiləri olan bərabər sayda protomerlərdən (2-dən 4-ə qədər, daha az tez-tez 6-dan 8-ə qədər) qurulur - bir neçə mindən yüz minlərlə. Xüsusilə, hemoglobin molekulu iki eyni α- və iki β-polipeptid zəncirindən ibarətdir, yəni. tetramerdir.
Protomer konformasiyasında kooperativ dəyişikliklər.
Oliqomer zülalın bütün protomerlərinin konformasiyasında və buna görə də funksional xassələrində liqand yalnız birinə bağlandıqda protomerlərin konformasiyasında kooperativ dəyişikliklər adlanır.
Allosterik tənzimləmə . Ferment öz fəaliyyətini ona kovalent bağlı olmayan effektorun köməyi ilə modulyasiya edir. Bağlama aktiv (katalitik) mərkəzdən fəza baxımından uzaq bir yerdə baş verir. Bu bağlanma zülal molekulunda konformasiya dəyişikliklərinə səbəb olur və katalitik mərkəzin xüsusi həndəsəsinin dəyişməsinə səbəb olur. Fəaliyyət arta bilər - bu, fermentin aktivləşməsi və ya azalmasıdır - bu inhibədir. Allosterik aktivatorun əlavə edilməsi ilə bağlı "mesaj" substratı tamamlayan katalitik alt bölməyə konformasiya dəyişiklikləri yolu ilə ötürülür və ferment " açılır”. Aktivator çıxarıldıqda, ferment yenidən qeyri-aktiv formaya keçir və "sönür". Allosterik tənzimləmə metabolik yolların tənzimlənməsinin əsas yoludur.
Bioloji kimya Lelevich Vladimir Valeryanoviç
Zülalların işləməsi
Zülalların işləməsi
Özünəməxsus ilkin quruluşa və konformasiyaya malik olan hər bir fərdi zülalın həm də onu bütün digər zülallardan fərqləndirən özünəməxsus funksiyası vardır. Fərdi zülallar toplusu hüceyrədə çox müxtəlif və mürəkkəb funksiyaları yerinə yetirir.
Zülalların işləməsi üçün zəruri şərt ona liqand adlanan başqa bir maddənin əlavə edilməsidir. Liqandlar həm aşağı molekulyar ağırlıqlı maddələr, həm də makromolekullar ola bilər. Zülalın liqandla qarşılıqlı əlaqəsi yüksək spesifikdir, bu, zülalın zülal-liqand bağlama yeri və ya aktiv mərkəz adlanan bölgəsinin strukturu ilə müəyyən edilir.
Zülalların aktiv yeri və onun liqandla bağlanmasının seçiciliyi
Zülalların aktiv mərkəzi zülal molekulunun müəyyən bir bölgəsidir, adətən onun girintisində yerləşir, üçüncü quruluşun formalaşması zamanı müəyyən bir məkan bölgəsində yığılmış amin turşusu radikalları tərəfindən əmələ gəlir və liqandla tamamlayıcı şəkildə bağlana bilir. Polipeptid zəncirinin xətti ardıcıllığında aktiv mərkəzi təşkil edən radikallar bir-birindən xeyli məsafədə yerləşə bilər.
Zülalın liqandla bağlanmasının yüksək spesifikliyi zülalın aktiv mərkəzinin strukturunun və liqandın strukturunun komplementarlığı ilə təmin edilir.
Tamamlayıcılıq qarşılıqlı təsir göstərən molekulların məkan və kimyəvi uyğunluğuna aiddir. Liqand aktiv sahənin konformasiyasına daxil olmaq və məkan baxımından üst-üstə düşmə qabiliyyətinə malik olmalıdır. Bu uyğunluq tam olmaya bilər, lakin zülalın konformasiya labilliyinə görə aktiv sahə kiçik dəyişikliklərə qadirdir və liqandla "tənzimlənir". Bundan əlavə, liqandın funksional qrupları ilə aktiv mərkəzi meydana gətirən amin turşusu radikalları arasında liqandı aktiv mərkəzdə saxlayan bağlar yaranmalıdır. Liqand ilə zülalın aktiv mərkəzi arasındakı bağlar kovalent olmayan (ion, hidrogen, hidrofobik) və ya kovalent ola bilər.
Fəal mərkəzin xüsusiyyətləri
Zülalın aktiv mərkəzi zülalı əhatə edən mühitdən nisbətən təcrid olunmuş, amin turşusu qalıqlarından əmələ gələn bölgədir. Bu bölgədə hər bir qalıq fərdi ölçüsünə və funksional qruplarına görə aktiv mərkəzin “relyefini” təşkil edir.
Aktiv mərkəzin unikal xüsusiyyətləri təkcə onu əmələ gətirən amin turşularının kimyəvi xassələrindən deyil, həm də onların kosmosda dəqiq nisbi oriyentasiyasından asılıdır. Buna görə də, zülalın ilkin strukturunda və ya ətraf mühit şəraitində nöqtə dəyişiklikləri nəticəsində onun ümumi konformasiyasında cüzi pozuntular belə aktiv mərkəzi təşkil edən radikalların kimyəvi və funksional xassələrinin dəyişməsinə, zülalın bağlanmasını poza bilər. liqand və onun funksiyası. Denatürasiya zamanı zülalların aktiv mərkəzi məhv olur və onların bioloji aktivliyi itir.
Tez-tez aktiv mərkəz elə bir şəkildə formalaşır ki, suyun onun radikallarının funksional qruplarına çıxışı məhduddur, yəni. liqandın amin turşusu radikallarına bağlanması üçün şərait yaradılır.
Protein-liqand bağlama yeri çox vaxt domenlər arasında yerləşir. Məsələn, bağırsaqda qida zülallarının peptid bağlarının hidrolizində iştirak edən tripsin proteolitik fermenti yivlə ayrılmış 2 sahəyə malikdir. Oluğun daxili səthi polipeptid zəncirində (Ser177, His40, Asp85) bir-birindən uzaqda yerləşən bu domenlərin amin turşusu radikallarından əmələ gəlir.
Zülaldakı müxtəlif domenlər bir liqandla qarşılıqlı əlaqədə olduqda bir-birinə nisbətən hərəkət edə bilər ki, bu da zülalın sonrakı fəaliyyətini asanlaşdırır. Zülalların funksiyalarının əsasını təşkil edən əsas xassə, zülal molekulunun müəyyən hissələrinə xüsusi liqandların bağlanmasının seçiciliyidir.
Müxtəlif liqandlar:
1. Liqandlar qeyri-üzvi (çox vaxt metal ionları) və üzvi maddələr, aşağı molekulyar və yüksək molekullu maddələr ola bilər;
2. zülalın aktiv mərkəzinə bağlandıqda kimyəvi quruluşunu dəyişən liqandlar var (fermentin aktiv mərkəzində substratın dəyişməsi);
3. Zülala yalnız fəaliyyət göstərdiyi zaman bağlanan (məsələn, hemoglobinlə daşınan O 2) və zülalla daim bağlı olan və zülalların fəaliyyətində köməkçi rol oynayan liqandlar (məsələn, hemoglobinin bir hissəsi olan dəmir).
İtlərin çoxalması kitabından müəllif Kovalenko Elena EvgenievnaReproduktiv sistemin fəaliyyəti Reproduktiv sistemin fəaliyyəti hormonlar - yüksək bioloji aktivliyə və təsir seçiciliyinə malik protein maddələri ilə tənzimlənir. Orqanlar arasında humoral əlaqəni təmin edən hormonların bu xüsusiyyətləri,
Yaş anatomiyası və fiziologiyası kitabından müəllif Antonova Olqa Aleksandrovna4.5. Onurğa beyninin quruluşu və fəaliyyəti Onurğa beyni uzunluğu təqribən 45 sm olan uzun kordondur (böyüklərdə).Yuxarıda uzunsov medullaya, aşağı hissəsində (I–II bel fəqərələrinin nahiyəsində) onurğa beyni daralır və konus formasına malikdir,
Biologiya kitabından [Vahid Dövlət İmtahanına hazırlaşmaq üçün tam məlumat kitabı] müəllif Lerner Georgi İsaakoviç4.6. Beynin quruluşu və fəaliyyəti
“İtkin Halqa” kitabından Edie Maitland tərəfindən Həyat haqqında söhbətlər kitabından müəllif Qalaktionov Stanislav GennadieviçAilə ağacı (zülalların sübutu) Ailə ağacı (zülalların sübutu) İki növün zülallarındakı fərqlər bu növlərin ümumi əcdaddan ayrıldıqdan sonra təkamül dəyişikliklərini əks etdirir. Analiz şimpanze qan serum albuminlər arasında olduğunu göstərir
Təkamül kitabından [Yeni kəşflər işığında klassik fikirlər] müəllifFəsil 2. Zülalların molekulyar arxitekturası Gizlətməyək: birinci fəsli bitirdikdən sonra müəlliflər (və bəlkə də oxucu) bir qədər rahatladılar. Axı, onun məqsədi yalnız oxucuya sonrakı fəsilləri başa düşmək üçün lazım olan məlumatları vermək idi,
İnsan Təkamülü kitabından. Kitab 1. Meymunlar, sümüklər və genlər müəllif Markov Aleksandr VladimiroviçQədim zülallar kainatı genişlənməkdə davam edir 2010-cu ildə “Nature” jurnalı fitnes landşaftlarında zülalların təkamül hərəkəti haqqında maraqlı bir məqalə dərc etdi (Povolotskaya, Kondrashov, 2010). Əsərin müəllifləri 572 qədim zülalın amin turşusu ardıcıllığını müqayisə etmək qərarına gəliblər.
Bioloji Kimya kitabından müəllif Leleviç Vladimir ValeryanoviçZülal dəyişiklikləri Genomun zülalları kodlayan hissələri təəccüblü dərəcədə az dəyişmişdir. İnsanlar və şimpanzelər arasında zülalların amin turşusu ardıcıllığında fərqlər əhəmiyyətli dərəcədə 1%-dən azdır və hətta bu bir neçə fərqin əksəriyyətində heç bir fərq yoxdur.
Müəllifin kitabındanFəsil 2. Zülalların quruluşu və funksiyaları Zülallar yüksək molekulyar azot tərkibli üzvi birləşmələrdir, peptid bağlarından istifadə edərək polipeptid zəncirlərinə bağlanmış amin turşularından ibarət olan və mürəkkəb struktur təşkilatı olan zülalların tədqiqi tarixi 1728-ci ildə
Müəllifin kitabındanZülalların struktur təşkili səviyyələri İlkin struktur polipeptid zəncirində amin turşularının ciddi şəkildə müəyyən edilmiş xətti ardıcıllığıdır.Zülalların ilkin strukturunun öyrənilməsinin strateji prinsipləri inkişaf və inkişaf kimi əhəmiyyətli dəyişikliklərə məruz qalmışdır.
Müəllifin kitabındanZülallarda post-translational dəyişikliklər Bir çox zülallar qeyri-aktiv formada (prekursorlar) sintez olunur və ribosomlarla konvergensiyadan sonra postsintetik struktur dəyişikliklərinə məruz qalır. Polipeptid zəncirlərində bu konformasyonel və struktur dəyişiklikləri alındı
Müəllifin kitabındanFəsil 23. Amin turşularının mübadiləsi. Orqanizm zülallarının dinamik vəziyyəti Amin turşularının orqanizm üçün əhəmiyyəti ilk növbədə ondan ibarətdir ki, onlar zülalların sintezi üçün istifadə olunur, onların metabolizmi orqanizmlə orqanizm arasında gedən metabolik proseslərdə xüsusi yer tutur.
Müəllifin kitabındanMədə-bağırsaq traktında zülalların həzm edilməsi Zülalların həzmi mədə şirəsində fermentlərin təsiri altında mədədə başlayır. Gündə 2,5 litrə qədər ifraz olunur və mövcudluğuna görə yüksək turşuluq reaksiyası ilə digər həzm şirələrindən fərqlənir.
Müəllifin kitabındanDokularda zülalların parçalanması proteolitik lizosomal fermentlərin katepsinlərindən istifadə etməklə həyata keçirilir. Aktiv mərkəzin quruluşuna əsasən sistein, serin, karboksil və metalloprotein katepsinləri fərqləndirilir. Katepsinlərin rolu: 1. bioloji aktivlərin yaradılması
Müəllifin kitabındanAmin turşularının və zülalların mübadiləsində qaraciyərin rolu Qaraciyər zülalların və digər azot tərkibli birləşmələrin mübadiləsində mərkəzi rol oynayır. O, aşağıdakı funksiyaları yerinə yetirir: 1. spesifik plazma zülallarının sintezi: - qaraciyərdə sintez olunur: 100% albuminlər, 75-90% β-qlobulinlər, 50%
Müəllifin kitabındanQan zərdabının zülallarının xüsusiyyətləri Komplement sisteminin zülalları - bu sistemə qanda aktiv olmayan prekursorlar şəklində dövr edən 20 zülal daxildir. Onların aktivləşməsi proteolitik aktivliyi olan xüsusi maddələrin təsiri altında baş verir.
· 1 Qeyri-üzvi kimya üzrə
o 1.1 Liqand nomenklaturası
o 1.2 Liqandların xarakteristikası
§ 1.2.1 Elektron quruluş
§ 1.2.2 Stomatologiya
§ 1.2.3 Koordinasiya üsulları
· 2 Qeyd
Qeyri-üzvi kimyada
Çox vaxt bu cür bağlanma "koordinasiya" donor-akseptor bağının meydana gəlməsi ilə baş verir, burada liqandlar Lyuis əsasları kimi çıxış edir, yəni elektron cütünün donorlarıdır. Liqandlar mərkəzi atoma bağlandıqda, kompleksləşdirici agentin kimyəvi xassələri və liqandların özləri çox vaxt əhəmiyyətli dəyişikliklərə məruz qalır.
Liqand nomenklaturası[redaktə | wiki mətnini redaktə et]
1. nominativ halda birləşmənin ilk adı anion, sonra isə cinsiyyət halında kation olur.
2. kompleks ionun adı əlifba sırası ilə əvvəlcə liqandları, sonra isə mərkəzi atomu sadalayır
3. Neytral kationik komplekslərdə mərkəzi atom rus adı ilə, anionlarda isə latın adının kökü ilə “at” şəkilçisi ilə çağırılır. Mərkəzi atomun adından sonra oksidləşmə vəziyyəti göstərilir.
4. mərkəzi atoma birləşən liqandların sayı “mono”, “di”, “tri”, “tetra”, “penta” və s. prefikslərlə göstərilir.
Liqandların xüsusiyyətləri[redaktə | wiki mətnini redaktə et]
Elektron quruluş[redaktə | wiki mətnini redaktə et]
Əslində, bir ligandın komplekslər yaratmaq və D-orbitalını özünü məhv etmək qabiliyyətini qiymətləndirməyə və proqnozlaşdırmağa imkan verən ən vacib xüsusiyyət - bütövlükdə birləşmənin məhv edilməsi. Birinci təxminə görə, bu, liqandın koordinasiya bağları yaratmaq üçün ayıra bildiyi elektron cütlərinin sayını və bağışlayan atomun və ya funksional qrupun elektronmənfiliyini ehtiva edir.
Dişçilik[redaktə | wiki mətnini redaktə et]
Mərkəzi atomun (və ya atomların) liqandın tutduğu koordinasiya yerlərinin sayı dentatasiya adlanır (lat. çuxur, diş- - diş). Eyni koordinasiya sahəsini tutan ligandlar deyilir mono dişli (məsələn, N H 3), iki - bi dişli (oksalat anionu) O-C(=O)-C(=O) -O] 2−). Daha çox sayda sayt tuta bilən ligandlar adətən olaraq təyin olunur poli dişli. Məsələn, altı koordinasiya yerini tuta bilən etilendiamintetraasetik turşu (EDTA).
Dentasiya ilə yanaşı, mərkəzi atomun bir koordinasiya sahəsi ilə əlaqəli liqand atomlarının sayını əks etdirən bir xüsusiyyət var. İngilis ədəbiyyatında sözü ilə işarələnir hapticity və müvafiq yuxarı işarə ilə η nomenklatura təyinatına malikdir. Göründüyü kimi, onun rus dilində müəyyən edilmiş termini olmasa da, bəzi mənbələrdə “haptnost” izləmə kağızına rast gəlmək olar. Nümunə olaraq, bir koordinasiya sahəsini tutan (yəni monodentat) və bütün beş karbon atomu ilə birləşən metal mərkəzli komplekslərdə siklopentadienil liqandını göstərə bilərik: η 5 - − .
Koordinasiya üsulları[redaktə | wiki mətnini redaktə et]

Xelat kompleksiEDTA 4−
Dişləri ikidən çox olan ligandlar əmələ gəlmə qabiliyyətinə malikdir xelat kompleksləri(yun. χηλή - caynaq) - mərkəzi atomun liqand molekulu ilə bir və ya bir neçə dövrəyə daxil olduğu komplekslər. Belə liqandlar deyilir chelating. Nümunə olaraq, eyni EDTA-nın tetraanion komplekslərini göstərə bilərik, qeyd edək ki, onun tərkibindəki dörd M-O bağından bir neçəsi formal olaraq ola bilər. ion.
Xelat kompleksləri əmələ gəldikdə tez-tez müşahidə olunur xelasiya effekti- xelatlaşdırıcı olmayan ligandların oxşar kompleksləri ilə müqayisədə onların daha böyük sabitliyi. Bu, mərkəzi atomun əvəzedici təsirlərdən və entropiya effektindən daha çox qorunması sayəsində əldə edilir. Məsələn, kadmium 2+ ammiak kompleksinin dissosiasiya sabiti etilendiamin 2+ ilə kompleksdən demək olar ki, 1500 dəfə azdır. Bunun səbəbi odur ki, hidratlı kadmium (II) ionu etilendiaminlə reaksiyaya girdikdə, iki liqand molekulu dörd su molekulunu sıxışdırır. Bu zaman sistemdə sərbəst hissəciklərin sayı əhəmiyyətli dərəcədə artır və sistemin entropiyası artır (və buna uyğun olaraq kompleksin daxili nizamı da artır). Yəni xelat effektinin səbəbi monodentatlı liqandlar polidentatlarla əvəz olunduqda sistemin entropiyasının artması və nəticədə Gibbs enerjisinin azalmasıdır.

Porfirin dövrü
Xelatlaşdırıcı liqandlar arasında makrosiklik liqandlar sinfini ayırmaq olar - kompleksləşən atomu yerləşdirmək üçün kifayət qədər intrasiklik boşluğa malik molekullar. Belə birləşmələrə misal olaraq porfirin əsasları - hemoglobin, xlorofil və bakterioklorofil kimi ən mühüm biokimyəvi komplekslərin əsasını göstərmək olar. Makrosiklik liqandlar kimi tac efirləri, kalixarenlər və s.
Liqandlar həmçinin iki və ya çoxnüvəli komplekslərdə müxtəlif mərkəzi atomlar arasında əlaqə yaradaraq körpü yarada bilər. Körpü liqandları yunan hərfi ilə təyin olunur μ ( mu).
LİQANDLAR
ABVGDEZHZIKLMNOPRSTUFHTSCHSHSHYUYA
LİQANDLAR(Latın ligo-dan - bağlayıram), neytral molekullar, ionlar və ya mərkəzlə əlaqəli radikallar. mürəkkəb birləşmənin atomu. Onlar ola bilər. ionları (H - , Hal - , NO 3 - , NCS - s.), inorg. molekulları (H 2, C n, N 2, P n, O 2, Sn, CO, CO 2, NH 3, NO, SO 2, NO 2, COS və s.), org. V, VI, VII əsas yarımqrupların elementlərini ehtiva edən birləşmələr gr. dövri sistemləri və ya p-donor funksiyası. Böyük bir qrup liqandlar - bioloji əhəmiyyətli birləşmələr. (amin turşuları, peptidlər, zülallar, purinlər, porfirinlər, korrinlər, makrolidlər) və onların sintetikləri. analoqlar (tac efirləri, kriptondlar), həmçinin donor atomları və xelat qrupları olan polimerlər. Liqandlar mərkəzi atoma s-, p- və d-bicenter və ya çoxmərkəzli bağlarla bağlana bilər. Liqandlarda iki mərkəzli bağların əmələ gəlməsi vəziyyətində donor mərkəzləri müəyyən edilə bilər (adətən N, O, S, Cl atomları və ya çoxlu bağlar). Çoxmərkəzli bağlama aromatik p-sisteminə görə həyata keçirilir. liqandlar (benzol, siklopentadienid anion) və ya heteroaromatik. liqandlar (pirol, tiofen, metilpiridinlər). Ən vacib miqdar. liqandların donor-akseptor qabiliyyətinin səciyyəvi - koordinasiyada iştirak edən liqandların donor mərkəzlərinin sayı ilə müəyyən edilən dişləşmə. Bu xüsusiyyətə əsasən liqandlar mono-, di-, ... polidentatlılara bölünür. Koord. monodentatlı liqandlar üçün kompleksləşdiricilərin sayı onların sayı ilə üst-üstə düşür, digərləri üçün bu, liqandların sayının və onların dişliliyinin hasilinə bərabərdir. Liqandların təbiəti koordinasiya növlərini müəyyən edir. əlaqə. (akvakomplekslər, amin kompleksləri, turşu kompleksləri, mol. əlavələr, xelatlar, p-komplekslər və s.); xassələri, quruluşu və reaksiyası ondan asılıdır. mürəkkəb əlaqə qurma qabiliyyəti və onların praktiki imkanları tətbiqlər.
Liqand kompleks zülalların vacib komponentidir
Mürəkkəb zülallar, zülal zəncirinə əlavə olaraq, əlavə bir protein olmayan qrupa malikdir - liqand(lat. liqo- bağlama), yəni bir zülalla əlaqəli bir molekul. Əgər ligand struktur və/və ya funksional yük daşıyırsa, ona deyilir protez qrupu.
Bir liqand kimi hər hansı bir molekul hərəkət edə bilər:
proteində fəaliyyət göstərən molekullar struktur funksiyası - lipidlər, karbohidratlar, nuklein turşuları, mineral elementlər, hər hansı digər üzvi birləşmələr: hemoglobində hem, qlikoproteinlərdə karbohidratlar, nukleoproteinlərdə DNT və RNT, seruloplazmində mis,
· portativ zülallar molekullar: transferrində dəmir, haptoqlobində hemoglobin, hemopeksində hem,
· substratlar fermentlər üçün - hər hansı molekullar və hətta digər zülallar.
Liqandların tanınması təmin edilir:
· tamamlayıcılıq zülal bağlama mərkəzinin quruluşu ilə liqandın quruluşu, başqa sözlə, zülal və liqandın məkan və kimyəvi uyğunluğu. Onlar bir kilidin açarı kimi bir-birinə uyğun gəlir, məsələn, ferment və substratın uyğunluğu,
Bəzən tanınma ondan asılı ola bilər reaktivlik ligandın bağlı olduğu atom. Məsələn, hemoglobində oksigenin dəmirə və ya yağ turşusunun albuminə bağlanması.
Liqand funksiyaları mürəkkəb zülalın tərkibi müxtəlifdir:
· xassələrini dəyişir zülallar (yüklənmə, həll olma qabiliyyəti, termolabillik), məsələn, fosfoproteinlərdəki fosfor turşusu və ya qlikoproteinlərdəki monosaxarid qalıqları,
· proteini qoruyur hüceyrənin xaricində və daxilində proteolizdən, məsələn, qlikoproteinlərdəki karbohidrat hissəsi,
· liqand kimi verilir nəqliyyat suda həll olunmayan birləşmələr, məsələn, yağların lipoproteinlərlə daşınması,
· verir bioloji fəaliyyət və zülalın funksiyasını müəyyən edir, məsələn, nukleoproteinlərdə nuklein turşusu, hemoglobində hem, reseptor zülallarında karbohidrat,
· təsir edir membranın nüfuz etməsi, zülalların hüceyrədaxili miqrasiyası, çeşidlənməsi və ifrazı. Bu, adətən, karbohidrat qalıqları tərəfindən edilir.
Başqa nə oxumaq
SON QEYDLƏR
- Trikarboksilik turşu dövrü (Krebs dövrü) Krebs dövrü kilo itkisi
- Bədən tərbiyəsi sosiologiyası nəyi öyrənir?
- Amin turşusu sürəti Bu nədir? Amin turşularının məhdudlaşdırılması. Zülalların bioloji dəyəri anlayışı, amin turşusu hesabı Amin turşusu balının hesablanması
- Bir insanın sehrli qabiliyyətlərə sahib olub olmadığını necə müəyyən etmək olar?
- Psixoloji testlər sizə nə deyir?
