Boltsman sabitinin qiyməti nədir? Boltzman sabiti
Boltzmann Lüdviq (1844-1906)- böyük avstriyalı fiziki, molekulyar kinetik nəzəriyyənin banilərindən biri. Boltzmanın əsərlərində molekulyar kinetik nəzəriyyə ilk dəfə məntiqi ardıcıl, ardıcıl fiziki nəzəriyyə kimi ortaya çıxdı. Boltzmann termodinamikanın ikinci qanununun statistik şərhini verdi. O, Maksvellin elektromaqnit sahəsi nəzəriyyəsini inkişaf etdirmək və populyarlaşdırmaq üçün çox iş görüb. Təbiətcə döyüşçü olan Boltsmann istilik hadisələrinin molekulyar təfsirinə ehtiyacı ehtirasla müdafiə etdi və molekulların varlığını inkar edən alimlərə qarşı mübarizənin ən ağır yükünü çəkdi.
Tənliyə (4.5.3) universal qaz sabitinin nisbəti daxildir R Avoqadro sabitinə N A . Bu nisbət bütün maddələr üçün eynidir. Molekulyar kinetik nəzəriyyənin banilərindən olan L. Boltsmanın şərəfinə Boltsman sabiti adlanır.
Boltzman sabiti:
 (4.5.4)
(4.5.4)
(4.5.3) tənliyi nəzərə alınmaqla Boltzman sabiti belə yazılır:
 (4.5.5)
(4.5.5)
Boltsman sabitinin fiziki mənası
Tarixən temperatur ilk dəfə termodinamik kəmiyyət kimi təqdim edilmiş və onun ölçü vahidi - dərəcələr müəyyən edilmişdir (bax § 3.2). Temperatur və molekulların orta kinetik enerjisi arasında əlaqə qurulduqdan sonra aydın oldu ki, temperatur molekulların orta kinetik enerjisi kimi müəyyən edilə bilər və kəmiyyət əvəzinə joul və ya erq ilə ifadə edilə bilər. T dəyəri daxil edin T* belə ki 
Beləliklə, müəyyən edilmiş temperatur dərəcə ilə ifadə olunan temperatura aşağıdakı kimi aiddir:

Buna görə də Boltsman sabitini enerji vahidləri ilə ifadə olunan temperaturu dərəcə ilə ifadə olunan temperaturla əlaqələndirən kəmiyyət hesab etmək olar.
Qaz təzyiqinin onun molekullarının konsentrasiyasından və temperaturundan asılılığı
ifadə edərək E(4.5.5) münasibətindən və onu (4.4.10) düsturu ilə əvəz edərək, qaz təzyiqinin molekulların konsentrasiyası və temperaturdan asılılığını göstərən ifadəni alırıq:
 (4.5.6)
(4.5.6)
(4.5.6) düsturundan belə nəticə çıxır ki, eyni təzyiq və temperaturda bütün qazlarda molekulların konsentrasiyası eyni olur.
Bu, Avoqadro qanununu nəzərdə tutur: eyni temperatur və təzyiqdə bərabər həcmli qazlar eyni sayda molekul ehtiva edir.
Molekulların translyasiya hərəkətinin orta kinetik enerjisi mütləq temperaturla düz mütənasibdir. Proporsionallıq faktoru- Boltzman sabitik = 10 -23 J/K - xatırlamaq lazımdır.
§ 4.6. Maksvell paylanması
Çox sayda hallarda, təkcə fiziki kəmiyyətlərin orta dəyərlərini bilmək kifayət deyil. Məsələn, insanların orta boyunu bilmək bizə müxtəlif ölçülərdə geyim istehsalını planlaşdırmağa imkan vermir. Hündürlüyü müəyyən bir intervalda olan insanların təxmini sayını bilməlisiniz. Eyni şəkildə, sürətləri orta qiymətdən fərqli olan molekulların sayını bilmək vacibdir. Maksvell ilk dəfə bu rəqəmlərin necə təyin oluna biləcəyini kəşf etdi.
Təsadüfi hadisənin baş vermə ehtimalı
§4.1-də biz artıq qeyd etdik ki, böyük molekullar toplusunun davranışını təsvir etmək üçün C.Maksvel ehtimal anlayışını təqdim etdi.
Dəfələrlə vurğulandığı kimi, böyük bir zaman intervalında bir molekulun sürətinin (və ya impulsunun) dəyişməsini izləmək prinsipcə mümkün deyil. Bütün qaz molekullarının müəyyən bir zamanda sürətlərini dəqiq müəyyən etmək də mümkün deyil. Bir qazın yerləşdiyi makroskopik şəraitdən (müəyyən bir həcm və temperatur) molekulyar sürətlərin müəyyən dəyərləri mütləq izlənmir. Molekulun sürəti təsadüfi bir dəyişən kimi qəbul edilə bilər, verilmiş makroskopik şəraitdə müxtəlif qiymətlər ala bilər, necə ki, zərf atarkən 1-dən 6-a qədər istənilən sayda xal əldə edə bilərsiniz (qövsün tərəflərinin sayı altı). Zər atarkən gələcək xalların sayını proqnozlaşdırmaq mümkün deyil. Ancaq yuvarlanma ehtimalı, məsələn, beş nöqtə müəyyən edilə bilər.
Təsadüfi bir hadisənin baş vermə ehtimalı nədir? Çox istehsal olunsun böyük rəqəm N testlər (N - zarların sayı). Eyni zamanda, in N" hallarda, testlərin əlverişli nəticəsi var idi (yəni, beşi azaltmaq). Onda verilmiş hadisənin baş vermə ehtimalı, əlverişli nəticəyə malik işlərin sayının sınaqların ümumi sayına nisbətinə bərabərdir, bir şərtlə ki, bu sayı istənilən qədərdir:
 (4.6.1)
(4.6.1)
Simmetrik qəlib üçün 1-dən 6-ya qədər hər hansı seçilmiş nöqtə sayının ehtimalı .
Bir çox təsadüfi hadisələrin fonunda müəyyən kəmiyyət qanunauyğunluğunun üzə çıxdığını, rəqəmin meydana çıxdığını görürük. Bu rəqəm - ehtimal - ortalamaları hesablamağa imkan verir. Beləliklə, əgər siz 300 zar atırsanız, onda (4.6.1) düsturundan aşağıdakı kimi beşlərin orta sayı bərabər olacaq: 300 = 50 və eyni zarı 300 və ya 300 dəfə atmağınızın heç bir fərqi yoxdur. eyni zamanda eyni zarlar.
Heç bir şübhə yoxdur ki, qaz molekullarının bir qabdakı davranışı atılan zərin hərəkətindən qat-qat mürəkkəbdir. Ancaq burada da statistik ortalamaları hesablamağa imkan verən müəyyən kəmiyyət qanunauyğunluqlarını kəşf etməyə ümid etmək olar, əgər problem klassik mexanikada olduğu kimi deyil, oyun nəzəriyyəsində olduğu kimi qoyularsa. Müəyyənləşdirmənin həll olunmayan problemindən imtina etmək lazımdır dəqiq qiymət molekulyar sürət Bu an və sürətin müəyyən bir dəyərə malik olması ehtimalını tapmağa çalışın.
Dəqiq kəmiyyət elmi olaraq, fizika müəyyən kəmiyyətlər arasında əlaqələr quran tənliklərə universal əmsallar kimi daxil edilən çox mühüm sabitlər toplusu olmadan edə bilməz. Bunlar fundamental sabitlərdir, bunun sayəsində bu cür əlaqələr invariant olur və müxtəlif miqyaslarda fiziki sistemlərin davranışını izah edə bilir.
Kainatımızın materiyasına xas olan xassələri xarakterizə edən belə parametrlər arasında Boltzman sabiti, bir sıra ən vacib tənliklərə daxil edilmiş kəmiyyətdir. Lakin onun xüsusiyyətləri və əhəmiyyətinə nəzər salmazdan əvvəl onun adını daşıyan alim haqqında bir neçə kəlmə deməyə bilməzsən.
Ludwig Boltzmann: elmi nailiyyətlər
19-cu əsrin ən böyük alimlərindən biri, avstriyalı Lüdviq Boltsman (1844-1906) statistik mexanikanın yaradıcılarından biri olmaqla molekulyar kinetik nəzəriyyənin inkişafına mühüm töhfə vermişdir. O, erqodik fərziyyənin, ideal qazın təsvirində statistik metodun və fiziki kinetikanın əsas tənliyinin müəllifi olmuşdur. O, termodinamika (Boltzmanın H-teoremi, termodinamikanın ikinci qanunu üçün statistik prinsip), şüalanma nəzəriyyəsi (Stefan-Boltzman qanunu) məsələləri üzərində çox işləmişdir. O, öz əsərlərində elektrodinamika, optika və fizikanın digər sahələrinin bəzi məsələlərinə də toxunmuşdur. Onun adı aşağıda müzakirə olunacaq iki fiziki sabitdə əbədiləşdirilib.
Lüdviq Boltsman maddənin atom-molekulyar quruluşu nəzəriyyəsinin inamlı və ardıcıl tərəfdarı idi. Bir çox fiziklərin atomları və molekulları lazımsız abstraksiya, ən yaxşı halda hesablamaların rahatlığı üçün adi cihaz hesab etdikləri dövrün elmi ictimaiyyətində o, uzun illər bu fikirlərin yanlış anlaşılması və rədd edilməsi ilə mübarizə aparmalı oldu. Ağrılı bir xəstəlik və mühafizəkar həmkarlarının hücumları Boltzmannı ağır depressiyaya saldı, buna dözə bilməyən görkəmli alimin intiharına səbəb oldu. Boltzmanın büstünün üstündəki qəbir abidəsində onun xidmətlərinin tanınması əlaməti olaraq S = k∙logW tənliyi həkk olunub - onun səmərəli fəaliyyətinin nəticələrindən biri. elmi fəaliyyət. Bu tənlikdəki k sabiti Boltsman sabitidir.
Molekulların enerjisi və maddənin temperaturu
Temperatur anlayışı müəyyən bir cismin istilik dərəcəsini xarakterizə etməyə xidmət edir. Fizikada bir maddənin hissəciklərinin istilik hərəkətinin enerjisinin miqdarını əks etdirən bir ölçü kimi temperatur haqqında molekulyar kinetik nəzəriyyənin qənaətinə əsaslanan mütləq temperatur şkalası istifadə olunur (əlbəttə ki, orta kinetik enerji deməkdir). hissəciklər dəsti).
Həm SI joule, həm də CGS sistemində istifadə olunan erq molekulların enerjisini ifadə etmək üçün çox böyük vahidlərdir və praktikada temperaturu bu şəkildə ölçmək çox çətin idi. Rahat bir temperatur vahidi dərəcədir və ölçmə dolayı yolla, bir maddənin dəyişən makroskopik xüsusiyyətlərini - məsələn, həcmi qeyd etməklə həyata keçirilir.

Enerji və temperatur necə bağlıdır?
Normala yaxın temperatur və təzyiqlərdə real maddənin hallarını hesablamaq üçün ideal qaz modelindən uğurla istifadə olunur, yəni molekulyar ölçüsü müəyyən miqdarda qazın tutduğu həcmdən xeyli kiçik olan qaz modeli ilə qazın arasındakı məsafədən hissəciklər onların qarşılıqlı təsir radiusunu əhəmiyyətli dərəcədə üstələyir. Kinetik nəzəriyyənin tənliklərinə əsasən, belə hissəciklərin orta enerjisi E av = 3/2∙kT kimi müəyyən edilir, burada E - kinetik enerji, T - temperatur, 3/2∙k isə təqdim edilən mütənasiblik əmsalıdır. Boltzmann. Buradakı 3 rəqəmi üç fəza ölçüsündə molekulların translyasiya hərəkətinin sərbəstlik dərəcələrinin sayını xarakterizə edir.
Daha sonra Avstriya fizikinin şərəfinə Boltzman sabiti adlandırılan k dəyəri bir joule və ya erq-in nə qədər bir dərəcə ehtiva etdiyini göstərir. Başqa sözlə, onun dəyəri bir atomlu ideal qazın bir hissəciyinin istilik xaotik hərəkətinin enerjisinin temperaturun 1 dərəcə artması ilə orta hesabla statistik olaraq nə qədər artdığını müəyyən edir.

Bir dərəcə bir jouldən neçə dəfə kiçikdir?
Bu sabitin ədədi qiymətini almaq olar fərqli yollar məsələn, ideal qaz tənliyindən istifadə edərək mütləq temperaturun və təzyiqin ölçülməsi və ya Brown hərəkət modelindən istifadə etməklə. Hazırkı bilik səviyyəsində bu dəyərin nəzəri çıxarılması mümkün deyil.
Boltsman sabiti 1,38 × 10 -23 J/K-a bərabərdir (burada K - kelvindir, mütləq temperatur şkalası üzrə dərəcədir). 1 mol ideal qazda (22,4 litr) olan hissəciklər qrupu üçün enerjinin temperaturla əlaqəsi (universal qaz sabiti) əmsalı Boltsman sabitini Avoqadro sayına (moldakı molekulların sayı) vurmaqla əldə edilir: R = kN. A, və 8,31 J/(mol∙kelvin) təşkil edir. Lakin sonuncudan fərqli olaraq, Boltsman sabiti təbiətcə daha universaldır, çünki o, digər mühüm əlaqələrə daxil olur və eyni zamanda başqa fiziki sabiti təyin etməyə xidmət edir.
Molekulyar enerjilərin statistik paylanması
Maddənin makroskopik halları böyük hissəciklər toplusunun davranışının nəticəsi olduğundan, statistik metodlardan istifadə etməklə təsvir edilir. Sonuncu, qaz molekullarının enerji parametrlərinin necə paylandığını öyrənməyi də əhatə edir:
- Kinetik enerjilərin (və sürətlərin) Maksvelian paylanması. O göstərir ki, tarazlıq vəziyyətində olan qazda əksər molekullar ən çox ehtimal olunan sürət v = √(2kT/m 0) yaxın sürətlərə malikdirlər, burada m 0 molekulun kütləsidir.
- Boltzmann hər hansı qüvvələr sahəsində yerləşən qazlar üçün potensial enerjilərin paylanması, məsələn, Yerin cazibə qüvvəsi. Bu, iki amil arasındakı əlaqədən asılıdır: Yerə cazibə və qaz hissəciklərinin xaotik istilik hərəkəti. Nəticədə molekulların potensial enerjisi nə qədər az olarsa (planetin səthinə yaxındır), onların konsentrasiyası bir o qədər yüksək olur.

Hər iki statistik üsul e - E/ kT eksponensial amildən ibarət Maksvell-Boltzman paylanmasına birləşdirilir, burada E kinetik və potensial enerjilərin cəmidir, kT isə Boltsman sabiti ilə idarə olunan istilik hərəkətinin artıq məlum olan orta enerjisidir.
Sabit k və entropiya
Ümumi mənada entropiya termodinamik prosesin dönməzliyinin ölçüsü kimi xarakterizə edilə bilər. Bu dönməzlik enerjinin dağılması - dağılması ilə bağlıdır. Boltsmann təklif etdiyi statistik yanaşmada entropiya fiziki sistemin vəziyyətini dəyişmədən həyata keçirə biləcəyi üsulların sayının funksiyasıdır: S = k∙lnW.
Burada k sabiti sistemin tətbiqi variantlarının və ya mikro vəziyyətlərin bu sayının (W) artması ilə entropiya artımının miqyasını müəyyən edir. rəhbərlik edən Maks Plank bu formula Kimə müasir görünüş, və k sabitinə Boltzmann adının verilməsini təklif etdi.

Stefan-Boltzmann radiasiya qanunu
Mütləq qara cismin energetik parlaqlığının (səth vahidinə düşən şüalanma gücünün) onun temperaturundan necə asılı olduğunu müəyyən edən fiziki qanun j = σT 4 formasına malikdir, yəni cismin öz temperaturunun dördüncü qüvvəsi ilə mütənasib olaraq emissiya edir. Bu qanun, məsələn, astrofizikada istifadə olunur, çünki ulduzların şüalanması xüsusiyyətlərinə görə qara cisim şüalanmasına yaxındır.
Bu əlaqədə fenomenin miqyasını idarə edən başqa bir sabit var. Bu, təxminən 5,67 × 10 -8 Vt/(m 2 ∙K 4) olan Stefan-Boltzman sabiti σ-dir. Onun ölçüsünə kelvin daxildir - bu o deməkdir ki, Boltsman sabiti k burada da iştirak edir. Həqiqətən, σ dəyəri (2π 2 ∙k 4)/(15c 2 h 3) kimi müəyyən edilir, burada c işığın sürəti və h Plank sabitidir. Beləliklə, Boltsman sabiti digər dünya sabitləri ilə birləşərək yenidən enerji (güc) və temperaturu birləşdirən bir kəmiyyət təşkil edir - bu halda radiasiya ilə əlaqədar.

Boltsman sabitinin fiziki mahiyyəti
Artıq yuxarıda qeyd olundu ki, Boltsman sabiti əsas sabitlər deyilənlərdən biridir. Məsələ təkcə ondan ibarət deyil ki, o, mikroskopik hadisələrin xüsusiyyətləri arasında əlaqə yaratmağa imkan verir molekulyar səviyyə makrokosmosda müşahidə olunan proseslərin parametrləri ilə. Və təkcə bu sabitin bir sıra vacib tənliklərə daxil olması deyil.
Onun nəzəri cəhətdən əldə edilə biləcəyi hər hansı fiziki prinsipin olub-olmaması hazırda məlum deyil. Başqa sözlə desək, heç nədən nəticə çıxmır ki, verilmiş sabitin qiyməti məhz belə olmalıdır. Biz hissəciklərin kinetik enerjisinə uyğunluq ölçüsü kimi dərəcə əvəzinə başqa kəmiyyətlərdən və digər vahidlərdən istifadə edə bilərik, onda ədədi dəyər sabit fərqli olardı, lakin sabit dəyər olaraq qalacaqdı. Bu cür digər fundamental kəmiyyətlərlə - məhdudlaşdırıcı sürət c, Plank sabiti h, elementar yük e, qravitasiya sabiti G - elm Boltzman sabitini dünyamızın verilmiş bir hissəsi kimi qəbul edir və ondan fiziki hərəkətlərin nəzəri təsviri üçün istifadə edir. onda baş verən proseslər.
Boltzman sabiti temperaturu molekulların kinetik enerjisi ilə birləşdirərək makrokosmosdan mikrokosmosa körpü qurur.
Lüdviq Boltzman qazların molekulyar kinetik nəzəriyyəsinin yaradıcılarından biridir ki, onun əsasında bir tərəfdən atomların və molekulların hərəkəti, digər tərəfdən isə maddənin temperatur və təzyiq kimi makroskopik xüsusiyyətləri arasındakı əlaqənin müasir mənzərəsi göstərilir. digəri isə əsaslanır. Bu şəkildə qazın təzyiqi qaz molekullarının qabın divarlarına elastik təsirləri ilə, temperatur isə molekulların hərəkət sürəti (daha doğrusu, onların kinetik enerjisi) ilə müəyyən edilir.Molekullar nə qədər sürətlə hərəkət edərsə, o qədər çox olar. daha yüksək temperatur.
Boltzman sabiti mikro dünyanın xüsusiyyətlərini makrodünyanın xüsusiyyətləri ilə - xüsusən də termometr oxunuşları ilə birbaşa əlaqələndirməyə imkan verir. Bu əlaqəni quran əsas düstur budur:
1/2 mv 2 = kT
Harada m Və v— müvafiq olaraq kütlə və orta sürəti qaz molekullarının hərəkəti, T qazın temperaturudur (mütləq Kelvin şkalası üzrə) və k — Boltsman sabiti. Bu tənlik atom səviyyəsinin xüsusiyyətlərini (sol tərəfdə) ilə əlaqələndirərək iki dünya arasında körpü yaradır. həcm xassələri(sağ tərəfdə), insan alətləri ilə ölçülə bilən, bu halda termometrlər. Bu əlaqə Boltzman sabiti ilə təmin edilir k, 1,38 x 10 -23 J/K-a bərabərdir.
Mikro dünya ilə makro dünya hadisələri arasındakı əlaqəni öyrənən fizikanın bölməsi adlanır. statistik mexanika. Bu bölmədə Boltsman sabitini daxil etməyən tənlik və ya düstur demək olar ki, yoxdur. Bu əlaqələrdən biri avstriyalının özü tərəfindən yaradılmışdır və bu, sadəcə olaraq adlandırılır Boltsman tənliyi:
S = k log səh + b
Harada S— sistemin entropiyası ( santimetr. Termodinamikanın ikinci qanunu) səh- sözdə statistik çəki(Çox mühüm element statistik yanaşma) və b- başqa bir sabit.
Lüdviq Boltsman bütün həyatı boyu sözün əsl mənasında öz dövrünü qabaqlamış, maddənin quruluşunun müasir atom nəzəriyyəsinin əsaslarını inkişaf etdirmiş, dövrünün böyük mühafizəkar əksəriyyəti ilə şiddətli mübahisələrə girmişdir. elmi ictimaiyyət, atomları yalnız bir konvensiya hesab edən, hesablamalar üçün əlverişli, lakin obyektlər deyil real dünya. Onun statistik yanaşması göründükdən sonra da ən kiçik bir anlayışa cavab vermədikdə xüsusi nəzəriyyə nisbilik, Boltzmann dərin depressiya anında intihar etdi. Boltzmanın tənliyi onun qəbir daşı üzərində həkk olunub.
Boltzmann, 1844-1906
Avstriyalı fizik. Vyanada dövlət qulluqçusu ailəsində anadan olub. Vyana Universitetində Josef Stefan ilə eyni kursda oxuyub ( santimetr. Stefan-Boltzman qanunu). 1866-cı ildə müdafiə olunaraq elmi fəaliyyətini davam etdirərək, vəzifələrdə çalışmışdır fərqli vaxt Qraz, Vyana, Münhen və Leypsiq universitetlərində fizika və riyaziyyat kafedralarında professorlar. Atomların mövcudluğu həqiqətinin əsas tərəfdarlarından biri olmaqla, o, atom səviyyəsində hadisələrin necə təsir etdiyinə işıq tutan bir sıra görkəmli nəzəri kəşflər etdi. fiziki xassələri və maddənin davranışı.
Stefan-Boltzman qanununa görə, inteqral yarımkürəvi şüalanmanın sıxlığı E 0 yalnız temperaturdan asılıdır və mütləq temperaturun dördüncü dərəcəsinə mütənasib olaraq dəyişir T:
Stefan-Boltzman sabiti σ 0 mütləq qara cismin tarazlıq istilik şüalanmasının həcm sıxlığını təyin edən qanuna daxil edilmiş fiziki sabitdir:

Tarixi olaraq, Stefan-Boltzmann qanunu Plankın radiasiya qanunundan əvvəl tərtib edilmişdir və nəticədə ondan irəli gəlir. Plank qanunu şüalanmanın spektral axınının sıxlığından asılılığını müəyyən edir E 0 dalğa uzunluğu λ və temperaturda T:

burada λ – dalğa uzunluğu, m; ilə=2,998 10 8 m/s – vakuumda işığın sürəti; T- bədən istiliyi, K;
h= 6,625 ×10 -34 J×s – Plank sabiti.
Fiziki sabit k, universal qaz sabitinin nisbətinə bərabərdir R=8314J/(kq×K) Avoqadro nömrəsinə N.A.=6,022× 10 26 1/(kq×mol):

Müxtəlif sistem konfiqurasiyalarının sayı N verilmiş ədədlər toplusu üçün hissəciklər n i(hissəciklərin sayı i-e i enerjisinin uyğun olduğu vəziyyət) qiymətə mütənasibdir:

Böyüklük W paylanmasının bir sıra yolları var N enerji səviyyələrinə görə hissəciklər. Əgər (6) əlaqəsi doğrudursa, ilkin sistemin Boltzman statistikasına tabe olduğu hesab edilir. Rəqəmlər dəsti n i, hansı nömrə W maksimum, ən tez-tez baş verir və ən ehtimal paylanmasına uyğundur.
Fiziki kinetika– statistik qeyri-tarazlıq sistemlərində proseslərin mikroskopik nəzəriyyəsi.
Çoxlu sayda hissəciklərin təsviri ehtimal metodlarından istifadə etməklə uğurla həyata keçirilə bilər. Monatomik qaz üçün bir sıra molekulların vəziyyəti onların koordinatları və müvafiq koordinat oxları üzrə sürət proyeksiyalarının qiymətləri ilə müəyyən edilir. Riyazi olaraq bu, hissəciyin verilmiş vəziyyətdə olma ehtimalını xarakterizə edən paylama funksiyası ilə təsvir edilir:

koordinatları +d, sürətləri isə +d diapazonunda olan d d həcmində molekulların gözlənilən sayıdır.
Əgər molekulların kinetik enerjisi ilə müqayisədə qarşılıqlı təsirinin zamanla orta potensial enerjisini nəzərə almamaq olarsa, qaz ideal adlanır. Bu qazdakı molekulların sərbəst yolunun axının xarakterik ölçüsünə nisbəti ideal qaza Boltsman qazı deyilir. Ləlbəttə, yəni.

çünki yolun uzunluğu tərs mütənasibdir nd 2(n ədədi sıxlıq 1/m 3, d molekulun diametri, m).
Ölçü

çağırdı H-Vahit həcm üçün Boltsman funksiyası, verilmiş vəziyyətdə qaz molekulları sisteminin aşkarlanması ehtimalı ilə bağlıdır. Hər bir vəziyyət, nəzərdən keçirilən molekulların faza sahəsinin bölünə biləcəyi altı ölçülü kosmik sürət hüceyrələrinin müəyyən sayda doldurulmasına uyğundur. işarə edək W nəzərdən keçirilən fəzanın birinci hüceyrəsində N 1 molekulların olma ehtimalı, ikincisində N 2 və s.
Ehtimalın mənşəyini təyin edən sabitə qədər aşağıdakı əlaqə etibarlıdır:
 ,
,
Harada 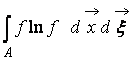 – Kosmos regionunun H funksiyası A qazla zəbt olunub. (9)-dan aydın olur ki W Və H bir-birinə bağlı, yəni. vəziyyətin ehtimalının dəyişməsi H funksiyasının müvafiq təkamülünə gətirib çıxarır.
– Kosmos regionunun H funksiyası A qazla zəbt olunub. (9)-dan aydın olur ki W Və H bir-birinə bağlı, yəni. vəziyyətin ehtimalının dəyişməsi H funksiyasının müvafiq təkamülünə gətirib çıxarır.

Boltzmann prinsipi entropiya arasında əlaqə yaradır S fiziki sistem və termodinamik ehtimal W onun dövlətləri:

(nəşrə görə nəşr edilmişdir: Kogan M.N. Nadir qazın dinamikası. - M.: Nauka, 1967.)
CUBE-nin ümumi görünüşü:

molekula təsir edən müxtəlif sahələrin (qravitasiya, elektrik, maqnit) olması səbəbindən kütlə qüvvəsi haradadır; J- toqquşma inteqralı. Boltzman tənliyinin məhz bu termini molekulların bir-biri ilə toqquşmasını və qarşılıqlı təsir göstərən hissəciklərin sürətlərindəki müvafiq dəyişiklikləri nəzərə alır. Toqquşma inteqralı beşölçülü inteqraldır və aşağıdakı quruluşa malikdir:

Heç bir tangensial qüvvələrin yaranmadığı molekulların toqquşması üçün inteqral (13) olan (12) tənliyi alınmışdır, yəni. toqquşan hissəciklər mükəmməl hamar hesab olunur.
Qarşılıqlı təsir zamanı molekulların daxili enerjisi dəyişmir, yəni. bu molekulların mükəmməl elastik olduğu qəbul edilir. Sürətləri olan və bir-biri ilə toqquşmadan əvvəl (toqquşma) (şəkil 1) və toqquşmadan sonra müvafiq olaraq sürətləri və . Sürət fərqinə nisbi sürət deyilir, yəni. . Aydındır ki, hamar bir elastik toqquşma üçün. Paylama funksiyaları f 1 ", f", f 1 , f toqquşmalardan sonra və əvvəl müvafiq qrupların molekullarını təsvir edin, yəni. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

düyü. 1. İki molekulun toqquşması.
(13) toqquşan molekulların bir-birinə nisbətən yerini xarakterizə edən iki parametr daxildir: b və ε; b– nişan alma məsafəsi, yəni. qarşılıqlı təsir olmadıqda molekulların yaxınlaşacağı ən kiçik məsafə (şək. 2); ε toqquşma bucaq parametri adlanır (şək. 3). İnteqrasiya bitdi b 0-dan ¥-ə qədər və 0-dan 2p-ə qədər ((12)-də iki xarici inteqral) vektora perpendikulyar qüvvələr qarşılıqlı təsirinin bütün müstəvisini əhatə edir.

düyü. 2. Molekulların hərəkət trayektoriyası.

düyü. 3. Silindrik koordinat sistemində molekulların qarşılıqlı təsirinin nəzərə alınması: z, b, ε
Boltsman kinetik tənliyi aşağıdakı fərziyyələr və fərziyyələr əsasında alınır.
1. Hesab olunur ki, əsasən iki molekulun toqquşması baş verir, yəni. üç və eyni vaxtda toqquşmaların rolu daha çox molekulları əhəmiyyətsizdir. Bu fərziyyə analiz üçün yuxarıda sadəcə olaraq paylanma funksiyası adlanan tək hissəcikli paylanma funksiyasından istifadə etməyə imkan verir. Üç molekulun toqquşmasını nəzərə almaq tədqiqatda iki hissəcikli paylama funksiyasından istifadə etmək zərurətinə gətirib çıxarır. Müvafiq olaraq, təhlil əhəmiyyətli dərəcədə mürəkkəbləşir.
2. Molekulyar xaos fərziyyəsi. Faza nöqtəsində 1-ci hissəciyi və faza nöqtəsində 2-ci hissəciyi aşkar etmək ehtimallarının bir-birindən asılı olmaması ilə ifadə edilir.
3. Molekulların istənilən təsir məsafəsi ilə toqquşması eyni dərəcədə ehtimal olunur, yəni. paylama funksiyası qarşılıqlı diametrdə dəyişmir. Qeyd etmək lazımdır ki, təhlil edilən element kiçik olmalıdır ki f bu element daxilində dəyişmir, lakin eyni zamanda nisbi dalğalanma ~ böyük olmasın. Toqquşma inteqralının hesablanmasında istifadə olunan qarşılıqlı təsir potensialları sferik simmetrikdir, yəni. ![]() .
.
Maksvell-Boltzman paylanması
Qazın tarazlıq vəziyyəti Boltsman kinetik tənliyinin dəqiq həlli olan mütləq Maksvell paylanması ilə təsvir olunur:

burada m molekulun kütləsidir, kq.
Ümumi yerli Maksvell paylanması, başqa bir şəkildə Maksvell-Boltzman paylanması adlanır:

qaz bütövlükdə sürətlə hərəkət etdikdə və n, T dəyişənləri koordinatdan asılıdır.
və vaxt t.
Yerin qravitasiya sahəsində Boltzman tənliyinin dəqiq həlli aşağıdakıları göstərir:

Harada n 0 = Yer səthində sıxlıq, 1/m3; g– cazibə sürəti, m/s 2 ; h– hündürlük, m Formula (16) Boltsman kinetik tənliyinin ya qeyri-məhdud fəzada, ya da bu paylanmanı pozmayan sərhədlərin mövcudluğunda dəqiq həllidir, eyni zamanda temperatur da sabit qalmalıdır.
Bu səhifə Puzina Yu.Yu tərəfindən hazırlanmışdır. tərəfindən dəstəklənir Rusiya Fondu Fundamental Tədqiqatlar – layihə № 08-08-00638.
